Переведем единицы измерения в систему СИ:
1 атм» 98 кПа;
p1 = 4 атм = 3,92×105 Па;
p2 = 16 атм = 15,68×105 Па;
p3 = 6 атм = 5,88×105 Па;
Т1 = 373 К.
3.3 Определяем параметры состояния p, v, T, u, i для основных точек цикла:
Для точки 1 дано  .
.
Из уравнения Клапейрона  следует, что
следует, что
 .
.
Находим внутреннюю энергию  и энтальпию
и энтальпию  при температуре
при температуре  :
:

Для точки 2 дано  .
.
Для определения  используем уравнение адиабаты рvk = const, откуда
используем уравнение адиабаты рvk = const, откуда
 .
.
Из соотношения  найдем
найдем
 .
.
Для определения температуры  используем уравнение состояния в виде
используем уравнение состояния в виде  :
:
 .
.
Находим внутреннюю энергию  и энтальпию
и энтальпию  при температуре
при температуре
 :
:

Для точки 3 дано p3 = 5,88×105 Па, Т3 = Т2 = 563 К.
Из уравнения Клапейрона  следует, что
следует, что
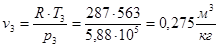 .
.
Находим внутреннюю энергию 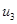 и энтальпию
и энтальпию  при температуре
при температуре  :
:
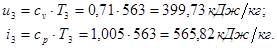
Для точки 4 дано p1 = p4 = 3,92×105 Па.
Для определения  используем уравнение адиабаты
используем уравнение адиабаты  , откуда
, откуда
 ,
,
где  , откуда
, откуда 
Для определения  используем уравнение состояния:
используем уравнение состояния:
 .
.
Находим внутреннюю энергию 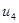 и энтальпию
и энтальпию  при температуре
при температуре  :
:

3.4 Определение параметров p, v, T, u, i для дополнительных точек цикла:
Для точки 1' дано  Определим
Определим  .
.
Для определения  используем уравнение pvk = const:
используем уравнение pvk = const:
 , где
, где  .
.
Откуда  .
.
Для определения температуры  используем уравнение состояния
используем уравнение состояния  , откуда:
, откуда:
 .
.
Находим внутреннюю энергию  и энтальпию
и энтальпию  при температуре
при температуре  :
:

Для точки 1'' дано 
Для определения  используем уравнение рvk = const, из которого:
используем уравнение рvk = const, из которого:
 ,
,
где  . Откуда
. Откуда
 .
.
Для определения температуры  используем уравнение состояния:
используем уравнение состояния:
 .
.
Находим внутреннюю энергию  и энтальпию
и энтальпию  при температуре
при температуре  :
:
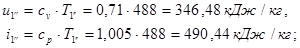
Для точки 2' дано 
Из уравнения Клапейрона  следует, что
следует, что
 .
.
Находим внутреннюю энергию 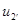 и энтальпию
и энтальпию  при температуре
при температуре  :
:

Для точки 2'' дано  .
.
Из уравнения Клапейрона  следует, что
следует, что
 .
.
Находим внутреннюю энергию  и энтальпию
и энтальпию  при температуре
при температуре
 :
: 
Для точки 3' дано  .
.
Для определения  используем уравнение рvk = const, согласно которому
используем уравнение рvk = const, согласно которому
 , где
, где 
откуда  .
.
Для определения температуры  используем уравнение состояния, из которого
используем уравнение состояния, из которого

Находим внутреннюю энергию  и энтальпию
и энтальпию  при температуре
при температуре  :
:

Для точки 4' дано  , при температуре
, при температуре
 определим
определим  .
.
Для определения  используем уравнение состояния:
используем уравнение состояния:
 .
.
Находим внутреннюю энергию  и энтальпию
и энтальпию  при температуре
при температуре  :
:

Для точки 4'' дано  , при температуре
, при температуре  определим
определим  Для определения
Для определения  используем уравнение состояния:
используем уравнение состояния:
 .
.
Находим внутреннюю энергию  и энтальпию
и энтальпию  при температуре
при температуре  :
:

3.5 Для каждого процесса, входящего в состав цикла, найдем n, c, Du, Di, Ds, q, l.
Определим перечисленные величины:
Для адиабатного процесса 1-2 при  ;
;

 ,
,
так как для адиабаты
dq = 0, то c = 0; 
Адиабатный процесс протекает без теплообмена с окружающей средой, поэтому q = 0.
Работу процесса определим из уравнения первого закона термодинамики:  так как
так как 
то  ;
;
Для изотермического процесса 2-3 при Т = const показатель политpопы  .
.
Теплоемкость  , так как для изотермы dТ = 0, то
, так как для изотермы dТ = 0, то  ;
;

Удельное количество теплоты, участвующее в изотермическом процессе, равно:  при изотермическом процессе работа численно равна количеству теплоты:
при изотермическом процессе работа численно равна количеству теплоты: 
Для адиабатного процесса 3-4 пpи  ;
; 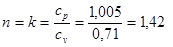
 , так как для адиабаты dq = 0, то c = 0;
, так как для адиабаты dq = 0, то c = 0;

Адиабатный процесс протекает без теплообмена с окружающей средой, поэтому q = 0.
Работу процесса определим из уравнения первого закона термодинамики:
 так как
так как  то
то  .
.
Для изобарического процесса 4-1 при n = 0 и теплоемкости 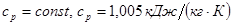



Для адиабатного процесса 1-1' при  ;
;

 , так как для адиабаты dq = 0, то c = 0;
, так как для адиабаты dq = 0, то c = 0;

Адиабатный процесс протекает без теплообмена с окружающей средой, поэтому q = 0.
Работу процесса определим из уравнения первого закона термодинамики:  так как
так как  то
то  .
.
Для адиабатного процесса 1'-1'' при  ;
;

 , так как для адиабаты dq = 0, то c = 0;
, так как для адиабаты dq = 0, то c = 0;

Адиабатный процесс протекает без теплообмена с окружающей средой, поэтому q = 0.
Работу процесса определим из уравнения первого закона термодинамики:  так как
так как  то
то  .
.
Для изотермического процесса 2-2' при Т = const показатель политропы  .
.
Теплоемкость  , так как для изотермы dТ = 0, то
, так как для изотермы dТ = 0, то  ;
;

Удельное количество теплоты, участвующее в изотермическом процессе, равно: 
при изотермическом процессе работа численно равна количеству теплоты

Для изотермического процесса 2'-2'' при Т = const показатель политропы  .
.
Теплоемкость  , так как для изотермы dТ = 0, то
, так как для изотермы dТ = 0, то  ;
;

Удельное количество теплоты, участвующее в изотермическом процессе, равно: 
при изотермическом процессе работа численно равна количеству теплоты

Для адиабатного процесса 3-3' при  ;
;
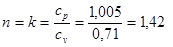
 , так как для адиабаты dq = 0, то c = 0;
, так как для адиабаты dq = 0, то c = 0;

Адиабатный процесс протекает без теплообмена с окружающей средой, поэтому q = 0.
Работу процесса определим из уравнения первого закона термодинамики:
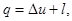 так как
так как  то
то 
Для изобарического процесса 4-4' при n = 0 и теплоемкости
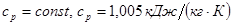



Для изобарического процесса 4'-4'' при n = 0 и теплоемкости 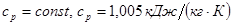



3.6 Определяем работу цикла lц, qц, термический к.п.д. ht, а так же среднее индикаторное давление pi:

Таблица 3.1. Термодинамические параметры процесса в точках
| p, кПа | v, м3/кг | Т, К | u, кДж/кг | i, кДж/кг | |
| 0,273 | 246,83 | 374,86 | |||
| 0,103 | 399,73 | 565,82 | |||
| 0,275 | 399,73 | 565,82 | |||
| 0,365 | 354,29 | 501,5 |
Таблица 3.2. Термодинамические параметры процесса в дополнительных точках
| p, кПа | v, м3/кг | Т, К | u, кДж/кг | i, кДж/кг | |
| 1' | 0,233 | 282,58 | 399,99 | ||
| 1'' | 0,143 | 346,48 | 490,44 | ||
| 2' | 0,188 | 399,73 | 565,82 | ||
| 2'' | 702,5 | 0,230 | 399,73 | 565,82 | |
| 3' | 0,313 | 379,14 | 536,67 | ||
| 4' | 0,329 | 319,5 | 452,25 | ||
| 4'' | 0,293 |
Таблица 3.3. Изменение термодинамических параметров процесса в основных точках
| Процессы | n | Du, кДж/кг | Di, кДж/кг | Ds, кДж/кг×К | q, кДж/кг | l, кДж/кг |
| 1-2 | 1,42 | 152,90 | 190,96 | 0,00 | 0,00 | -152,90 |
| 2-3 | 0,00 | 0,00 | 0,3 | 158,77 | 158,77 | |
| 3-4 | 1,42 | -45,44 | -64,32 | 0,00 | 0,00 | 45,44 |
| 4-1 | -107,46 | -126,64 | -0,3 | -126,63 | -19,17 | |
| S Du =0 | S Di =0 | S Ds =0 | S Dq =32,14 | S Dl =32,14 |
Таблица 3.4. Изменение термодинамических параметров процесса в дополнительных точках
| Процессы | n | Du, кДж/кг | Di, кДж/кг | Ds, кДж/кг×К | q, кДж/кг | l, кДж/кг |
| 1-1' | 1,42 | 35,75 | 25,13 | 0,00 | 0,00 | -35,75 |
| 1'-1'' | 1,42 | 63,9 | 90,45 | 0,00 | 0,00 | -63,9 |
| 2-2' | 0,00 | 0,00 | 0,17 | 95,71 | 95,71 | |
| 2'-2'' | 0,00 | 0,00 | 0,057 | 32,091 | 32,091 | |
| 3-3' | 1,42 | -20,59 | -29,15 | 0,00 | 0,00 | 20,59 |
| 4-4' | 0,00 | -34,79 | -49,25 | -0,104 | -49,24 | -14,45 |
| 4'-4'' | 0,00 | -35,50 | -50,25 | -0,118 | -50,25 | -14,75 |

Рис. 3.2 Рабочая диаграмма процесса

Рис. 3.3 Тепловая диаграмма процесса






