Лабораторная работа.
Тема: Кислород и водород.
Цель работы: Получить в лабораторных условиях кислород и водород, изучить их химические свойства. Изучить свойства перекиси водорода.
Приборы и реактивы: перманганат калия кристаллический; сера; древесный уголь; цинк гранулированный; алюминий гранулированный; 20%-й раствор серной кислоты; раствор гидроксида натрия 20%-й; пероксид водорода, 3%; диоксид марганца; раствор иодида калия; крахмальный клейстер;гидрат окиси кальция; концентрированная соляная кислота; ложечка для сжигания; спиртовка; газоотводная трубка; пробирки; штатив для пробирок; стеклянные палочки.
Ход работы
ОПЫТ 1. Получение и собирание кислорода, изучение его свойств.
При проведении опытов с кислородом не должно быть рядом зажженной спиртовки!
1.1. Получение О2.
В основе получения кислорода в лаборатории лежит реакция разложения перманганата калия (1):
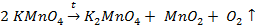 (1)
(1)
- Укрепите горизонтально в зажиме штатива сухую пробирку с 0,5 г кристаллического KMnO4 (рис.1).

Рис. 1. Получение кислорода методом вытеснения воздуха
- Закройте пробирку с газоотводной трубкой, конец которой опустите на дно сухой пробирки.
- Подогрейте пробирку целиком, а затем KMnO4.
- Испытайте выделяющийся газ тлеющей лучинкой. Для этого подожгите лучинку и погасите ее. Поднесите тлеющую лучинку к краю пробирки.
1.2. Изучение свойств О2.
- Положите в ложечку для сжигания кусочек серы, подожгите ее на пламени спиртовки (под тягой). Обратите внимание на цвет и размер пламени горящей серы. Внесите горящую серу в колбу с кислородом. Какие изменения в горении серы наблюдаются? Напишите уравнения реакции горения серы.
- Положите в ложечку для сжигания небольшой кусочек древесного угля, накалите на пламени спиртовки и внесите в колбу с кислородом. Как изменилась интенсивность горения угля в кислороде? Напишите уравнения реакции горения угля.
? Какой вывод о свойствах кислорода можно сделать на основании проведенных опытов? Как влияет на интенсивность горения веществ замена воздуха кислородом? Чем это объясняется?
ОПЫТ 2. Получение водорода и его горение.
1.1 Получение водорода при взаимодействии цинка и кислоты.
Водород получаем при взаимодействии активного металла (цинка) с серной кислотой (2):
 (2)
(2)
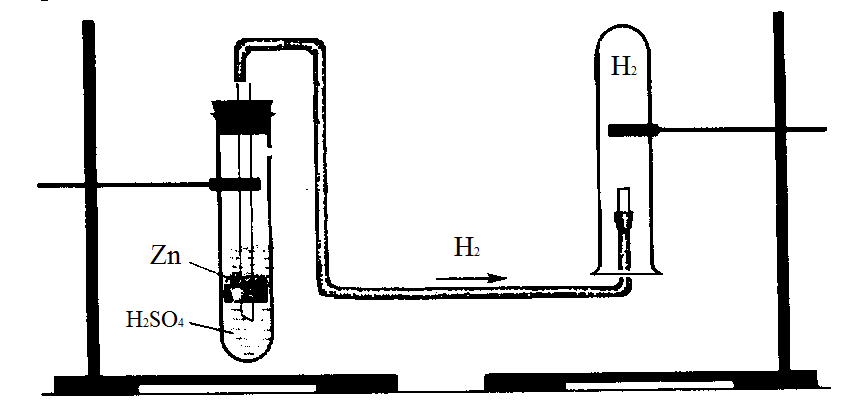
Рис. 2. Прибор для получения водорода
Собрать прибор (рис.2). Внесите в пробирку 5-6 кусочков цинка, прилить 15-20 мл 20%-го раствора H2SO4. Закройте пробирку пробкой с отводной трубкой (конец трубки должен быть оттянут) и, когда реакция пойдет бурно, подожгите выделяющийся из отводной трубки газ. Подержите над пламенем водорода холодную стеклянную воронку или часовое стекло (выполнять с лаборантом и преподавателем!). Что наблюдаете? Напишите уравнения окислительно-восстановительных реакций получения водорода и его горения. Можно ли получить водород действием серной и соляной кислоты на любой другой металл? Сделайте общий вывод.
1.2 Получение водорода при взаимодействии алюминия и щелочи.
Положить в пробирку несколько кусочков алюминия, прилить 2-3 мл 20%-го раствора NaOH. Если реакция идет плохо, осторожно нагреть пробирку. Определить какой газ выделяется.
Напишите уравнения реакций: взаимодействия алюминия с водой, оксида алюминия со щелочью с образованием тетрагидроксоалюмината натрия Na[Al(OH)4]. Почему алюминий не взаимодействует с водой в отсутствие щелочи?
ОПЫТ 3. Свойства пероксида водорода.
1.1 Разложение пероксида водорода.
Внесите в пробирку небольшое количетсво 3 %-ного раствора пероксида водорода и несколько кристаллов диоксида марганца, являющегося катализатором в данной реакции. Внесите в пробирку тлеющую лучинку. Какой газ выделяется? Уравнение реакции разложения пероксида водорода (3):
 (3)
(3)
1.2 Окислительные свойства пероксида водорода.
К раствору перекиси водорода прилить несколько капель раствора йодида калия. Что наблюдается? Разбавить раствор водой и внести в него 1-2 капли раствора крахмала. Что происходит. Методом электронного баланса уравнять реакцию (4):
 (4)
(4)
Контрольные вопросы
1. Запишите уравнения реакции в цепи превращений:
Na → NaОН → Аl(ОН)3 → Аl2О3 → Аl
2. Расставьте коэффициенты в уравнениях методом ионно-электронного баланса. Укажите окислитель и восстановитель:
а) КМnО4 + Н2О2+ Н2SО4 → К2SО4 + МnSО4 + О2 + Н2О;
б) Сl2 + Н2О2 → НСl + О2;
в) Н2О2 + НI → I2 + Н2О;
г) Н2О2 + СrСl3 + КОН → К2СrО4 + КСl + Н2О;
д) Н2О2 + Н2S → Н2SО4 + Н2О;
е) Н2О2 + НIО3 → I2 + О2 + Н2О.
3. Сколько литров водорода выделится при действии соляной кислоты на 112 г железа?






