Изучение нового материала.
План (слайд №2)
1. Состав молекулы аммиака
2. Строение молекулы аммиака
3. Водородная связь
4. Физические свойства аммиака
5. Химические свойства аммиака
а) аммиак-комплексообразователь.
б) аммиак-восстановитель
6. Получение аммиака
7. Применение аммиака
8. Закрепление
9. Домашнее задание
Состав молекулы аммиака
Учитель начинает свой рассказ об аммиаке с обращения внимания на несоответствие написания химической формулы аммиака принятым правилам степени окисления.
- запишите молекулярную формулу аммиака;
- укажите степень окисления элементов;
- дайте химически верное название и запись формулы аммиака.
NH3 = H3 +1N-3 нитрид водорода (слайд № 3)
Строение молекулы аммиака
Учащиеся представляют схему образования химической связи в молекуле.
- запишите молекулярную, электронную, структурную формулы молекулы аммиака.
- укажите вид химической связи в молекуле и способы образования,
- укажите смещение электронной плотности к более электроотрицательному элементу.
NH3 - молекулярная формула
ковалентная полярная связь, одинарная, по обменному механизму.
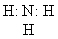 электронная формула (слайд № 4)
электронная формула (слайд № 4)
Водородная связь
Учитель акцентирует внимание ребят на неподеленной электронной паре атома азота, сдвиге электронной плотности в сторону гораздо более электроотрицательного атома азота и возникновении в молекуле аммиака на атоме азота частично отрицательного заряда, а на атоме водорода частично положительного.
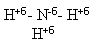 структурная формула (слайд № 5)
структурная формула (слайд № 5)
Учитель знакомит учащихся с новым для них видом химической связи – водородной связью, которая возникает между молекулами аммиака.
Отметьте особенности водородной связи:
1) между какими атомами возникает связь;
2) силу связи по сравнению с другими видами связи;
3) условное обозначению водородной связи;
4) следствие образования водородной связи в соединении.
Водородной называется связь между атомами водорода и атомами очень ЭО элементов, имеющих свободные электронные пары;
- слабее ковалентной связи в 10 – 20 раз;
- условно обозначается тремя точками;
- вещества с водородной связью обладают хорошей растворимостью в воде, повышается их температура кипения и плавления. (слайд № 6)
Получение аммиака
В промышленности аммиак получают прямым синтезом из простых веществ – азота и водорода. Реакция идет только в присутствии катализатора, при температуре 500 С0 и повышенном давлении.
Запишите уравнение реакции получение аммиака:
а) в промышленности
Дайте классификацию реакции по всем известным признакам и предложите оптимальные условия проведения реакции. Ответ: Реакция соединения, экзотермическая, гомогенная, обратимая, окислительно-восстановительная, каталитическая.
(слайд № 7)
б) в лаборатории
Для получения аммиака мы возьмем вещество которое находится в черном ящике. Прослушайте сообщение о данном веществе и попытайтесь отгадать, что это за вещество..
В черном ящике находится вещество, которое арабские алхимики получали из оазиса Амона, расположенного в пустыне Сахара. Это бесцветное кристаллическое вещество, которое они называли «нушадир». При растирании нушадира с гашеной известью и нагревании смеси выделялся газ с резким запахом, хорошо растворимый в воде. Алхимики заметили, что водный раствор этого газа, находясь рядом с соляной кислотой, начинал «дымить» и с течением времени все стеклянные сосуды рядом с ним покрывались белым налетом. Алхимики отметили и еще кое-что: когда раствор неизвестного газа добавляли к водному раствору медного купороса, то голубая окраска последнего становится интенсивно синей. Как объяснить эти явления? Запишите уравнения реакций и укажите их тип?
Ответ: (во время обсуждения идет презентация демонстрирующая опыты: «дым без огня», взаимодействие хлорида аммония с гидроксидом кальция, растворение аммиака в воде, «голубые цветы») В ящике соль хлорид аммония. «Нашадир»-это нашатырь (хлорид аммония), продукт естественного разложения мочи и испражнений верблюдов, караваны которых столетиями проходили через оазис.
Пполучение аммиака
При взаимодействии NH4Cl с гашеной известью- гидроксидом кальция Ca(OH)2 выделялся аммиак NH3
2NH4Cl + Ca(OH)2 = 2 NH3 + CaCl2 +2H2O
Собирание - в перевернутую кверху дном пробирку.
Распознавание аммиака:
а) по запаху;
б) по посинению влажной лакмусовой бумажки
в) по появлению белого дыма от поднесенной стеклянной палочки, смоченной HCl (конц.)
Физические свойства аммиака
С физическими свойствами аммиака учитель предлагает познакомиться учащимся самостоятельно по учебнику.
· изучите физические свойства аммиака по учебнику;
· рассчитайте его плотность по воздуху Dвозд = 29/МNН3;
· предложите способ собирания газа в лабораторных условиях.
NH3 – газ без цвета, с резким запахом, почти в два раза легче воздуха, при охлаждении до -33,6оС он сжижается, а при температуре -77,8оС превращается в твердое белое вещество, хорошо растворим в воде. (слайд №8)
Учитель разъясняет ребятам, что поскольку аммиак легче воздуха, то при выделении он будет улетать вверх. Поэтому, для того чтобы собрать аммиак, пробирку необходимо держать перевернутой дном.






