Степень гидролиза (h) – это отношение числа молекул, подвергшихся гидролизу, к общему числу молекул в растворе.
число гидролизованных молекул
 h =
h =
 общее число молекул
общее число молекул
Степень гидролиза зависит от концентрации (чем меньше концентрация, тем больше степень гидролиза), от температуры (с увеличением температуры степень гидролиза увеличивается). Для того, чтобы растворы не подвергались гидролизу, их необходимо хранить при более низкой температуре и в более высокой концентрации. Избежать гидролиза можно также путем подкисления или подщелачивания соответствующих растворов.
Гидролиз солей – процесс обратимый, поэтому к реакции гидролиза применим закон действия масс. Например, для гидролиза по иону CH3COO -
CH3COO - + H2O ® CH3COOH + OH –

[CH3COOH] [OH -]
 Кравн =.
Кравн =.
 [CH3COO -] [H2O]
[CH3COO -] [H2O]
Концентрация воды [H2O] практически постоянна, она может быть перенесена в левую часть уравнения и включена в константу равновесия. Умножив числитель и знаменатель правой части уравнения на [H +], получим константу гидролиза
[CH3COOH] [OH -] [H +]
 Кг = Кравн [H2O] = .
Кг = Кравн [H2O] = .
[CH3COO -] [H+]
Видно, что выражение для константы гидролиза состоит из величины ионного произведения воды Кв и константы диссоциации кислоты
Кв 10-14

 Кг = =.
Кг = =.
Ккисл Ккисл
Следовательно, чем меньше константа диссоциации кислоты, тем больше константа гидролиза Кг, тем сильнее положение равновесия реакции смещено вправо и тем выше щелочность раствора, т.е. больше значение рН.
Константа гидролиза соли слабого основания и сильной кислоты определяется по формуле
Кв 10-14

 Кг = =,
Кг = =,
Косн Косн
где Косн – константа диссоциации слабого основания.
Очевидно, что чем меньше константа диссоциации слабого основания, образующегося в результате гидролиза, тем выше константа гидролиза, тем больше кислотность раствора, т.е. меньше рН.
Константа гидролиза соли слабого основания и слабой кислоты равна
Кв
 Кг =.
Кг =.
Косн Ккисл
Как указано выше, реакция раствора при гидролизе солей, образованных слабыми кислотой и основанием, может быть и кислой, и щелочной (хотя ионы H+ и OH – в суммарное уравнение реакции гидролиза не входят). Это зависит от относительной силы образующихся слабых кислоты и основания.
Константа гидролиза есть величина постоянная для данной температуры и не зависит от концентрации ионов в растворе.
Выражение константы гидролиза любого типа включает ионное произведение воды и константы диссоциации образующихся слабых электролитов. Так как при повышении температуры Кдисс воды значительно в большей степени возрастает по сравнению с константами диссоциации слабых кислот и оснований, то при повышении температуры константа гидролиза увеличивается и равновесие гидролиза смещается вправо.
Константа гидролиза связана со степенью гидролиза уравнением
Кг = h2 C, откуда h = 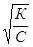 ,
,
где С – концентрация.
Гидролизу подвергаются разные вещества: соли, галогенангидриды, белки, углеводы, жиры и т.д. Разрушение горных пород в значительной мере зависит от гидролиза составляющих их минералов силикатов. В живых организмах происходит гидролиз белков, полисахаридов и других органических веществ. Состав и функция крови обусловлены гидролизом солей, растворимых в плазме.
Оборудование и реактивы: штатив с пробирками, стеклянные палочки, растворы солей, кристаллические вещества, дистиллированная вода, мерный цилиндр на 100 мл, термометр, фенолфталеин, универсальная индикаторная бумага.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
О п ы т 1. Реакция среды водного раствора соли. Определение рН
раствора при помощи универсального индикатора
Опыт выполняется по вариантам А, Б, В (табл. 2).
Таблица 2
| Вариант | Соль | |||
| А | Б | В | ||
| NaCl | CuCl2 | NaHCO3 | ||
| K2SO4 | Pb(NO3)2 | Na2C2O4 | ||
| LiCl | NH4Cl | Na2S | ||
| NaNO3 | CuSO4 | Na2CO3 | ||
| Na2SO4 | CrCl3 | K3PO4 | ||
| CaCl2 | BeSO4 | NaCH3COO | ||
| BaCl2 | FeCl2 | Na2SO3 | ||
| KNO3 | Al2(SO4)3 | KNO2 | ||
| SrCl2 | SnCl2 | K2SiO3 | ||
| CsCl | NH4NO3 | KCH3COO | ||
| NaF | Cr2(SO4)3 | K2S | ||
| KBr | NiSO4 | KNO2 | ||
| KCl | ZnSO4 | Na3PO4 | ||
| LiNO3 | MnCl2 | NaNO2 | ||
В пробирках растворить в небольшом количестве воды кристаллические соли и с помощью универсальной индикаторной бумаги определить реакцию среды раствора. Для этого на индикаторную бумагу нанести стеклянной палочкой каплю испытуемого раствора и полученную окраску сравнить с окраской эталонов.
Характер гидролиза растворенного вещества определяется химической природой соли.
Анализируя природу ионов соли, установить, происходит ли гидролиз и какой из ионов вызывает смещение равновесия диссоциации воды?
Пользуясь соотношением
Кв
Кг = ¾¾¾¾¾,
Ксл.элетролита
рассчитать константы гидролиза по первой ступени (используя константы соединений, указанных в табл. 3.
Таблица 3
| Соединение | Кдисс | Соединение | Кдисс |
| HNO2 Н2S H2SO3 HCl H2CO3 CH3COOH H3PO4 H2C2O4 | 4,6 . 10 -4 К1 = 8,7 . 10 –8 К2 = 3,6 . 10 -13 К1 = 1,7 . 10 –2 К2 = 6,8 . 10 –8 4,9. 10 –10 К1 = 4,3 . 10 –7 К2 = 5,6 . 10 -11 1,8 . 10 –5 К1 = 7,6. 10 –3 К2 = 6,2 . 10 –6 К3 = 4,4 . 10 –12 К1 = 5,6 . 10 –2 К2 = 5,1 . 10 -5 | NH4OH Аl(OH)3 Cu(OH)2 Сr(OH)3 Pb(OH)2 Zn(OH)2 Mg(OH)2 Fe(OH)2 Fe(OH)3 Сa(OH)2 Ni(OH)2 Mn(OH)2 | 1,8 . 10 -5 К3 = 1,4 . 10 –9 К2 = 3,4 . 10-7 К3 = 1,02 .10 –10 К1 = 9,6 . 10 –4 К2 = 4,0 . 10 –5 К2 = 2,5 . 10 –3 К2 = 1,3 . 10 –4 К3 = 1,35 .10 –12 К2 = 4,3 . 10 –2 К2 = 2,5 . 10 –5 К2 = 5,0 . 10 –4 |
Результаты оформить в табл. 4.
Таблица 4
| Соль | Происходит ли гидролиз | Реакция среды | рН раствора (показания универсального индикатора) | Кг | |
| по катиону | по аниону | ||||
Для каждой соли написать ионное и молекулярное уравнения гидролиза.
О п ы т 2. Смещение равновесия реакции гидролиза соли
при изменении температуры.
Налить в пробирку 2-3 мл 1 н раствора ацетата натрия и 2-3 капли фенолфталеина. Нагреть раствор почти до кипения и наблюдать появление розовой окраски. Охладить пробирку под краном с холодной водой и наблюдать уменьшение интенсивности окрашивания.
Обьяснить изменение окраски раствора с изменением температуры. Написать ионное и молекулярное уравнения реакции. Сделать вывод о среде раствора.
О п ы т 3. Смещение равновесия реакции гидролиза соли
при разбавлении раствора
а) Внести в пробирку 2-3 кристаллика хлорида олова (II) и добавить по каплям воду до выпадения осадка основного хлорида олова SnOHCl. При подкислении соляной кислотой осадок растворяется.
Объяснить влияние разбавления раствора и добавления соляной кислоты, исходя из принципа Ле-Шателье.
б) В коническую колбу налить 50 мл дистиллированной воды и добавить 1-2 капли прозрачного концентрированного раствора Pb(NO3)2. Наблюдать образование осадка.
Указать гидролизующийся ион, составить уравнения реакции гидролиза в ионной и молекулярной форме. Объяснить, почему при разбавлении в колбе появился осадок.
О п ы т 4. Особые случаи полного (необратимого) гидролиза.
В две пробирки внести по 6–8 капель раствора хлорида алюминия AlCl3. В одну пробирку добавить такой же объем раствора сульфида аммония, в другую – раствора карбоната натрия. Наблюдать в обеих пробирках выпадение осадка гидроксида алюминия, сопровождающееся в первом случае выделением газообразного сероводорода, во втором – пузырьков диоксида углерода.
В результате обменной реакции образуются две соли. Одна из них – соль сильного основания и сильной кислоты, гидролизу не подвергается, другая – подвергается гидролизу, причем гидролиз таких солей идет обычно до конца. Написать молекулярные уравнения процессов.
О п ы т 5. Влияние силы кислоты и основания, образующих соль,
на степень ее гидролиза.
Налить в пробирки по 1–2 мл 1 н растворов сульфита и карбоната
натрия. В каждую пробирку добавить по одной капле фенолфталеина.
Почему окраска фенолфталеина в этих растворах различна? Объяснить наблюдаемое явление, сравнив константы диссоциации угольной (К1 = 4,3. 10 –7, К2 = 5,6 . 10 –11) и сернистой
(К1 =1,7 . 10 –2, К2 = 6,8 . 10 –8) кислот. Написать ионные и молекулярные уравнения гидролиза исследуемых солей.
КОНТРОЛЬНЫЕ ВОПРОСЫ И ЗАДАЧИ
1. Что называется ионным произведением воды и каково его численное значение?
2. Дать определение водородного показателя рН. Показать взаимосвязь между характером среды и рН.
3. Что такое гидролиз солей? Какие вещества образуются в результате гидролиза? Привести примеры.
4. Какие соли подвергаются гидролизу? Чем это объясняется?
5. Почему соли, образованные сильным основанием и сильной кислотой, не подвергаются гидролизу?
6. Какие соли гидролизуются с образованием кислых солей или слабодиссоциирующих кислот? Привести пример.
7. Какие соли гидролизуются с образованием основных солей или слабых оснований? Привести пример.
8. Почему в одних случаях реакция гидролиза обратима, а в других – происходит полный (необратимый) гидролиз? Привести примеры.
9. Почему в результате гидролиза изменяется реакция среды? Как ее можно определить?
10. Имеются растворы солей KCl, NaCl, CuCl2, AlCl3. В каких растворах концентрация иона Н+ равна концетрации OH -? Ответ пояснить.
11. Можно ли пользуясь фенолфталеином, отличить водный раствор Na2SiO3, от водного раствора Na2SO4? Oтвет пояснить.
12. Можно ли с помощью рН –метра отличить водный раствор KCl
oт водного раствора NH4Cl? Ответ пояснить.
13. Справедливо ли утверждение о том, что водные растворы NaCl и KCl имеют одинаковое значение водородного показателя? Ответ пояснить.
14. Используя справочные данные, рассчитать константу гидролиза CH3COONa. Ответ: 0,57 . 10 –9.
15. Используя справочные данные, рассчитать степень гидролиза соли СH3COONa в 0,01 м растворе. Ответ: 2,39 . 10 –4 (2,39. 10 –2 %).
16. Написать ионные и молекулярные уравнения ступенчатого гидролиза сульфата двухвалентного железа и сульфида натрия. Какова будет реакция среды этих солей в результате гидролиза?
17. Какую реакцию среды должны показывать водные растворы нитрата аммония, нитрита калия, цианида аммония, ацетата аммония? Ответ пояснить и написать соответствующие уравнения реакций в молекулярном и ионном виде?
18. В каком направлении сместится гидролиз соли цианида натрия, если прибавить к этому раствору щелочь, кислоту или хлорид аммония?
19. Гидролиз соли выражается уравнением
Cu(NO3)2 + H2O ® CuOHNO3 + HNO3.
Записать реакцию в ионном виде. В каком направлении сместится равновесие в этой реакции при добавлении в раствор H2O, KOH, HNO3, Cu(NO3)2?
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Коровин Н.В. Общая химия. – М.: Высш. шк., 2000.
2. Общая химия. /Под ред. Е.М. Соколовской. – М.: МГУ, 1980.
3. Хомченко Г.П., Цитович И.К., Неорганическая химия. – М.: Высш. шк., 1987.
4. Глинка Н.Л. Задачи и упражнения по общей химии. – Л.: Химия,
1986.
5. Лабораторный практикум по общей химии./Под ред. А.А. Таперовой. - М.: Высш. шк., 1976.
6. Практикум по общей и неорганической химии. /Под. Ред. М.Х. Карапетьянца, С.И. Дракина. – М.: Высш. шк., 1969.
7. Коровин Н.В., Мигулина Э.И., Рыжова Н.Г. Лабораторные работы по химии. – М.: Высш. шк., 2001.
8. Киселев В.П., Иванченко А.В., Шишин Л.П., Тюменева Г.Т., Рубчевская Л.А. Общая химия. Методические указания к лабораторным работам для студентов 1 курса всех специальностей. Часть 1. – Красноярск: КрасГАСА, 1997.
СОДЕРЖАНИЕ
Лабораторная работа: Характеристика среды растворов. Гидролиз солей…………………………………………………… 3
1. Теоретическое обоснование …………………………………. 3
1.1 Ионное произведение воды………………………………… 3
1.2 Водородный показатель…………………………………….. 4
1.3 Гидролиз солей………………………………………………. 5
1.4 Количественные характеристики гидролиза………………. 8
2. Экспериментальная часть……………………………………… 11
3. Контрольные вопросы и задачи………………………………. 14
Библиографический список……………………………………… 15






