Решение: по правилу креста
80 
 50
50
10 
 20
20
т.е. исходные растворы кислот нужно смешивать в соотношении 20:50.
По справочнику находим, что плотность 60%-го раствора HNO3 составляет 1,365, поэтому 1л нужного нам раствора весит 1365г. Это количество раствора нужно разделить на две части в соотношении 20:50. Составляем пропорции:
Из 20г 10%-го раствора получим 20+50г р-ра
Из Х г------------------------------------1365г р-ра
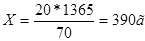 .
.
т.е. нужно взять 390г 10%-го раствора.
Аналогично: из 50г 80%-го раствора----------------70г
Х--------------------------------------1365г
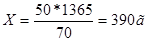 .
.
Для удобства пересчитывают эти количества в объеме на единицы. Для 10%-го раствора HNO3 плотность равна 1,455, поэтому объем раствора, необходимый для смешивания будет равен:
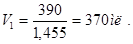
Для 60% -го раствора плотность равна 1,455, поэтому объем раствора равен:
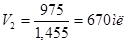 .
.
Пример 5. При решении задач на разбавление растворов чистым растворителем нужно второй раствор в правиле «креста» считать за раствор с концентрацией 0.
Сколько воды следует добавить к 100г 40%-ой щелочи натрия, чтобы получить 5%-ый раствор?
Решение: по правилу «креста»
40 
 5
5

 0 35
0 35
т.е. 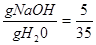 ,
,
далее определяем количество воды, которое нужно смешать со 100г щелочи:
5 - 35
100 - X
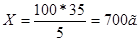
Пример 6. При решении задач на смешивание растворов, концентрации которых выражены в молях или нормальностях, моляльностях, также можно применять правило «креста».
Сколько нужно взять 0,2М и 1М растворов, чтобы приготовить 1000мл 0,4м раствора?
Решение: по правилу «креста»:
1 
 0,2
0,2

 0,4
0,4
0,2 0,6
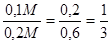 , тогда
, тогда
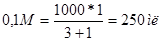 ,
,
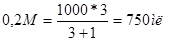 .
.
Пример 7. Сколько воды нужно добавить к 1000мл. 1,15н раствора NaOH, чтобы получить 1,0Н раствор?
Решение: по правилу «креста»
 1,15 1 1 - 0,15
1,15 1 1 - 0,15

 1 1000 - X
1 1000 - X
 0 0,15
0 0,15
 .
.
Пример 8. Сколько воды и серной кислоты, удельного веса 1,82 г/см3 следует взять для приготовления 5л 2Н раствора?
Решение: Пересчитаем концентрацию серной кислоты на нормальность. По справочнику находим, что если плотность H2SO4 равна 1,82, то она содержит 91,11г. H2SO4 в 100г раствора.
В 100г раствора - 91,11г
В 1820г (1литр) - Х

Эквивалент H2SO4 = 49, поэтому нормальность будет равна:

Далее применяем правила «креста»:

 33,8 2.
33,8 2.

 2
2
0 31,8
т.е. отношение объемов
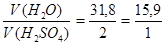
Из 1 литра H2SO4 плотностью 1,82 получается (15,9+1)л. раствора. Из Х – 5л. р-ра.

Из 15,9л. H2O получится 16,9л. 2Н р-ра
Из Хл. H2O -----------5л. 2Н р-ра.
КОНТРОЛЬНЫЕ ЗАДАНИЯ
1. Сколько граммов NH4CI потребуется, чтобы приготовить 1,6кг.10%-го раствора?
2. В 300г раствора содержится 10% безводной соды. Сколько десятиводного карбоната натрия потребовалось для приготовления такого раствора?
3. Требуется приготовить 250г. 3%-го раствора буры. Сколько граммов десятиводного тетрабората натрия и воды необходимо для этого?
4. Сколько граммов воды потребуется для приготовления 10%-го раствора из 35г. двухводного кристаллогидрата хлорида бария?
5. Сколько граммов воды потребуется для растворения 12 граммов NaCI, чтобы получить 5%-ый раствор?
6. Сколько миллилитров этилового спирта (d=0,80 г/см3) потребуется для приготовления 10%-го раствора из 5г.иода?
7. Сколько граммов NaCI, имеющей 15% влажности, требуется для приготовления 1000 грамм 10%-го раствора?
8. Сколько граммов 60%-го раствора КОН и воды потребуется, чтобы приготовить 500г. 1-%-го раствора?
9. Сколько граммов технического едкого натра, содержащего 75% Na2O потребуется для приготовления 600г. 15%-го раствора?
10. 10г КСI растворены в 60г H2O. Найти процентную концентрацию раствора.
11. В 60г. H2O растворили 20мл 40%-го раствора H3PO4 (d= 1,254). Чему равна процентная концентрация раствора?
12. Из мерной колбы на 250мл, в которой находился 0,09650 н. раствор H2SO4 взяли 25,0 мл. Сколько граммов раствора H2SO4 (d=1,611) следует ввести в колбу, чтобы после доливания до метки водой получился 0,2000н. раствор.
13. Сколько мл. 50%-го и 20%-го растворов КОН потребуется для приготовления 500мл. 40%-го раствора?
14. В каком соотношении нужно смешать 12н. раствор НСI с 2н. раствором, чтобы получить 4н. раствор?
15. В каких объемных отношениях нужно смешать раствор HNO3 c водой, чтобы получить 2н. раствор?
16. В каких объемных отношениях надо смешать 1н. раствор уксусной кислоты с водой, чтобы получить 0,05н. раствор?
17. В каких объемных отношениях надо смешать 0,5 и 0,1н. растворы NaOH, чтобы получить 0,2н. раствор?
18. Сколько миллилитров 6н. и 1н. растворов HNO3 надо смешать для получения 500мл 2н раствора?
СВОЙСТВА РАСТВОРОВ
Растворы занимают промежуточное место между механическими смесями и химическими соединениями. Однородность растворов и выделение теплоты при растворении некоторых веществ делает их сходными с химическими соединениями. Отличие растворов от химических соединений состоит в том, что состав раствора может изменяться в широких приделах.
Кроме того, в свойствах раствора можно обнаружить свойства его отдельных компонентов, чего не наблюдается в случае химического соединения.
Давление насыщенного пара над раствором
Переход молекул веществ из жидкости в пар называется испарением. Переход молекул вещества из парообразного состояния в жидкость называется конденсацией.
Если жидкость находится в замкнутом сосуде, то достигается равновесие, когда скорость испарения жидкости равна скорости конденсации пара.
Давление, которое оказывает пар, находящийся в равновесии с жидкостью, называют давление насыщенного пара этой жидкости. Это максимальное давление пара, которое развивается жидкостью. Давление насыщенного пара зависит от природы жидкости и температуры и не зависит от количества жидкости.
Поверхность раствора, в отличае от поверхности чистого растворителя, частично занята молекулами растворенного вещества. Поэтому число молекул растворителя, испаряющихся в еденицу времени с еденицы поверхности раствора меньше, чем с еденицы поверхности растворителя. Следовательно, при одной и той же температуре давление насыщенного пара над раствором всегда будет ниже давления насыщенного пара над растворителем.
Количественно эта зависимость выражается законом Ф. Рауля “В идеальных растворах при постоянной температуре величина относительного понижения давления пара растворителя над раствором равна молярной доле растворенного вещества”.
 , где
, где
Р0 – давление пара чистого растворителя,
Р - давление насыщенного пара над раствором.
Идеальный раствор – раствор, в котором межмолекулярные силы равны. Если вещества А и В образуют идеальный раствор, то силы между молекулами А…А, А…В и В…В равны.
Из закона Рауля следует, что пар над смесью жидкостей А и В содержит оба этих вещества, причем давление насыщенного пара каждого из веществ в смеси равно произведению мольной доли этого вещества на давление насыщенного пара над чистым веществом, т.е.:
РА = NА* Р0А
РА – давление насыщенного пара вещества А над раствором,
NА – мольная доля вещества А в расворе,
Р0А – давление насыщенного пара вещества А над чистым веществом.
Для вещества В РВ = NВ* Р0 В






