Вопрос
Коллоидные системы- это такие дисперсные системы, в которых размер частиц фазы от 100 до 1 нм. Эти частицы не видны невооруженным глазом, и фаза и среда отстаивание разделяются с трудом.
Основными признаками коллоидных систем являются гетерогенность и дисперсность.Гетерогенность указывает на наличие межфазной поверхности поверностного слоя. Дисперсность- является мерой раздробленности вещества.Она определяется как величина обратная размеру частиц.
Вопрос
Классификация дисперсных систем по агрегатным состояниям фаз.
Дисперсион-ная среда Дисперс-ная фаза Примеры дисперсных систем
Твердая Твердое Рубиновое стекло; пигментированные волокна; сплавы; рисунок на ткани, нанесенный методом пигментной печати
Твердая Жидкая Жемчуг, вода в граните, вода в бетоне, остаточный мономер в полимерно-мономерных частицах
Твердая Газообразная Газовые включения в различных твердых телах: пенобетоны, замороженные пены, пемза, вулканическая лава, полимерные пены, пенополиуретан
Жидкая Твердая Суспензии, краски, пасты, золи, латексы
Жидкая Жидкая Эмульсии: молоко, нефть, сливочное масло, маргарин, замасливатели волокон
Жидкая Газообразная Пены, в том числе для пожаротушения и пенных технологий замасливания волокон, беления и колорирования текстильных материалов
Газообразная Твердая Дымы, космическая пыль, аэрозоли
Газообразная Жидкая Туманы, газы в момент сжижения
Газообразная Газообразная Коллоидная система не образуется
Вопрос
Истинные растворы коллоидные системы
Имеется сродство между компонентами отсутствие сродства между компонентами
Образуются самопроизвольно образуются принудительно(растворы ПАВ и ВМС)
Молекулярная или ионная степень дисперсии коллоидная степень дисперсии
Термоденамически устойчивы термоденамически не устойчивы
Агрегативно устойчивы,сохранение степени агрегативно не устойчивы-уменьшают степень дисперсии
Дисперсии во времени
Однофазны многофазны
Обратимы не обратимы
Преломляют свет рассеивают свет
Вопрос
Очистку коллоидных растворов можно проводить либо методом диализа, либо ультрафильтрацией.
Диализ заключается в извлечении из золей низкомолекуляр-ных веществ чистым растворителем с помощью полупроницаемой перегородки (мембраны), через которую не проходят коллоидные частицы. Периодически или непрерывно сменяя растворитель в при-боре для диализа -- диализаторе, можно практически полностью удалить из коллоидного раствора примеси электро-литов и низкомолекулярных неэлектролитов.
Недостатком метода является большая длительность процесса очистки (недели, месяцы).
Электродиализ -- это процесс диализа, ускоренный путем приме-нения электрического тока.
Компенсационный диализ и вивидиализ -- методы, разработан-ные для исследования биологических жидкостей, представляющих собой коллоидлые системы. Принцип метода компенсационного диализа состоит в том, что в диализаторе вместо чистого раство-рителя используют растворы определяемых низкомолекулярных веществ различной концентрации.
Ультрафильтрация -- фильтрование коллоидного раствора через полупроницаемую мембрану, пропускающую дисперсионную среду с низкомолекулярными примесями и задерживающую частицы дисперсной фазы или макромолекулы. Для ускорения процесса ультрафильтрации ее проводят при перепаде давления по обе сто-роны мембраны: под разрежением (вакуумом) или под повышен-ным давлением.
5 вопрос.
Коллоидная частица не имеет определенного состава, поэтому ее строение может быть изображено лишь схематически.
Рассмотрим образование золя и строение его частиц на примере иодида свинца PbI2.
Уравнение реакции имеет вид:
Pb2+ + 2I— = PbI2
Образование золя возможно, если к раствору Pb(NO3)2 постепенно прибавлять раствор KI или если к раствору KI постепенно прибавлять раствор Pb(NO3)2. При этом строение коллоидных частиц будет отличаться.
1. Предположим, что золь PbI2 образуется при постепенном прибавлении раствора KI к раствору Pb(NO3)2.
Вначале образуется агрегат (PbI2)m из ионов Pb2+ и I—.
Далее на поверхности агрегата адсорбируются ионы, входящие в его состав и находящиеся в растворе в избытке. В нашем примере это ионы свинца.
В результате этого, агрегат (PbI2)m с адсорбированным слоем Pb2+ приобретает положительный заряд. Адсорбированные на поверхности агрегата ионы и придающие ему заряд, называются потенциалопределяющими. А сам агрегат (PbI2)m с потенциалопределяющими ионами Pb2+, образуют ядро.
Далее, к ядру притягиваются противоположно заряженные ионы – противоионы, которые компенсируют заряд твердой фазы и образуют адсорбционный слой. Противоионами будут служить, ионы содержащиеся в растворе, но не входящие в состав агрегата. В данном примере – это нитрат-ионы NO3–.
Ядро и противоионы адсорбционного слоя образуют коллоидную частицу или гранулу, знак которой определяется знаком заряда потенциалопределяющих ионов.
Те же противоионы (NO3–), образуют и диффузный слой. По мере удаления от ядра, их содержание постепенно снижается.
Коллоидная частица вместе с противоионами диффузного слоя называется мицеллой.
Мицела в целом электронейтральна и не имеет строго определенных размеров.
Агрегат сравнительно прочно удерживает (связывает) противоионы адсорбционного слоя, а противоионы диффузного слоя испытывают действие электростатического притяжения разноименно заряженных ионов, удерживающее их вблизи ядра, и броуновского движения, стремящегося распределить их в дисперсионной среде.
Формула мицеллы йодида свинца выглядит следующим образом:


2. Если же постепенно прибавлять раствор Pb(NO3)2 к раствору KI, то строение мицелы будет иным.
В этом случае, в избытке будут йодид-ионы, которые и будут адсорбироваться на поверхности агрегата (PbI2)m, образуя слой потенциалопределяющих ионов. В качестве противоионов адсорбционного и диффузионного слоев будут выступать ионы калия. Строение мицеллы имеет следующий вид:
[(PbI2)m, nI–, (n – x)K+]x–xK+.
Т.к. гранула мицелы и ее диффузный слой – это заряженные частицы, то под действием электрического поля, они будут перемещаться к соответствующим электродам.
Итак, обобщая вышесказанное, приведем порядок написания формулы мицелы:
1) Ядро мицелы. Малорастворимое соединение, образуемое в результате реакции, составляет агрегат. Агрегат записывают в круглых скобках с индексом m.
2) Потенциалопределяющие ионы. Ионы, адсорбированные на поверхности агрегата и входящие в его состав, а также придающие ему заряд, находятся в растворе в избытке. Перед потенциалопределяющим ионом ставят коэффициент n.
3) Противоионы адсорбционного слоя. Ионы раствора, взятого в избытке, но не входящие в состав агрегата образуют адсорбционный слой и компенсируют заряд твердой фазы. Перед противоионом адсорбционного слоя ставят коэффициент (n-x), умноженный на численное значение заряда потенциалопределяющего иона.
Ядро и адсорбционный слой мицелы, образующие гранулу, заключают в квадратные скобки и указывают заряд гранулы — x+ или x-, умноженные на численное значение заряда потенциалопределяющего иона.
4) Противоионы диффузного слоя. Часть противоионов, находящиеся во внешней сфере мицелы, удаленной от ее ядра. Перед противоионом диффузного слоя ставят коэффициент x, умноженный на численное значение заряда потенциалопределяющего иона. Противоионы диффузного слоя записывают за квадратными скобками.
6 вопрос.
Поверхностное натяжение может быть непосредственно измерено только в случае поверхности раздела жидкость — газ (насыщенный пар) или жидкость — жидкость. П. н., измеренное в условиях, когда поверхностный слой еще не достиг равновесного состояния, называют динамическим, а измеренное в равновесных условиях — статическим П. н. Время для достижения равновесного состояния поверхностного слоя чистых жидкостей и растворов низкомолекулярных веществ не превышает обычно нескольких тысячных долей секунды.
Адсорбцией наз. концентрирование какого-либо вещества в поверхностном слое в результате его самопроизвольного перехода из объема фазы на поверхность. Вещество, на поверхности которого происходит адсорбция. наз. адсорбентом, а вещество, концентрирующееся на границе раздела фаз наз. адсорбтивом или адсорбатом.
Основной особенностью адсорбции на поверхностях раздела жидких фаз является возможность измерения поверхностного натяжения. Надежных методов измерения поверхностного натяжения твердых тел нет, так как обратимое изменение их поверхности встречает ряд трудностей.
Количественно соотношение между адсорбцией растворимого вещества (в кмоль на 1 м2 поверхности) и изменением поверхностного натяжения (s) с концентрацией раствора С (кмоль/м3) определяется уравнением Гиббса:

7. Поверхностно-активные и –инактивные вещества.
Вещества, добавление которых к растворителю уменьшает поверхностное натяжение, называют поверхностно-активными (ПАВ). Вещества, добавление которых увеличивает или не изменяет поверхностное натяжение, называют поверхностно-инактивными.
Рассмотрим поверхностно-активные, или дифильные (двояколюбящие), вещества. Поверхностно-активные вещества состоят из двух частей:
полярной;
неполярной.
ПАВ являются следующие классы веществ:
спирты R-OH;
альдегиды R-COH;
карбоновые кислоты R-COOH.
Углеводородные радикалы (CH3-; C2H5-; C17H35- и т.д) представляют собой неполярную часть поверхностно-активного вещества, которая может быть как угодно длинной.
Функциональные группы – COH, COOH представляют полярную часть поверхностно-активного вещества (ПАВ). Примеры ПАВ: олеиновая кислота (С17H33COOH), натриевая соль стеариновой кислоты (C17H35COONa, мыло).
Молекулы ПАВ менее полярны, чем молекулы воды. Благодаря этому взаимодействие молекул воды между собой сильнее, чем молекул воды с молекулами ПАВ. В результате молекулы ПАВ будут вытесняться из раствора в поверхностный слой. Повышение концентрации третьего вещества в поверхностном слое, в частности, молекул ПАВ, приводит к понижению поверхностного натяжения. Исследуя поверхностное натяжение водных растворов органических веществ, Траубе и Дюкло установили для гомологических рядов поверхностно-активных веществ следующее эмпирическое правило:
В любом гомологическом ряду при малых концетрациях удлинение углеродной цепи на одну группу СН2 увеличивает поверхностную активность в 3−3,5 раза.
Изменение поверхностного натяжения под действием ПАВ влияет на смачиваемость твердых тел жидкостью. Например, для очистки тканей (стирка, чистка) или металлов от жировых загрязнений применяют ПАВ. ПАВ позволяет разделить пустую породу и руду при флотации руд.
Ионные ПАВ применяются в хирургии в качестве антисептиков. Механизм молекулярной адсорбции лежит в основе гемосорбции – очищении крови от токсических веществ с помощью различных адсорбентов.
Поверхностно-инактивными веществами являются все неорганические электролиты (кислоты, соли, основания) и некоторые органические (α-аминокислоты и др.). Ионы таких соединений хорошо гидратируются, поскольку энергия взаимодействия между молекулой воды и ионом больше, чем молекул воды друг с другом, что отражает неравенство:  . Из-за высокой энергии гидратации результирующая сила F возрастает и поверхностные ионы интенсивно втягиваются в глубину раствора. Это приводит к тому, что в растворах сильных электролитов пограничный слой толщиной в несколько молекулярных диаметров состоит преимущественно из молекул воды, а ионы солей содержатся в очень малой концентрации. В итоге, поверхностное натяжение раствора, по сравнению с чистым растворителем, повышается незначительно.
. Из-за высокой энергии гидратации результирующая сила F возрастает и поверхностные ионы интенсивно втягиваются в глубину раствора. Это приводит к тому, что в растворах сильных электролитов пограничный слой толщиной в несколько молекулярных диаметров состоит преимущественно из молекул воды, а ионы солей содержатся в очень малой концентрации. В итоге, поверхностное натяжение раствора, по сравнению с чистым растворителем, повышается незначительно.
8. Под адсорбцией на твердых поверхностях подразумевается поглощение газов и компонентов жидких растворов на этих поверхностях.
У адсорбции на твердых поверхностях совсем иная область применения, чем у адсорбции на подвижных поверхностях. Там главное значение имеет снижение поверхностного натяжения. С помощью адсорбции на твердой поверхности производится очистка газов и растворов, разделение и анализ смесей (хроматография), изучение пористой структуры материалов.
ГЕНРИ ЗАКОН: растворимость газа при заданной т-ре пропорциональна его давлению над р-ром. В такой формулировке закон был установлен У. Генри в 1802. Совр. формулировка: при постоянной т-ре парциальное давление р, растворенного в-ва над его предельно разб. р-ром пропорционально мольной доле этого в-ва Ni, т.е. рi- = KiNi,где Хi-постоянная Генри для в-ва i.
Генри закон-осн. закон, определяющий термодинамич. св-ва предельно разб. р-ров неэлектролитов. Так, если для идеального разб. бинарного р-ра выполняется Генри закон, то из Гиббса-Дюгема уравнения и общих законов термодинамич. равновесия следует, что парциальное давление пара р-рителя над таким р-ром при постоянной т-ре пропорционально мольной доле р-рителя (см. Рауля законы), а понижение т-ры замерзания р-ра (если его компоненты не образуют твердых р-ров) пропорционально мольной доле растворенного в-ва и не зависит от его хим. природы
9.
Теория мономолекулярной адсорбции основывается на следующих положениях:
1) Адсорбция является локализованной (происходит на адсорбционных центрах).
2) Адсорбция происходит не на всей поверхности адсорбента, а на активных центрах, которыми являются выступы либо впадины на поверхности адсорбента. Активные центры считаются независимыми (т.е. один активный центр не влияет на адсорбционную способность других), и тождественными.
3) Каждый активный центр способен взаимодействовать только с одной молекулой адсорбата; в результате на поверхности может образоваться только один слой адсорбированных молекул.
4) Процесс адсорбции находится в динамическом равновесии с процессом десорбции.
10. Уравнение Фрейндлиха для адсорбции газа имеет вид:
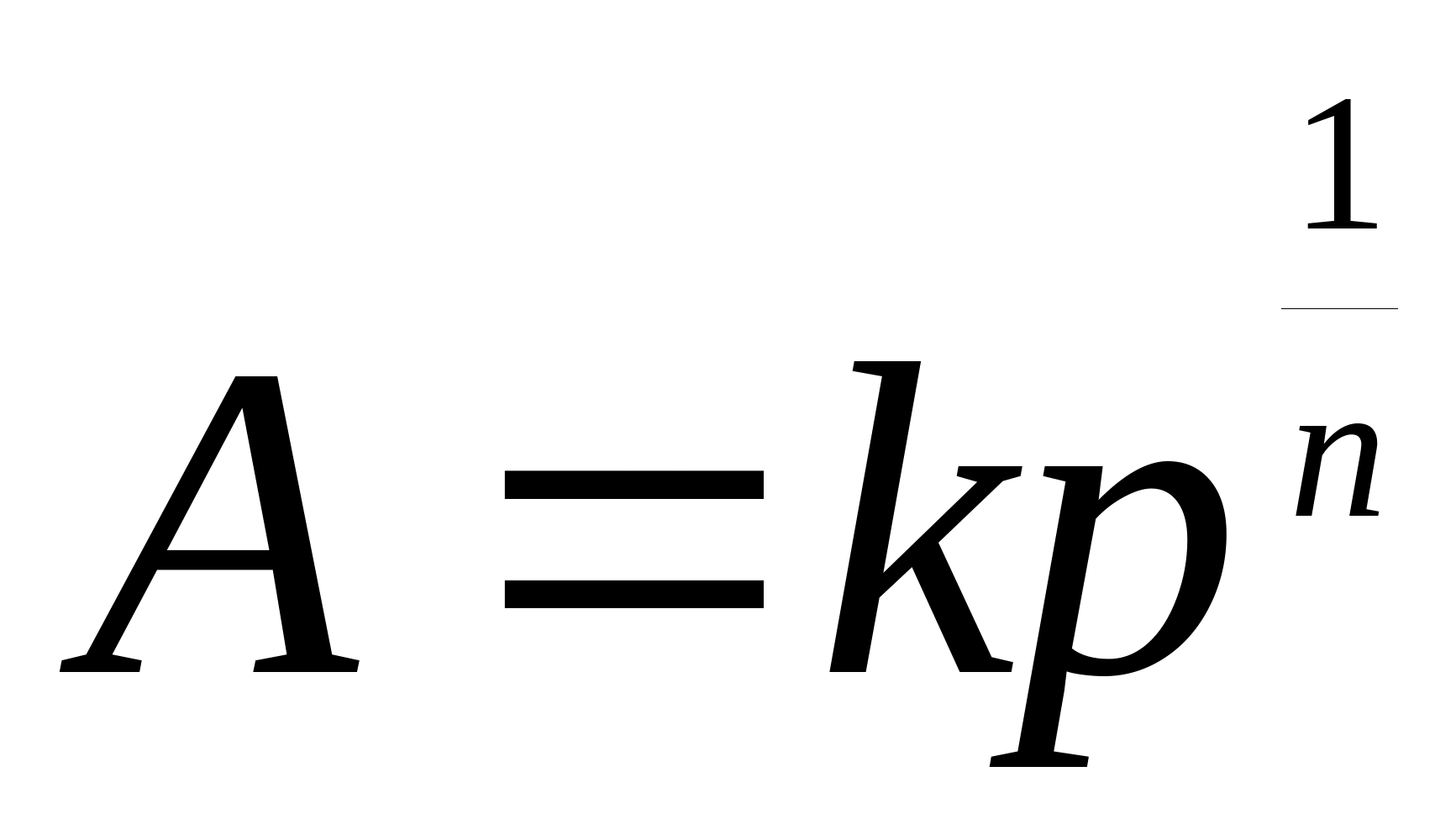 (11)
(11)
K и 1/n –постоянные уравнения Фрейндлиха.
Чаще всего это уравнение применяется в логарифмической форме:
 (12)
(12)
Уравнение в такой форме позволяет построить линейную зависимость lnA от lnp и графически определить оба постоянных параметра.
Логарифмическое уравнение Фрейндлиха для адсорбции из раствора имеет вид:
 (13)
(13)
Графически определяем постоянные параметры по линейной зависимости lnA от lnC. (рис.2)
Отрезок, отсекаемый на оси ординат равен lg k, а тангенс угла наклона прямой
равен 1/n.
Р 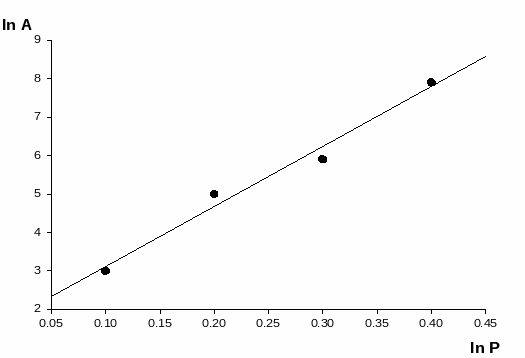
ис.2. Изотерма адсорбции в координатах логарифмического уравнения.
11 вопрос.
Теория БЭТ сохраняет ленгмюровские представления о динамическом характере адсорбции. Адсорбция считается полислойной. Молекулы первого слоя адсорбируются на поверхности адсорбента в результате межмолекулярного взаимодействия адсорбент - адсорбат. Каждая адсорбированная молекула первого адсорбционного слоя может, в свою очередь, являться центром адсорбции молекул второго слоя и т.д. Так формируются второй и последующие сорбционные слои. Теплота адсорбции в первом слое q1 определяется взаимодействием адсорбат - адсорбент, во всех последующих слоях - взаимодействием адсорбат - адсорбат. Поэтому теплота адсорбции во всех слоях, начиная со второго, равна теплоте конденсации λ. Второй и последующие адсорбционные слои могут начинать образовываться и при незавершенном первом слое, как это показано на рисунке:

Если обозначить через S0, S1, S2... площади поверхности адсорбента, покрытые 0, 1, 2... слоями адсорбированных молекул, то вся площадь адсорбента будет равна сумме площадей с разным числом слоев:
Sобщ = Σ Si.
Составив уравнение адсорбционного равновесия для каждого слоя и просуммировав их, авторы теории БЭТ получили уравнение для полислойной адсорбции:

В приведенном уравнении АМ - емкость монослоя, С - константа, равная е (q1− λ) / RT. При малых относительных давлениях, когда р << рs, уравнение преобразуется в уравнение Ленгмюра.
Таким образом, изотерма Ленгмюра (изотерма I) может рассматриваться как частный случай уравнения БЭТ. В случаях, когда q1 > λ, т.е. энергия взаимодействия адсорбент - адсорбат больше энергии взаимодействия адсорбат - адсорбат, изотерма адсорбции выпукла и относится к типу II или IV. Если же энергия взаимодействия адсорбат - адсорбат больше теплоты адсорбции (λ > q1), то изотерма адсорбции вогнута и относится к типу III или V.
Уравнение изотермы адсорбции БЭТ широко используется для определения величины удельной поверхности адсорбентов. Изотерма адсорбции выражается прямой линией, отсекающей на оси ординат отрезок, равный 1 / АМ С, а тангенс угла ее наклона к оси абсцисс равен (С − 1) / АМ С.

Из этих значений можно найти величину АМ, а зная ее, рассчитать по уравнению удельную поверхность адсорбента. Стандартной методикой для определения удельной поверхности адсорбентов принято считать измерение изотермы адсорбции азота при 77 К. В этом случае wо = 0.162 нм2.

12.
Адсорбция на границе твердое тело-раствор
Адсорбция из раствора на твердой поверхности наиболее важна для коллоидной химии, так как именно она лежит в основе таких явлений как образование и разрушение коллоидных систем, а также их устойчивости.
Адсорбция на границе твердое тело-раствор усложняется наличием третьего компонента - среды (растворителя), молекулы которого могут также адсорбироваться на поверхности адсорбента и являются конкурентами молекул адсорбтива. Таким образом, происходит адсорбция из смеси. Кроме того, адсорбция усложняется взаимодействием молекул адсорбтива с молекулами среды.
При адсорбции из раствора на твердом теле принято различать два случая: адсорбция неэлектролитов, когда адсорбируются молекулы адсорбтива, и адсорбцию электролитов, когда избирательно адсорбируется один из ионов электролита.
ХРОМАТОГРАФИЯ, метод разделения, анализа и физ.-хим. исследования в-в. Обычно основана на распределении исследуемого в-ва между двумя фазами - неподвижной и подвижной (элюент).
Неподвижная фаза гл. обр. представляет собой сорбент с развитой пов-стью, а подвижная - поток газа (пара, флюида -в-во в сверхкритич. состоянии) или жидкости. Поток подвижной фазы фильтруется через слой сорбента или перемещается вдоль слоя сорбента.
Основные виды хроматографии. В зависимости от агрегатного состояния подвижной фазы различают газовую, флюидную (или сверхкритич. хроматографию с флюидом в качестве элюента; см. Капиллярная хроматография)и жидкостную хроматографию. В качестве неподвижной фазы используют твердые (или твердообразные) тела и жидкости. В соответствии с агрегатным состоянием подвижной и неподвижной фаз различают следующие виды хроматографии: 1) газо-твердофазную хроматографию, или газоадсорбционную хроматографию; 2) газо-жидкостную хроматографию (газо-жидко-твердофазную); 3) жидко-твердофазную хроматографию; 4) жидко-жидкофазную хроматографию; 5) флюидно-твердофазную хроматографию; 6) флюидно-жидко-твердофазную хроматографию.
Строго говоря, газо-жидкостная хроматография пока не реализована, на практике используют только газо-жидко-твердо-фазную хроматографию (см. Газовая хроматография). Жидко-жидкофазная хроматография реализована, однако преим. используют жидко-жидко-твердо-фазную хроматографию (неподвижной фазой служит твердый носитель с нанесенной на его пов-сть жидкостью; см. Жидкостная хроматография).
По механизму разделения в-в различают адсорбционную, распределительную, ионообменную, эксклюзионную, аффинную (биоспецифическую), осадочную хроматографию. На практике часто реализуется одновременно неск. механизмов разделения (напр., адсорбционно-распределителъный, адсорбционно-эксклюзионный и т. д.).
По геометрии сорбционного слоя неподвижной фазы различают колоночную и плоскослойную хроматографию. К плоскослойной относятся тонкослойная хроматография и бумажная хроматография. В колоночной хроматографии обычно выделяют капиллярную хроматографию, в к-рой сорбент расположен на внутр. стенках колонки, а центр, часть колонки остается незаполненной сорбентом, т.е. открытой для потока элюента (хроматография на открытых капиллярных колонках).
В зависимости от способа ввода пробы и способа перемещения хроматографич. зон по слою сорбента различают след. варианты хроматографии: проявительный (или элюентный), фронтальный и вытеснительный. В наиб. часто используемом проявительном варианте анализируемую смесь периодически импульсно вводят в поток подвижной фазы; в колонке анализируемая смесь разделяется на отдельные компоненты, между к-рыми находятся зоны подвижной фазы.
Во фронтальном варианте хроматографии пробу, содержащую разделяемые в-ва, непрерывно подают в колонку. Можно также подавать в колонку одновременно пробу и подвижную фазу. Во фронтальной хроматографии только первый, наименее сорбируемый компонент можно получить в чистом виде на выходе из колонки, вторая и последующая зоны содержат по два и более компонентов разделяемой смеси.
В вытеснительном варианте хроматографии в колонку после подачи разделяемой смеси вводят спец. в-во (т. наз. вытеснитель), к-рое сорбируется лучше любого из разделяемых компонентов. В вытеснительной хроматографии образуются примыкающие друг к другу зоны разделяемых в-в. Во фронтальном и вытеснительном вариантах хроматографии необходима регенерация колонки перед след. опытом.
13.
Ионообменная адсорбция - это процесс, при котором твердый адсорбент обменивает свои ионы на ионы того же знака из жидкого раствора.
Первые сообщения об ионообменной адсорбции были сделаны в 1850 г. независимо друг от друга английскими учеными Томпсоном и Уэем. Изучая способность почв к поглощению удобрений и их вымыванию дождем, они обнаружили обмен ионами между почвой и водными растворами солей.
ОСОБЕННОСТИ ОБМЕННОЙ АДСОРБЦИИ
Обменная адсорбция специфична, т.е. к обмену способны только определенные ионы, по своей природе этот процесс приближается к химическим явлениям; не всегда обратима; протекает более медленно, чем молекулярная адсорбция; может приводить к изменению рН среды.
Вещества, проявляющие способность к ионному обмену, называются ионитами. Иониты имеют структуру в виде каркаса, "сшитого", обычно, ковалентными связями. Каркас имеет положительный или отрицательный заряд, скомпенсированный противоположным зарядом подвижных ионов (противоионов), которые могут легко заменяться на другие ионы с зарядом того же знака. Каркас выступает в роли полииона и обусловливает нерастворимость ионита в растворителях.
Ионный обмен, обратимый процесс стехиометрического обмена ионами между двумя контактирующими фазами. Обычно одна из фаз раствор электролита, другая - ионит. Диссоциация ионогенной группы ионита дает ионную пару. «фиксированный ион» которой ковалентно связан с каркасом (матрицей) ионита, а «противоион» подвижен и может обмениваться на ионы одноименного заряда, поступающие из «внешнего» раствора. Благодаря эквивалентности обмена ионами обе фазы сохраняют электронейтральность в течение всего процесса. Принято рассматривать ионный обмен как гетерогенную химическую реакцию обмена и количественно характеризовать ее одной из трех констант равновесия К: концентрационной (не учитывает коэффициент активности компонентов); кажущейся (учитывает коэффициент активности только в растворе); термодинамической (учитывает коэффициент активности в растворе и фазе ионита). К определяют из уравнения Никольского:
K = (c 1/ a 1)1/z1(a 2/ c 2)1/z2
где c 1 и с 2 - концентрации или активности противоионов 1 и ионов 2 в равновесном растворе, a 1 и а 2 - концентрации или активности ионов 1 и 2 в равновесной фазе ионита, z 1 и z 2 - зарядовые числа ионов. Изменение термодинамического потенциала Гиббса в ходе ионного обмена подчиняется уравнению: D G = — RTlnK. В процессе ионного обмена меняется также объем сорбента Q, совершается работа А изотермического расширения (сжатия), причем A = pDQ, где p - осмотическое давление в фазе сорбента; поэтому суммарное значение D G = - RTlnK - pDQ. Однако в подавляющем большинстве случаев вторым членом уравнения можно пренебречь.
В простейшем случае ионный обмен система содержит два типа обменивающихся ионов и, следовательно, характеризуется четырьмя равновесными концентрациями (для каждого иона в растворе и в ионите). Все задачи решаются на основе системы четырех уравнений: баланса, изотермы ионный обмен, эквивалентности обмена и электронейтральности. Задачу нахождения К можно свести к экспериментальному определению равновесной концентрации с одного компонента в растворе. В случае обмена однозарядных ионов справедливо уравнение а = Ка 0 с /[ с 0 + (К — 1) с ], где а - равновесная концентрация иона в фазе ионита, а0 - обменная емкость ионита, с 0 - концентрация исходного раствора. Это уравнение иллюстрирует связь вида изотермы со значением К (рис. 1). 
Уравнение Никольского
Влияние мешающих ионов на формирующийся потенциал ИСЭ описывает уравнение Никольского, вытекающее из эмпирического уравнения Нернста.
Уравнение Никольского

const – эмпирическая величина, определяемая для каждого ИСЭ, отрезок, на основании потенциалов, отсекаемый функцией;
+ в случае определения катионов, - в случае определения анионов;
zx – заряд определяемо иона, zy – заряд мешающего иона;
ax – активность определяемого иона, ау – активность мешающего иона;
Кх/у – коэффициент селективности определяемый ион - мешающий ион. Коэффициент селективности показывает, при каком избытке мешающего иона мы можем получить 100% погрешность в определении анализируемого иона.
14 вопрос.
Агрегативная устойчивость
Укрупнение в результате слипания твердых частиц дисперсной фазы называют коагуляцией [коагуляция лат. coagulation свертывание, сгущение], слияние капелек жидкости – коалесценцией (рис. 30).

Рис. 30. Нарушение агрегативной устойчивости в результате слияния капель нерастворимого в воде органического вещества (коалесценция)
Коалесценция происходит за счет энергии поверхностного натяжения. В результате слияния капель жидкости сокращается площадь s поверхности раздела фаз. На рис. 31, а представлены семь шарообразных капель радиусом 0.1 мм, которые имеют следующий объем и площадь:
 ,
, 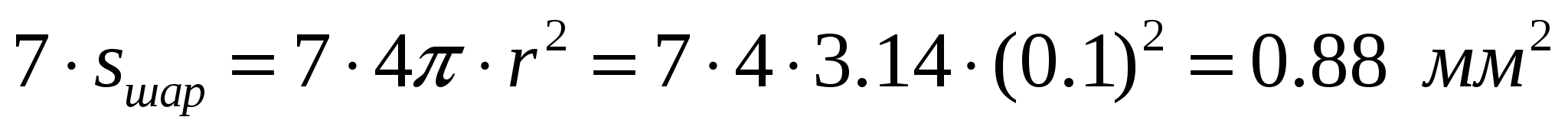 .
.
При слиянии в крупную каплю объем, занимаемый образовавшейся каплей, остается прежним, но площадь поверхности сокращается почти вдвое (рис. 31, б):
V = 4 p r 3/3 = 0.029 мм3,
r =  = 0.19 мм,
= 0.19 мм,
 .
.
 Рис. 31. Самопроизвольное уменьшение поверхности раздела фаз, приводящее к снижению энергии поверхностного натяжения
Рис. 31. Самопроизвольное уменьшение поверхности раздела фаз, приводящее к снижению энергии поверхностного натяжения
Существует возможность объяснения укрупнения капель жидкости, связанный с различием парциальных давлений газа над поверхностью мелких и крупных капель Это можно продемонстрировать на каплях жидкости, находящихся длительное время под колпаком (рис. 32). Парциальное давление газа над поверхностью мелких капель выше парциального давления над поверхностью крупных капель, поэтому крупные капли постепенно увеличиваются за счет мелких капель при диффузии молекул в газовой фазе.

Рис. 32. Укрупнение капелек ртути, находящихся в закрытом объеме
Слипание частиц приводит к нарушению агрегативной устойчивости (рис. 33).

Рис. 33. Нарушение агрегативной устойчивости в результате слипания частичек вещества (коагуляция)
В высокодисперсных системах агрегативная устойчивость обеспечивается электростатическим отталкиванием одинаково заряженных коллоидных частиц (рис 34).






