Строение электронных оболочек
Согласно квантово-механическим представлениям электрон, как и любая другая микрочастица, обладает одновременно корпускулярными и волновыми свойствами (корпускулярно-волновой дуализм), т.е. свойствами частицы и волны. Для описания состояния (движения) электрона в атоме используется вероятностный подход, основанный на представлениях об электронном облаке, атомной орбитали и электронной плотности.
 Электронное облако – модель движения электрона в атоме, предполагающая, что отрицательный заряд электрона неравномерно распределен во всем объеме пространства вокруг ядра (электрон как бы «размазан» в этом объеме). При графических изображении электронного облака это показывают неодинаковой густотой точек: где точки расположены гуще, там электрон находится чаще.
Электронное облако – модель движения электрона в атоме, предполагающая, что отрицательный заряд электрона неравномерно распределен во всем объеме пространства вокруг ядра (электрон как бы «размазан» в этом объеме). При графических изображении электронного облака это показывают неодинаковой густотой точек: где точки расположены гуще, там электрон находится чаще.
Плотность электронного облака (электронная плотность) убывает по мере удаления от ядра.
В многоэлектронном атоме электроны располагаются на атомных орбиталях (АО). Атомная орбиталь – это состояние электрона с определенным значением энергии, формой и пространственной ориентацией электронного облака.
Орбитали имеющие форму шара, обозначаются буквой s, а электроны, занимающие эти орбитали, называются s-электронами.
Орбитали в виде объемной восьмерки (гантели) обозначают буквой р, а находящиеся на них электроны называются р-электронами.

По мере удаления от ядра энергия электрона возрастает (прочность его связи с ядром при этом уменьшается), возрастают и размеры орбитали, на которой находится электрон. Соответственно при сохранении формы орбитали и числа электронов на ней электронная плотность уменьшается. При построении электронно-графических схем АО изображают в виде клетки (квантовая ячейка), а электрон – стрелкой.
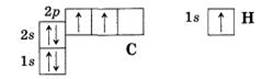
Электрон характеризуется спином, который упрощенно можно представить как вращение электрона вокруг собственной оси по часовой стрелке или против часовой стрелки. В зависимости от этого электрон обозначают стрелками: ↑ или ↓.
АО, не содержащая электронов, называется вакантной (свободной), содержащая один электрон – наполовину заполненной, содержащая два электрона – занятой (заполненной).
Если на АО находится один электрон, то он называется неспаренным. Находящиеся на АО два электрона получили названия спаренных или электронной (неподеленной) пары.
Частица, содержащая неспаренный электрон, называется свободным радикалом или просто радикалом.
На одной АО находится не более двух электронов, причем их спины должны быть противоположно направлены.






