Методы определения чувствительности бактерий к антибиотикам делятся на 2 группы: диффузионные и методы разведения.
Определение чувствительности бактерий к антибиотикам:
диффузионные методы
с использованием дисков с антибиотиками
с помощью Е-тестов
методы разведения
разведение в жидкой питательной среде (бульоне)
разведение в агаре
При определении чувствительности диско-диффузионным методом на поверхность агара в чашке Петри наносят бактериальную суспензию определенной плотности (обычно эквивалентную стандарту мутности 0,5 по McFarland) и затем помещают диски, содержащие определенное количество антибиотика. Диффузия антибиотика в агар приводит к формированию зоны подавления роста микроорганизмов вокруг дисков. После инкубации чашек в термостате при температуре 35о-37оС в течение ночи учитывают результат путем измерения диаметра зоны вокруг диска в миллиметрах (рис. 1).
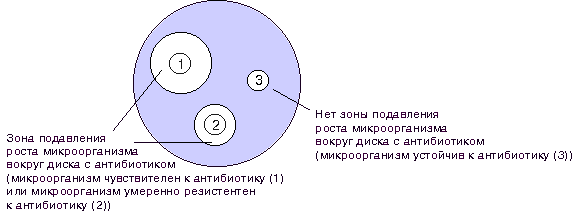
Рисунок 1. Определение чувствительности микроорганизмов диско-диффузионным методом.
Определение чувствительности микроорганизма с помощью Е-теста проводится аналогично тестированию диско-диффузионным методом. Отличие состоит в том, что вместо диска с антибиотиком используют полоску Е-теста, содержащую градиент концентраций антибиотика от максимальной к минимальной (рис. 2). В месте пересечения эллипсовидной зоны подавления роста с полоской Е-теста получают значение минимальной подавляющей концентрации (МПК).
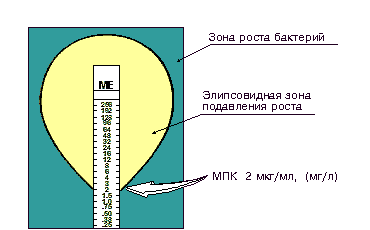
Рисунок 2. Определение чувствительности микроорганизмов с помощью Е-тестов.
Несомненным достоинством диффузионных методов является простота тестирования и доступность выполнения в любой бактериологической лаборатории. Однако с учетом высокой стоимости Е-тестов для рутинной работы обычно используют диско-диффузионный метод.
Методы разведения основаны на использовании двойных последовательных разведений концентраций антибиотика от максимальной к минимальной (например от 128 мкг/мл, 64 мкг/мл, и т.д. до 0,5 мкг/мл, 0,25 мкг/мл и 0,125 мкг/мл). При этом антибиотик в различных концентрациях вносят в жидкую питательную среду (бульон) или в агар. Затем бактериальную суспензию определенной плотности, соответствующую стандарту мутности 0,5 по MсFarland, помещают в бульон с антибиотиком или на поверхность агара в чашке. После инкубации в течение ночи при температуре 35о-37оС проводят учет полученных результатов. Наличие роста микроорганизма в бульоне (помутнение бульона) или на поверхности агара свидетельствует о том, что данная концентрация антибиотика недостаточна, чтобы подавить его жизнеспособность. По мере увеличения концентрации антибиотика рост микроорганизма ухудшается. Первую наименьшую концентрацию антибиотика (из серии последовательных разведений), где визуально не определяется бактериальный рост принято считать минимальной подавляющей концентрацией (МПК). Измеряется МПК в мг/л или мкг/мл (рис. 3).
|

Рисунок 3. Определение значения МПК методом разведения в жидкой питательной среде.
71. Принципы рациональной антибиотикотерапии.
Профилактика развития осложнений состоит, прежде всего, в соблюдении принципов рациональной антибиотикотерапии (антимикробной химиотерапии):
• Микробиологический принцип. До назначения препарата следует установить возбудителя инфекции и определить его индивидуальную чувствительность к антимикробным химиотерапевтическим препаратам. По результатам антибиотикограммы больному назначают препарат узкого спектра действия, обладающий наиболее выраженной активностью в отношении конкретного возбудителя, в дозе, в 2—3 раза превышающей минимальную ингибирующую концентрацию. Если возбудитель пока неизвестен, то обычно назначают препараты более широкого спектра, активные в отношении всех возможных микробов, наиболее часто вызывающих данную патологию. Коррекцию лечения проводят с учетом результатов бактериологического исследования и определения индивидуальной чувствительности конкретного возбудителя (обычно через 2-3 дня). Начинать лечение инфекции нужно как можно раньше (во-первых, в начале заболевания микробов в организме меньше, во-вторых, препараты активнее действуют на растущих и размножающихся микробов).
• Фармакологический принцип. Учитывают особенности препарата — его фармакокинетику и фармакодинамику, распределение в организме, кратность введения, возможность сочетания препаратов и т. п. Дозы препаратов должны быть достаточными для того, чтобы обеспечить в биологических жидкостях и тканях микробостатические или микробоцидные концентрации. Необходимо представлять оптимальную продолжительность лечения, так как клиническое улучшение не является основанием для отмены препарата, потому что в организме могут сохраняться возбудители и может быть рецидив болезни. Учитывают также оптимальные пути введения препарата, так как многие антибиотики плохо всасываются из ЖКТ или не проникают через гематоэнцефалический барьер.
• Клинический принцип. При назначении препарата учитывают, насколько безопасным он будет для данного пациента, что зависит от индивидуальных особенностей состояния больного (тяжесть инфекции, иммунный статус, пол, наличие беременности, возраст, состояние функции печени и почек, сопутствующие заболевания и т.п.) При тяжелых, угрожающих жизни инфекциях особое значение имеет своевременная антибиотикотерапия. Таким пациентам назначают комбинации из двух-трех препаратов, чтобы обеспечить максимально широкий спектр действия. При назначении комбинации из нескольких препаратов следует знать, насколько эффективным против возбудителя и безопасным для пациента будет сочетание данных препаратов, т. е. чтобы не было антагонизма лекарственных средств в отношении антибактериальной активности и не было суммирования их токсических эффектов.
• Эпидемиологический принцип. Выбор препарата, особенно для стационарного больного, должен учитывать состояние резистентности микробных штаммов, циркулирующих в данном отделении, стационаре и даже регионе. Следует помнить, что антибиотикорезистентность может не только приобретаться, но и теряться, при этом восстанавливается природная чувствительность микроорганизма к препарату. Не изменяется только природная устойчивость.
• Фармацевтический принцип. Необходимо учитывать срок годности и соблюдать правила хранения препарата, так как при нарушении этих правил антибиотик может не только потерять свою активность, но и стать токсичным за счет деградации. Немаловажна также и стоимость препарата.
71. Лекарственная устойчивость микроорганизмов и механизм ее возникновения. Понятие о госпитальных штаммах микроорганизмов. Пути преодоления лекарственной устойчивости.
Антибиотикорезистентность — это устойчивость микробов к антимикробным химиопрепаратам. Бактерии следует считать резистентными, если они не обезвреживаются такими концентрациями препарата, которые реально создаются в макроорганизме. Резистентность может быть природной и приобретенной.
Природная устойчивость. Некоторые виды микробов природно устойчивы к определенным семействам антибиотиков или в результате отсутствия соответствующей мишени (например, микоплазмы не имеют клеточной стенки, поэтому не чувствительны ко всем препаратам, действующим на этом уровне), или в результате бактериальной непроницаемости для данного препарата (например, грамотрицательные микробы менее проницаемы для крупномолекулярных соединений, чем грамположительные бактерии, так как их наружная мембрана имеет «маленькие» поры).
Приобретенная устойчивость. Приобретение резистентности — это биологическая закономерность, связанная с адаптацией микроорганизмов к условиям внешней среды.
Генетические основы приобретенной резистентности. Устойчивость к антибиотикам определяется и поддерживается генами резистентности (r-генами) и условиями, способствующими их распространению в микробных популяциях. Приобретенная лекарственная устойчивость может возникать и распространяться в популяции бактерий в результате:
• мутаций в хромосоме бактериальной клетки с последующей селекцией (т. е. отбором) мутантов. Особенно легко селекция происходит в присутствии антибиотиков, так как в этих условиях мутанты получают преимущество перед остальными клетками популяции, которые чувствительны к препарату. Мутации возникают независимо от применения антибиотика, т. е. сам препарат не влияет на частоту мутаций и не является их причиной, но служит фактором отбора. Далее резистентные клетки дают потомство и могут передаваться в организм следующего хозяина (человека или животного), формируя и распространяя резистентные штаммы. Мутации могут быть: 1) единичные (если мутация произошла в одной клетке, в результате чего в ней синтезируются измененные белки) и 2) множественные (серия мутаций, в результате чего изменяется не один, а целый набор белков, например пенициллинсвязывающих белков у пенициллин-резистентного пневмококка);
• переноса трансмиссивных плазмид резистентности (R-плазмид). Плазмиды резистентности (трансмиссивные) обычно кодируют перекрестную устойчивость к нескольким семействам антибиотиков. Впервые такая множественная резистентность была описана японскими исследователями в отношении кишечных бактерий. Сейчас показано, что она встречается и у других групп бактерий. Некоторые плазмиды могут передаваться между бактериями разных видов, поэтому один и тот же ген резистентности можно встретить у бактерий, таксономически далеких друг от друга. Например, бета-лактамаза, кодируемая плазмидой ТЕМ-1, широко распространена уграмотрицательных бактерий и встречается укишечной палочки и других кишечных бактерий, а также у гонококка, резистентного кпенициллину, и гемофильной палочки, резистентной к ампициллину;
• переноса транспозонов, несущих r-гены (или мигрирующих генетических последовательностей). Транспозоны могут мигрировать с хромосомы на плазмиду и обратно, а также с плазмиды на другую плазмиду. Таким образом, гены резистентности могут передаваться далее дочерним клеткам или при рекомбинации другим бактериям-реципиентам.
Реализация приобретенной устойчивости. Изменения в геноме бактерий приводят к тому, что меняются и некоторые свойства бактериальной клетки, в результате чего она становится устойчивой к антибактериальным препаратам. Обычно антимикробный эффект препарата осуществляется таким образом: агент должен связаться с бактерией и пройти сквозь ее оболочку, затем он должен быть доставлен к месту действия, после чего препарат взаимодействует с внутриклеточными мишенями. Реализация приобретенной лекарственной устойчивости возможна на каждом из следующих этапов:
• модификация мишени. Фермент-мишень может быть так изменен, что его функции не нарушаются, но способность связываться с химиопрепаратом (аффинность) резко снижается или может быть включен «обходной путь» метаболизма, т. е. в клетке активируется другой фермент, который не подвержен действию данного препарата.
• «недоступность» мишени за счет снижения проницаемости клеточной стенки и клеточных мембран или «эффлюко»-механизма, когда клетка как бы «выталкивает» из себя антибиотик.
• инактивация препарата бактериальными ферментами. Некоторые бактерии способны продуцировать особые ферменты, которые делают препараты неактивными (например, бета-лактамазы, аминогликозид-модифицирующие ферменты, хлорамфениколацетилтрансфераза). Бета-лактамазы — это ферменты, разрушающие бета-лактамное кольцо с образованием неактивных соединений. Гены, кодирующие эти ферменты, широко распространены среди бактерий и могут быть как в составе хромосомы, так и в составе плазмиды.
Для борьбы с инактивирующим действием бета-лактамаз используют вещества — ингибиторы (например, клавулановую кислоту, сульбактам, тазобактам). Эти вещества содержат в своем составе бета-лактамное кольцо и способны связываться с бета-лактамазами, предотвращая их разрушительное действие на бета-лактамы. При этом собственная антибактериальная активность таких ингибиторов низкая. Клавулановая кислота ингибирует большинство известных бета-лактамаз. Ее комбинируют с пенициллинами: амоксициллином, тикарциллином, пиперациллином.
Предупредить развитие антибиотикорезистентности у бактерий практически невозможно, но необходимо использовать антимикробные препараты таким образом, чтобы не способствовать развитию и распространению устойчивости (в частности, применять антибиотики строго по показаниям, избегать их использования с профилактической целью, через 10—15 дней антибиотикотерапии менять препарат, по возможности использовать препараты узкого спектра действия, ограниченно применять антибиотики в ветеринарии и не использовать их как фактор роста).
Внутрибольничная инфекция — это инфекция, заражение которой происходит в больничных учреждениях: наслаиваясь на основное заболевание, она утяжеляет клиническое течение болезни, затрудняет диагностику и лечение, ухудшает прогноз и исход заболевания, нередко приводя к смерти больного.
Внутрибольничная инфекция (ВБИ) является одной из форм ятрогенных, т. е. связанных с медицинскими вмешательствами, заболеваний. Возбудителями ВБИмогут быть патогенные микробы, например, в случаях госпитализации инфекционного больного в соматические отделения, неправильной или несовершенной изоляции больных в инфекционных отделениях, заноса возбудителей в больницы посетителями во время эпидемий.






