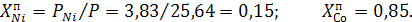Концентрация компонента выражена в долях единицы или процентах:
мольная доля 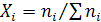
массовая доля 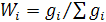
объёмная доля 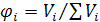 ,
,
где ni, gi, Vi – число молей, масса и объём данного компонента, а сумма этих величин относится к раствору в целом.
Мольный, массовый и объёмный процент – это соответствующие доли, увеличенные в 100 раз. Обозначение: мол.%, мас.%, об.%.
По аналогии с молем вещества вводится понятие моль раствора (М) – это такое его количество, в котором число молей каждого компонента равно его мольной доле:
M=ΣXiMi.
Концентрация компонента выражена содержанием его в единице объёма раствора:
МолярностьCi – число молей растворённого вещества в литре раствора (моль/дм3),
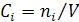 ;
;
Нормальность Ni – число грамм-эквивалентов растворённого вещества в литре раствора (г-экв/дм3),
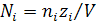 ,
,
где zi – валентность иона;
Концентрация в граммах компонента в литре раствора (г/дм3):
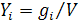 .
.
Концентрацию компонента выражают числом молей, содержащихся в килограмме растворителя А, называют моляльностью mi, моль/кг:
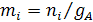 .
.
Перейти от одних концентрационных единиц к другим можно, зная молекулярные массы компонентов и плотность раствора (г/см3). Эта величина определяется как отношение
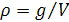 .
.
По плотности можно рассчитать молярный объём V, т.е. объём, который занимает один моль раствора (см3/моль):
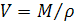 .
.
Задание к расчёту концентраций
| № | Растворитель | Растворённое | Концентрация | Плотность, г/см3 | ||
| п/п | (1) | вещество (2) | Р-р | |||
| H2O | C2H5OH | 20 об.% | 1,0 | 0,8 | - | |
| H2O | H2SO4 | 100 г/дм3 | 1,0 | - | 1,05 | |
| H2O | Co SO4 | 1 моль/дм3 | 1,0 | - | 1,12 | |
| H2O | NaCI | 10 мас.% | 1,0 | - | 1,06 | |
| H2O | CaCI2 | 10 мол.% | 1,0 | - | 1,08 | |
| H2O | Zn SO4 | 120 г/ дм3 | 1,0 | - | 1,18 | |
| H2O | Na2O | 330 г/ дм3 | 1,0 | - | 1,24 | |
| H2O | Cu SO4 | 140 г/ дм3 | 1,0 | - | 1,10 | |
| AI | Si | 12 мас.% | 2,37 | 2,53 | - | |
| AI | Mg | 5 об.% | 2,37 | 1,59 | - | |
| AI | Zn | 5 мол.% | 2,37 | 6,57 | - | |
| AI | Cu | 1 моль/кг | 2,37 | 8,0 | - | |
| AI | Pb | 20 об.% | 2,37 | 10,2 | - | |
| AI | Cd | 4 см3/кг | 2,37 | 8,0 | - | |
| Mg | AI | 8 мол.% | 1,59 | 2,37 | - | |
| Mg | Be | 1 об.% | 1,59 | 1,68 | - | |
| Mg | Li | 5 мас.% | 1,59 | 0,51 | - | |
| Mg | Pb | 1 моль/кг | 1,59 | 10,6 | - | |
| Na3AIF6 | AI2O3 | 5 мас.% | 2,15 | 3,96 | - | |
| KCI | NaCI | 10 мол.% | 2,0 | 2,16 | - | |
| AI2O3 | MgO | 5 мол.% | 3,90 | 3,60 | - | |
| AgNO3 | KNO3 | 10 мас.% | 3,82 | 1,87 | - | |
| Fe | C | 3 мас.% | 7,84 | - | 7,25 | |
| AIF3 | NaF | 30 мол.% | - | - | - | |
| MgCI2 | Mg | 0,1 моль/кг | 2,32 | 1,59 | - |
Основные термодинамические функции идеального раствора
| Функция | G(F) | H(U) | S | V |
| 
| 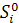 - RInXi - RInXi
| 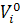
| |
| Ф | ΣXiµi | ΣXi 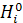
| ΣXi(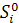 - RInXi) - RInXi)
| ΣXi 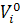
|
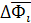
| RTInXi | - RInXi | ||
| ∆Ф | RTΣXiInXi | - RΣXiInXi |
Задание: Кобальт и никель при 1950 К образуют раствор, близкий к идеальному. Определить суммарное давление и состав пара над сплавом, содержащим 40 мол.%никеля. Зависимость давления пара чистых веществ (Па) от температуры даётся в виде уравнений
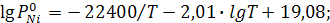
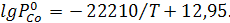
Решение: Подставим заданное значение температуры в уравнения и определим давление пара чистых металлов:
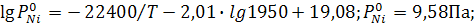
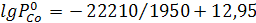 ;
; 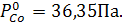
Определим парциальные давления компонентов по уравнению
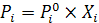
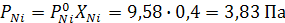
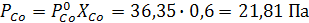
Суммарное давление пара
P=PNi+PCo=3,83 +21,81=25,64 Па
Найдём концентрацию компонентов в паре: