Сухой остаток представляет собой сумму всех водно-растворимых веществ перешедших в вытяжку.
С помощью пипетки берут 50 мл вытяжки и помещают ее в предварительно взвешенный стеклянный бюкс или фарфоровую чашку. Содержимое выпаривают на водяной бане и высушивают в термостате при1500 до постоянного веса.
Охлаждают в эксикаторе и взвешивают. Вычисляют по формуле:
m = а*10* КГ, где
m- общее содержание воднорастворимых солей, % к почве
а - масса осадка после выпаривания и высушивания, г
10- коэффициент для перевода в % так как вся навеска 100 г
Кг – коэффициент гигроскопичности
в) определение рН водной вытяжки Берут 5 мл вытяжки и определяют рН потенциометрически или колориметрически по шкале образцовых растворов.
г) определение хлор-ионов В пробирку наливают 5 мл водной вытяжки и подкисляют ее двумя каплями 10% раствора H2SO4. К фильтрату прибавляют 5-7 капель 5% раствора AgNO3 и содержимое перемешивают. При присутсвии солей хлора образуется осадок AgCI.
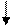 NaCI+AgNO3 = AgCI +NaNO3 По количеству выпавшего осадка или характера помутнения отмечают: хлориды отсутствуют, мало, много, очень много.
NaCI+AgNO3 = AgCI +NaNO3 По количеству выпавшего осадка или характера помутнения отмечают: хлориды отсутствуют, мало, много, очень много.
д) определение сульфат иона Наличие иона SO4 в водной вытяжке можно установить действием на ее раствора хлористого бария. Если вытяжке содержатся в заметных количествах сульфата, то они, вступая во взаимодействие с BaCI2 образуют нерастворимую соль BaSO4.  Na2SO4 + BaCI2 = BaSO4 +2 NaCI
Na2SO4 + BaCI2 = BaSO4 +2 NaCI
Наливают в пробирку около 5 мл водной вытяжки. Затем приливают в пробирку 1 мл 10% раствора BaCI2 и кипятят жидкость в течение 1 минуты. По количеству выпавшего осадка или характера помутнения вытяжки отмечают: отсутствует, мало, много, очень много.
е) определение кальций иона Присутствие кальция в водной вытяжке устанавливается с помощью раствора щавелевокислого аммония, т.к. соединения кальция с этой солью образует нерастворимый осадок. Реакция происходит по следующей схеме:
 CaCI2 + (NH4)2C2O4 = CaC2O4 + 2 NH4CI
CaCI2 + (NH4)2C2O4 = CaC2O4 + 2 NH4CI
В пробирку собирают около 5 мл вытяжки, добавляют в нее 5 мл щавелевокислого аммония (4% р-р) и подкисляют ее несколькими каплями 10% раствора уксусной кислоты. Содержимое пробирки доводят до кипения. По количеству осадка щавелевокислого кальция отмечают: соединения кальция отсутствуют, мало, много, очень много.
По преобладанию тех или иных ионов определяют тип (химизм) засоления, а по характеру осадки степень засоления.
Результаты определения степени и химизма засоления почв
| Почва(район) | CI- | SO2- | Ca2+ | Phводн. | Степень засоления | Химизм засоления |
| Обр.1 | ||||||
| Обр.2 |
Оборудование: пробирки, колбы, воронки, фильтры, спиртовки.
Реактивы 1.10% раствор H2SO4 – (61 мл на 1 л воды); 2. 5% AgNO2 (5 г AgNO3 на 100 мл воды); 3. 10% раствор BaCI2 (10 г BaCI2 на 100 мл воды); 4. 4% раствор (NH4)2C2O4 – (4 г (NH4)2C2O4 на 100 мл воды); 5. 10% раствор СН3СООН – (97 мл СН3СООН на 1 л воды).
Вопросы для самоконтроля
1. Условия, факторы, способствующие процессам соленакопления в почве.
2. Актуальность изучения засолённых почв.
3. Влияние токсичных солей на свойства почв, физиологические процессы роста и развития растений.
4. Какие соли относятся к токсичным? Ряд токсичности солей.
5. Приёмы регулирования солевого режима почв и рационального использования засолённых почв.
6. Как определяется химизм (тип) засоления почв?






