Решение:
Рассчитаем титр соляной кислоты по карбонату натрия:
T(HCl/Na2CO3)=m(Na2CO3)/V(HCl)=0.2167/21=0.01032 г/мл
В пересчете на гидроксид натрия:
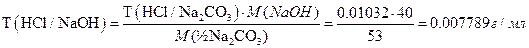
67. Навеска образца оксида цинка 0,2046 г растворена в 50,00 мл раствора серной кислоты с титром 0,004904 г/мл. Избыток кислоты оттитрован 10,00 мл раствора NаОН с титром 0,004040 г/мл. Вычислите процентное содержание ZnO в образце.
Решение:
Запишем уравнения реакций:
ZnO + H2SO4 = ZnSO4 + H2O
H2SO4 + 2NaOH = Na2SO4 + 2H2O
Обратное титрование, закон эквивалентов:
n(½ZnO)=n(½H2SO4)-n(NaOH)
рассчитаем молярные концентрации эквивалентов для гидроксида натрия и серной кислоты:

Тогда массовую долю оксида цинка в навеске:
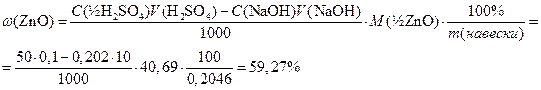
77. Навеску 2,5 г технического хлорида натрия растворили в 500 мл воды. На титрование 10 мл полученного раствора затратили 16,85 мл 0,0005 N раствора нитрата серебра. Каково процентное содержание хлорида натрия в образце?
Решение:
Запишем уравнения реакций:
NaCl + AgNO3 = AgCl + NaNO3
Прямое титрование, метод аликвотных частей, закон эквивалентов:
n(NaCl)=n(AgNO3)
массовая доля хлорида натрия в навеске:

* скорее всего в условии задачи опечатка, и концентрация нитрата серебра не 0,0005н, а 0,05н (в осадительном титровании как правило не используют настолько разбавленные растворы), тогда массовая доля хлорида серебра будет равна 98,47%
87. Сколько процентов железа содержит руда, если на титрование раствора, полученного при растворении навески руды 0,2500 г в соляной кислоте, израсходовано 28,00 мл 0,09950 н. раствора КМnО4?
Решение:
Запишем уравнение реакции:
5FeCl2 + KMnO4 + 8HCl = 5FeCl3 + KCl + MnCl2 + 4H2O
Прямое титрование, метод отдельных навесок, закон эквивалентов:
n(Fe)=n(1/5 KMnO4)
массовую долю железа в руде можно рассчитать по формуле:

97. Определите жесткость воды, если к 50 см3 воды добавлено 25,00 см3 0,0500 N раствора комплексона III и на титрование избытка его израсходовано 20,00 см3 0,0500 N раствора сульфата магния.
Решение:
Запишем уравнения реакций:
Ca2++H2EDTA2-=CaEDTA2-+2H+
Mg2++H2EDTA2-=MgEDTA2-+2H+
Обратное титрование, закон эквивалентов:
n(Ca2+)=n(ЭДТА)-n(Mg2+)
жесткость воды можно рассчитать по формуле:

107. Какого рода ошибки опыта Вам известны? Чем обусловлены и как устраняются ошибки различного рода?
Решение:
Погрешности измерений классифицируют как систематические (определенные), случайные (неопределенные) и грубые или промахи.
Систематические погрешности - это погрешности, постоянные по значению или изменяющиеся по определенному закону. Они могут быть методическими, зависящими от особенности применяемого метода анализа. Они могут зависеть от применяемых приборов и реактивов, от неправильного или недостаточно тщательного выполнения аналитических операций, от индивидуальных особенностей человека, выполняющего анализ. Систематические погрешности трудно заметить, так как они постоянны и появляются при повторном определении. Чтобы избежать погрешностей такого рода, надо устранить их источник либо ввести соответствующую поправку в результат измерения.
Случайными погрешностями называют неопределенные по величине и знаку ошибки, в появлении каждой из которых не наблюдается какой-либо закономерности.
Случайные погрешности происходят при всяком измерении, и в том числе при любом аналитическом определении, как бы тщательно оно не проводилось. Наличие их сказывается в том, что повторные определения того или иного компонента в данном образце, выполненные одним и тем же методом, дают, как правило, несколько различающиеся между собой результаты.
Влияние случайных погрешностей на результат анализа может быть учтено теоретически, путем обработки результатов, полученных в серии параллельных определений данного компонента, с помощью методов математической статистики.
Наличие грубых погрешностей или промахов проявляется в том, что среди сравнительно близких результатов наблюдается одно или несколько значений, заметно выделяющихся по величине из общего ряда. Если отличие настолько велико, что можно говорить о грубой ошибке, то это измерение сразу отбрасывают. Однако в большинстве случаев нельзя сразу признать тот иной результат неверным только по признаку «выскакивания» из общего ряда, и поэтому необходимо провести дополнительные исследования.
Таких критериев известно несколько. Самым простым из них является Q-критерий
117.Вычислить мольную рефракцию бромоформа CHBr3.
Решение:
По таблице атомных рефракций находим атомные рефракции для углерода  = 2,418 и для брома
= 2,418 и для брома  = 8,865 и для водорода.
= 8,865 и для водорода.  = 1,100
= 1,100

При фотометрическом определение титана с хромотроповой кислотой в растворе, содержащем 11.496 мкг титана в 10мл, кювете толщиной слоя в 2см, была получена оптическая плотность, равная 0.23. Определить молярный коэффициент погашения окрашенного соединения.
Решение:
Рассчитаем молярную концентрацию титана:

Тогда молярный коэффициент погашения:

137. Вычислить потенциал при титрование 0.0100 N раствора НСООН 0.1000 N раствором КОН в точке эквивалентности. Индикаторный электрод- хингидронный; электрод сравнения- насыщенный каломельный электрод, температура 30о С.
Решение:
Запишем уравнение реакции:
HCOOH + KOH = HCOOK + H2O
Рассчитаем рН в точке эквивалентности (растворе находится соль слабой кислоты и сильного основания):
рН=7 + 1/2 рКкисл + 1/2 lg Cсоли
концентрация соли:
С(HCOOK)=0,01*100/(100+10)=0,0091н
рК=3,75
рН= 7+3,75/2+lg0,0091/2=6,53
потенциал хингидронного электрода рассчитывается по формуле:

Е=0,699+RT/Fln[H+] = 0.699+8.31*303/96500*ln10-6.53=0.307В
Потенциал насыщенного каломельного электрода при 30о С: 0,241В
Тогда ЭДС: 0,307-0,241=0,066В
147. Определите силу тока в ячейке, содержащей 0,1 N раствор нитрата натрия, с электродами площадью 2,0 см2 и расстояние между ними 10 мм, если прилагаемое напряжение равно 6,25 В и эквивалентная электропроводимость 200.
Решение:
Удельное сопротивление раствора:
ρ=1000/ λ С =1000/200*0,1=50 Ом∙ см
сопротивление раствор рассчитаем по формуле:
 ,
,
где ρ – удельное сопротивление, Ом•см.
При ℓ = 1 см и S = 1 см2, имеем R = ρ, следовательно удельное сопротивление равно сопротивлению 1 см3 раствора.

I=E/R=6.25/25=0.25А






