Ростов-на-Дону
Г.
УДК 541.2
Методические указания по дисциплине «химия». «Электролитическая диссоциация». – Ростов н/Д: Рост.гос.строит.ун-т, 2011. – 8 с.
Изложена информация по классификации, номенклатуре, химическим свойствам и получению основных классов неорганических соединений. Рассчитаны на студентов, изучающих курс общей и неорганической химии на дневном и заочном отделениях.
Составитель: к.х.н., доц. Астахова Л.М.
Редактор Т.М. Климчук
Темплан 2011 г., поз. __________________________________________________________________
Подписано в печать
Формат 60x84/16. Бумага белая. Ризограф.
Уч.-изд.л. 1,0. Тираж 100 экз. Заказ
__________________________________________________________________
Редакционно-издательский центр
Ростовского государственного строительного университета
344022, Ростов-на-Дону, ул. Социалистическая, 162
© Ростовский государственный
строительный университет, 2011
Вещества, растворы (или расплавы) которых проводят электрический ток, называются э л е к т р о л и т а м и. Нередко электролитами называют и сами растворы этих веществ. Эти растворы (расплавы) электролитов являются проводниками второго рода, так как передача электричества осуществляется в них движением и о н о в - заряженных частиц. Частица, заряженная положительно называется катионом (Са+2), частица несущая отрицательный заряд - анионом (ОН־). Ионы могут быть простые (Са+2, Н+) и сложные (РО4 ־3, НСО3 ־2).
Основоположником теории электролитической диссоциации является шведский ученый С. Аррениус. Согласно теории электролитической диссоциацией называется распад молекул на ионы при их растворении в воде, причем это происходит без воздействия электрического тока. Однако эта теория не отвечала на вопросы: какие причины обусловливают появление в растворах ионов и почему положительные ионы, сталкиваясь с отрицательными, не образуют нейтральных частиц.
Свой вклад в развитие этой теории внесли русские ученые: Д.И. Менделеев, И. А. Каблуков – сторонники химической теории растворов, обращавшие внимание на влияние растворителя в процессе диссоциации. Каблуков утверждал, что растворенное вещество взаимодействует с растворителем (процесс с о л ь в а т а ц и и) образуя продукты переменного состава (с о л ь в а т ы).
Сольват представляет собой ион, окруженный молекулами растворителя (сольватная оболочка), которых может быть разное количество (именно за счет этого достигается переменный состав). Если растворителем является вода, то процесс взаимодействия молекул растворенного вещества и растворителя называется г и д р а т а ц и е й, а продукт взаимодействия - г и д р а т о м.
Таким образом, причиной электролитической диссоциации является сольватация (гидратация). И именно сольватация (гидратация) ионов препятствует обратному соединению в нейтральные молекулы.
Количественно процесс диссоциации характеризуется величиной степени электролитической диссоциации (α), которая представляет собой отношение количества распавшегося на ионы вещества к общему количеству растворенного вещества.Отсюда следует, что для сильных электролитов
α = 1 или 100 % (в растворе присутствуют ионы растворенного вещества), для слабых электролитов 0 < α < 1 (в растворе присутствуют наряду с ионами растворенного вещества и его недиссоциированные молекулы), для неэлектролитов α = 0 (ионы в растворе отсутствуют). Помимо природы растворенного вещества и растворителя величина α зависит от концентрации раствора и температуры.
Если растворителем является вода, к сильным электролитам относятся:
1) все соли;
2) следующие кислоты: HCl, HBr, HI, H2SO4, HNO3, HClO4;
3) следующие основания: LiOH, NaOH, KOH, RbOH, CsOH, Ca(OH)2, Sr(OH)2, Ba(OH)2.
Процесс электролитической диссоциации является обратимым, следовательно, его можно охарактеризовать величиной константы равновесия, которая, в случае слабого электролита, называется константой диссоциации (КД).
Чем больше эта величина, тем легче электролит распадается на ионы, тем больше его ионов в растворе. Например: HF ═ H+ + F־
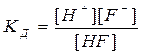 .
.
Эта величина постоянная при данной температуре и зависит от природы электролита, растворителя.
Многоосновные кислоты и многокислотные основания диссоциируют ступенчато. Например, молекулы серной кислоты в первую очередь отщепляют один катион водорода:
H2SO4 ═ Н+ + HSO4־.
Отщепление второго иона по уравнению
HSO4־═ Н+ + SO4־2
идет уже значительно труднее, так как ему приходится преодолевать притяжение со стороны двухзарядного иона SO4־2, который, конечно, притягивает к себе ион водорода сильнее, чем однозарядный ион HSO4־. Поэтому вторая ступень диссоциации происходит в гораздо меньшей степени, чем первая.
Основания, содержащие более одной гидроксильной группы в молекуле, тоже диссоциируют ступенчато. Например:
Ba(OH)2 ═ BaOH+ + OH-;
BaOH+ = Ba2+ + OH-.
Средние (нормальные) соли всегда диссоциируют на ионы металлов и кислотных остатков:
CaCl2 = Ca2+ + 2Cl-;
Na2SO4 = 2Na+ + SO42-.
Кислые соли, подобно многоосновным кислотам, диссоциируют ступенчато. Например:
NaHCO3 = Na+ + HCO3-;
HCO3- = H+ + CO3 2-.
Однако степень диссоциации по второй ступени очень мала, так что раствор кислой соли содержит лишь незначительное число ионов водорода.
Основные соли диссоциируют на ионы основных и кислотных остатков. Например:
Fe(OH)Cl2 = FeOH2+ + 2Cl-.
Вторичной диссоциации ионов основных остатков на ионы металла и гидроксила почти не происходит.
Ионные реакции в растворах
Чтобы узнать, будет ли протекать та или иная реакция между сильными электролитами в водных растворах, необходимо помимо уравнения реакции в молекулярном виде уметь писать это же уравнение в полном ионном и сокращенном ионном виде.
Рассмотрим возможную реакцию взаимодействия водных растворов KNO3 и NaCl. В молекулярном виде уравнение выглядит следующим образом:
KNO3 + NaCl = KCl + NaNO3.
Запишем это же уравнение реакции в ионном виде, учитывая, что все его участники – средние соли, а значит, в воде полностью диссоциируют на ионы:
K+ + NO 3- + Na+ + Cl- = K+ + Cl- + Na+ + NO 3-.
После сокращения одинаковых ионов (сократятся все ионы) можно однозначно сделать вывод, что данная реакция в растворах идти не будет.
Таким образом, основными условиями протекания ионных реакций являются:
1. Образование в результате ионной реакции плохорастворимого вещества. Например, если в предыдущей реакции заменить KNO3 на AgNO3, получим:
AgNO3 + NaCl = AgCl↓ + NaNO3 – молекулярное уравнение реакции;
поскольку AgCl – нерастворим в воде, то в ионном виде уравнение реакции можно записать следующим образом:
Ag+ + NO 3- + Na+ + Cl- = AgCl↓ + Na+ + NO 3- - полное ионное уравнение.
После сокращения получаем сокращенное ионное уравнение реакции:
Ag+ + Cl- = AgCl↓.
2. Образование слабодиссоциирующего вещества. Например, при взаимодействии NaOH и HCl:
NaOH + HCl = NaCl + H2O.
Так как вода – очень слабый электролит, то она остается в виде молекул.
Na+ + OH- + H+ + Cl- = Na+ + Cl- + H2O – полное ионное уравнение.
OH- + H+ = H2O – сокращенное ионное уравнение.
Из последнего уравнения видно, что любая реакция нейтрализации сильной кислоты сильным основанием сводится к образованию слабого электролита – молекул воды – путем взаимодействия ионов водорода и гидроксид-ионов.
3. Образование газообразных веществ. Например:
Na2CO3 + H2SO4 = Na2SO4 + H2O + CO2↑ - молекулярное уравнение;
2Na+ + CO32- + 2H+ + SO 42- = 2Na+ + SO 42- + H2O + CO2↑ - полное ионное уравнение;
CO32- + 2H+ = H2O + CO2↑ - сокращенное ионное уравнение.
Экспериментальная часть




