Содержание
Введение....................................................................................................... 5
I. Характеристика семейства: Retroviridae.................................................. 6
1.1 Архитектура вириона............................................................................ 6
1.2 Генетика.................................................................................................. 6
1.3 Репродукция........................................................................................... 7
1.4 Биологические характеристики............................................................. 9
II. Роды Retroviridae................................................................................. 11
II.I. Род: Deltaretrovirus. Вирус лейкемии КРС........................................ 17
1 Этиология................................................................................................ 17
2 Патогенез................................................................................................. 18
2.1 Патогенез организма........................................................................... 18
3 Клиническая картина.............................................................................. 20
4 Диагностика............................................................................................ 22
5 Лечение и профилактика........................................................................ 24
Заключение................................................................................................. 26
Список используемых источников............................................................ 27
Введение
Вирусология - наука о морфологии, физиологии, генетике. Экологии и эволюции вирусов. Медицинская и ветеринарная вирусология исследует вирусы паразиты человека и животных, их роль в этиологии и патогенезе инфекционных и опухолевых болезней, разрабатывает специальные методы диагностики, способы этиотропой терапии и специфической профилактики. (Сизенцов А. Н.,2010)
Вирусы способны поражать все известные формы жизни. Следует помнить, что способность вирусов вносить новую информацию в генный аппарат клетки-хозяина определяет их роль, как одного из важных факторов изменчивости и биологической эволюции живого, помимо этого с вирусами связывают возникновение онкологических заболеваний, атеросклеротические изменения в микроорганизме, разнообразные поражения центральной нервной системы и ряд других патологических процессов.
Зародившись на рубеже IX и XX вв. вирусология является одной из наиболее интенсивно развивающихся наук тесно связанной с микробиологией, иммунологией, молекулярной биологией, генетикой, физикой и рядом других научных направлений. (Сизенцов А. Н., Исайкина Е. Ю., Каримов И. Ф., Кван О. В., 2015)
Цель работы – изучить строение ретровирусов и его этиологию и патогенез на примере вируса лейкемии КРС.
Задачи:
1) Провести информационный поиск литературы по данной теме;
2) Узнать основные особенности ретровирусов;
3) Определить основные особенности этиологии и патогенеза вируса лейкемии КРС;
4) Сделать вывод о значении ретровирусов в заболеваниях.
I Характеристика семейства Retroviridae
В семейство Retroviridae входят 6 родов: Aipharetrovirus, Betaretrovirus, Gammaretrovirus, Deltaretrovirus, Epsilonretrovirus, Lentivirus и Spumavirus.
Архитектура вириона
Вирион сферический (диаметр равен от 80нм до 100нм) оболочечный, с гликопротеиновым поверхностными выступами (8нм в длину). Внутреннее ядро включает сферический нуклеотид (нуклеоид), расположен эксцентрично у представителей рода Betaretrovirus, по центру у Aipharetrovirus, Gammaretrovirus, Deltaretrovirus и Spumavirus, и в виде стержня или усеченного конус у представителя рода Lentivirus.
Выделяют два пути морфогенеза. Исторически номенклатура, основывалась на электронной микроскопии классифицировав членов рода Aipharetrovirus и Gammaretrovirus, у которого сборка незрелого капсида происходит на плазме мембраны, как вирус типа С. По отношению к членам рода Betaretrovirus считалось, что сборка их частиц тип А (незрелых капсидов) совершается в цитоплазме с последующим почкованием по морфологическому типу В (MMTV) или D (Mason-Pfizer monkey virus, M-PMV).
Вирусы восприимчивы к нагреванию, детергентам и формальдегиду. Поверхностные гликопротеины могут быть частично удалены протеолитическими ферментами. Они относительно устойчивы к ультрафиолетовому облучению. Плавучая плотность вириона составляет от 1,16г/  до 1,18г/
до 1,18г/  .
.
Генетика
Геном выступает в виде димера молекул РНК (мономер РНК: односпиральная, линейная с позитивной полярностью, размер от 7kb (kilo base (килобаза) – тысяча оснований) до 11kb, что составляет 2% сухого веса вириона. Мономеры вирусов семейства Retroviridae связываются друг с другом водородной связью, причем каждый мономер полиаденилирован и кэпирован по 3'- и 5'-концу, соответственно. Очищенная вируса РНК не инфекционна. Каждый мономер комплементарно ассоциирован со специфической молекулой тРНК. РНК и фрагменты ДНК, клеточного происхождения могут случайно оказаться в составе вириона.
Репродукция
Вирион содержит две копии генома. Инфекционный вирус несет четыре основных гена, кодируются вирусные протеины в следующем порядке: 5’- gag-pro-pol-env-У. Отдельные ретровирусы несут гены, кодирующие неструктурные протеины, играющие значительную роль в регуляции экспрессии генов и репликции вируса (например, у вируса саркомы Payca- Rouse sarcoma virus, RSV) или в виде замен при делециях вирусных последовательностей (например, у вируса саркомы мышей- Murine sarcoma virus). Такие делеции ведут к нарушению репликации вируса и зависят от нетрансформирующихся вирусов-помощников, необходимые для формирования инфекционного потомства. Во многих случаях последовательности клеточного происхождения формируют гибриды с генами вирусных структурных белков, которые транслируются в один химерный протеин (например, gag-one).
Проникновение в клетку обусловливается взаимодействием гликопротеином вириона и специфическими рецепторами на клеточной поверхности, последствием чего является объединением вирусной оболочки и клеточной мембраны и эндоцитоз. Отдельные из клеточных рецепторов были идентифицированы.
Репликация начинается с обратной транскрипции (при участии обратной транскриптазы, RT) вирусной РНК в кДНК, с использованием 3’-конца тРНК в качестве праймера. Синтез кДНК сопровождается разрезанием вирусного РНК (за счет RNAse H активности RT). Продукты гидролиза служат для первичного синтеза кДНК с негативной полярностью. Процесс обратной транскрипции обуславливается высокой частотой рекомбинации.
Ретровирусы ДНК интегрируются в хромосомную ДНК клетки, образуя провирус, приучастии вируса протеина IN. Слияние конца вируса ДНК с клеточной сопровождается удалением двух оснований с концовкой вируса ДНК и формирующегося короткого дуплекса клеточного сиквенс в сайте интеграции. IN вирусного генома может совершаться по многим сайтам клеточного геном. Тем не менее однажды интегривовшись, сиквенс уже не может изменить свою позицию внутри той же клетки. Карта интегрирования провируса колинеарна неинтегрированной вирусной ДНК. Интеграция предшествует вирусной репликации (рисунок 1).
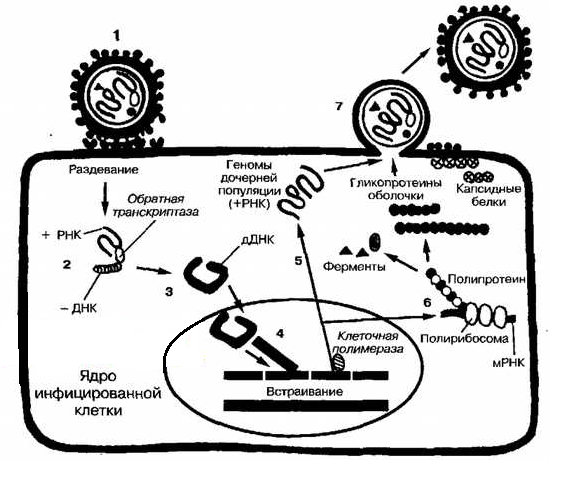
Рисунок 1 – Репродукция вируса.
Интегрирование провирусов траскрибируются клеткой РНК полимеразой II в вирионную РНК и мРНК в ответ на трнскрипционный сигнал в вирусе LTRs. У вирусов отдельных родов транскрипция также регулируется вирусами трансактиваторами. В зависимости от вируса и генной карты различают несколько классов мРНК. мРНК, содержащий весь геном предназначается для трансляции генов gag, pro, pol (находящийся в 5’- половине РНК), продуктом которого являются полипротеин- предшественник, разрезаемый до структурных протеинов, полимеразы, RT и IN, соответственно.
Меньшие РНК, содержащие 5’- конец генома, после сплайсинга с сиквенсом 3’-конца генома, и содержащий ген env, участки U3 и R, транслируются в предшественники оболочечных протеинов.
Инфекционная вирусная частица (1) пробирается в клетку посредством слияния с клеточной стенкой после адсорбции на ней. После чего вирус раздевается (2), а обратная транскриптаза RT (входящая в состав вирусной частицы) индуцирует синтез –ДНК, применяя в начальной матрицы молекулу РНК (3). +ДНК копируется с вновь синтезируемой молекулой –ДНК, в результате чего образуется двойная цепь ДНК (дДНК) (4). дДНК транспортируется в ядро клетки, где клетка ДНК подвергается сплайсингу с образованием рекомбинантов с вирусной ДНК (5). Интегрируемая молекула ДНК транскрибируется клеточной ДНК-зависимой РНК-полимеразой в +РНК, применяемую в качестве геномов дочерних популяций (6), а также транспируются как мРНК для синтеза (через стадию формирования полипротеинов) структурных белков и ферментов (7). Некоторая часть +РНК подвергается сплайсингу с образованием мРНК малого размера, кодируя поверхностные, регуляторные и добавочные белки (8). Зрелые дочерние популяции высвобождаются почкованием (9).
У вирусов имеющих дополнительные гены, может происходить другой сплайсинг, но все таки РНК будет иметь общий 5’-концевой сиквенс. Спумавирусы уникальны в том, что могут употреблять внутренний промотор, расположенный в гене env выше доступа к рамке считывания. Большинство первично транспированных продуктов представляют собой полипротеины, подвергающиеся протеолитическому разрезанию для приобретения функциональной активности. Продукты генов gag, pro и pol обычно являются вторичными после первичной трансляции продуктов. Для трансляции pro к pol используется обходные трансляционныые терминирующие сигналы.
Сборка капсида происходит на плазматической мембране (вирусы большинства родов), либо как внутрицитоплазматические частицы (Beta- и Spumavirus), и высвобождаются из клетки почкованием.полипротеиновый процессинг внутренних протеинов случается попутно или последовательно с формированием вириона.
Биологические характеристики
Протеины составляют приблизительно 60% сухого массы вируса. Два оболочных протеина: SU (surface - поверхностный) и TM (transmembrane- трансмембранный), кодируют вирусный геном gag. Расположенный от N -конца: (I) МА (matrix - матрикс), (2) протеин, обнаруженный у некоторых вирусов, с неопределенной функцией, (3) СА (capsid protein - капсидный протеин), (4) NC (nucleocapsid - нуклеокапсид). Протеин МА часто ацилирован, с меристемовой частью, ковалентно связаной с аминоконцевым глицином. К другим протеинам причисляют: протаза (PR, кодируемая геном pro), обратная транскриптаза (RT, кодируемая геном pol) и интеграза (IN, кодируемая геном pot). У некоторых вирусов присутствует dUTPase (DU), роль которого не ясна.
Липиды составляют приблизительно 35% сухого веса вириона, и является производным клеточной мембраны.
Углеводы составляют 3% сухого веса вириона. Как правило, оба (реже один) поверхностных оболочечных протеина гликозилированы. В вирусной оболочке также находятся клетки гликолипиды.
Ретровирусы широко распространены среди позвоночных как экзогенные агенты. Эндогенные провирусы, являются результатом произошедшего когда-либо инфицирования герминативных клеток, наследуемые по закону Менделя. Ретровирусы связаны с различными болезнями: лейкемии, лимфомы, саркомы и другие опухолевые процессы тканей мезодермального происхождения; карцинома печени, почек, молочных желез; иммунодефициты (СПИД); аутоиммуне болезни; болезнь нижних двигательных нервов и многие другие остро протекающие болезни. Некоторые ретровирусы непатогенны.
Распространение может быть горизонтальное (через кровь, слюну, половые контакты и т. п.) и вертикальное (прямое инфицирование плода; инфицирование через молоко; или при прохождении через родовые пути). Эндогенные растворы наследуются в виде провирусов.
II. Роды ретровируса
Род: Alpharetrovirus.
Типовой вид: Avian leucosis virus (ALV) (вирус лейкоза птиц)
Сборка вирусных частиц происходит на плазматической мембране по морфологии С-типа. Молекулярная масса протеинов: MA (матрикс)  ; PR (протеаза)
; PR (протеаза)  ; RT (обратная транскриптаза)
; RT (обратная транскриптаза)  ; IN (интеграза)
; IN (интеграза)  ; SU (поверхностный)
; SU (поверхностный)  ; TM
; TM  . Геном 7,2 kb (1 монономер). Расположение генов: gag-pro-pol-env. Дополнительных генов нет. LTR
. Геном 7,2 kb (1 монономер). Расположение генов: gag-pro-pol-env. Дополнительных генов нет. LTR  нуклеотидов, из которых 250 составляют участок U3, 20- синквенс R, 80- участок U5, вирусы широко распространены и являются экзо- и эндогенными вирусами уток и других видов птиц. Изоляты ALV подразделяются на подгруппы A-J по различию в используемых клеточных рецепторах. Отдаленное сходство сиквенсов выявлено у эндогенных вирусов птиц и млекопитающих. Инфекция ассоциируется с малигнизацией и другими болезнями (истощение, остеопороз). Выделено много онкогенсодержащих вирусов.
нуклеотидов, из которых 250 составляют участок U3, 20- синквенс R, 80- участок U5, вирусы широко распространены и являются экзо- и эндогенными вирусами уток и других видов птиц. Изоляты ALV подразделяются на подгруппы A-J по различию в используемых клеточных рецепторах. Отдаленное сходство сиквенсов выявлено у эндогенных вирусов птиц и млекопитающих. Инфекция ассоциируется с малигнизацией и другими болезнями (истощение, остеопороз). Выделено много онкогенсодержащих вирусов.
В настоящее время официально зарегистрировано 9 видов.
Род: Betaretrovirus.
Типовой вид: Mouse nammary tumor virus (MMTV) (вирус опухоли молочной железы мышей).
Характерные особенности: Вирионы MMTV имеют морфологию типа В (эксцентрично расположенное ядро, выступы на поверхности вириона). Другие члены рода имеют морфологию типа D (менее плотные поверхностные выступы и цилиндричный кор). Сборка капсида происходит в цитоплазме (образуя структуру, называемая частицами типа А), после чего они транспортируются и отпочковываются через цитоплазматическую мембрану. Молекулярная масса протеинов: MA  ; p 21
; p 21 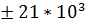 ; CA
; CA  ; NC
; NC  ; DU; PR
; DU; PR  ; RT; IN; SU
; RT; IN; SU  ; TM
; TM  . Размер генома от 8 kb до 10 kb (1 мономер). Организация для MMTV: gag-pro-pol-env-sag. У MMTV есть дополнительный ген sag, продуктом которого является супер антиген.
. Размер генома от 8 kb до 10 kb (1 мономер). Организация для MMTV: gag-pro-pol-env-sag. У MMTV есть дополнительный ген sag, продуктом которого является супер антиген.
В данный род входят экзогенные, передающиеся вертикально (с молоком) и эндогенные вирусы мышей, так же как и экзогенные, передающиеся горизонтально, и эндогенные вирусы приматов и овец. Вирусы мышей ассоциированы с карциномой молочной железы и Т -лимфомами, тогда как экзогенные вирусы приматов ассоциированы с иммунодефицитными болезнями; Jaagsiekte virus (JSRV) ассоциирован с раком легких у овец. Онкоген-содержащие вирусы не выявлены.
В настоящее врема официально зарегистрировано 5 видов.
Род: Gammaretrovirus.
Типовой вид: Murine leukemia virus (MLV) (вирус лейкемии мышей).
Характерные особенности: Вирион имеет морфологию типа С, со слабо различимыми поверхностными выступами. Плотный кор расположен в центре. Сборка капсида происходит на внутренней поверхности мембраны одновременно с почкованием. Молекулярная масса протеинов: MA  ; CA
; CA 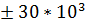 ; NC
; NC  ; PR
; PR  ; RT
; RT  ; IN
; IN 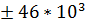 ; SU
; SU  ; TM
; TM  . Геном 8,3 kb; расположение генов: gag-pro-pol-env. Дополнительных генов нет. Размер LTR составляет 600 нуклеотидов, 500 нуклеотидов- регион U3, 60 нуклеотидов- R, 75 нуклеотидов- U5.
. Геном 8,3 kb; расположение генов: gag-pro-pol-env. Дополнительных генов нет. Размер LTR составляет 600 нуклеотидов, 500 нуклеотидов- регион U3, 60 нуклеотидов- R, 75 нуклеотидов- U5.
Вирус широко распространен, экзогенные (передаются горизонтально и вертикально) и эндогенные вирусы встречаются у многих млекопитающих. Вирус ретикулоэндотелиозов включают несколько видов, выделенных у птиц, не имеют сходных эндогенных последовательностей. Сходные эндогенные последовательности обнаруживаются у млекопитающих. Вирус ассоциируется с рядом таких болезней как малигнезация, иммуносупрессия, нейрологические нарушения и другие возможные болезни. Выделено много онкоген-содержащих вирусов млекопитающих и вирусов группы ретикулоэндетелиозов.
В настоящее время официально зарегистрировано 17 видов.
Род: Deltaretrovirus.
Типовой вид: Bovine leukemia virus (BLV) (вирус лейкемии (лекоза) КРС).
По морфологии и стратегии сборки вирион дельтаретровирусов сходен с таковым гаммаретровирусов: морфология типа С, со слабо различимыми поверхностными выступами, плотный кор расположен в центре; сборка капсида происходит на внутренней поверхности мембраны одновременно с почкованием. Молекулярная масса протеинов: MA  ; CA
; CA  ; NC
; NC 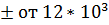 до 15*
до 15*  ; PR
; PR  ; RT; IN; SU
; RT; IN; SU 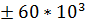 ; TM
; TM 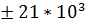 . Геном 8,3 kb; расположение генов: gag-pro-pol-env-tax-rex. Дополнительные гены: tax-rex, кодируют неструктурные протеины, участвующие в регуляции синтеза и процессинга вируса РНК. Размер LTR составляет от 550 до 750 нуклеотидов, от 200 до 300 нуклеотидов- регион U3, от 135 до 235 нуклеотидов- R, от 100 до 200 нуклеотидов- U5. Экзогенные вирусы (с горизонтальной передачей) данного рода обнаруживается только у небольшой группы млекопитающих. Родственных эндогенных вирусов не идентифицировано. Инфекции связаны с В- или Т - клеточными лейкемиями или лимфомами, так же как и с нейрологической болезнью (тропический спастический парапорез или HTLV- ассоциированная миопатия) с длительной патентным периодом с инцидентностью меньше 100%. Онкоген-содержащих вирусов не выявлено.
. Геном 8,3 kb; расположение генов: gag-pro-pol-env-tax-rex. Дополнительные гены: tax-rex, кодируют неструктурные протеины, участвующие в регуляции синтеза и процессинга вируса РНК. Размер LTR составляет от 550 до 750 нуклеотидов, от 200 до 300 нуклеотидов- регион U3, от 135 до 235 нуклеотидов- R, от 100 до 200 нуклеотидов- U5. Экзогенные вирусы (с горизонтальной передачей) данного рода обнаруживается только у небольшой группы млекопитающих. Родственных эндогенных вирусов не идентифицировано. Инфекции связаны с В- или Т - клеточными лейкемиями или лимфомами, так же как и с нейрологической болезнью (тропический спастический парапорез или HTLV- ассоциированная миопатия) с длительной патентным периодом с инцидентностью меньше 100%. Онкоген-содержащих вирусов не выявлено.
Род: Epsilonretrovirus.
Типовой вид: Walleye dermal sarcoma virus (WDSV) (вирус дермальной саркомы (глаукомы)).
Все представители рода являются экзогенными ретровирусами. Они имеют сложную структуру. Размер генома от 11,7 kb до12,8 kb, расположение генов: gag-prO’pol-env-orfA-orfB; 1-3 ORFs кодирующие преимущественно дополнительные протеины. ORFa (вирус гомологичен циклину D) присутствует у всех трех ретровирусов, вызывающих глаукому. Функции двух других ORFs у вирусов глаукомы или одной ORF у ретровируса змееголовка не определены. Размер LTR ретровирусов рыб варьирует от 500 до 650 нуклеотидов, 450 нуклеотидов- регион U3, 80 нуклеотидов- R, 75 нуклеотидов- U5.
Филогенетический анализ участка полимеразы показал, что ретровирусы глаукомы у окуней образуют группу вирусов, отличающихся от ретровируса змееголовка. Тем не менее, на данный момент, все ретровирусы рыб оказались в одной группе с ретровирусами типа С млекопитающих.
В настоящее время официально зарегистрировано 3 основных и 2 предполагаемых вида.
Род: Lentivirus.
Типовой вид: Human immunodeficiency virus 1 (HIV-1) вирус иммунодефицита человека 1 (ВИЧ-1).
Вирион имеет характерную морфологию, с прямоугольным или конусовидным кором (нуклеотидом). Сборка вириона происходит на клеточной мембране. Молекулярная масса протеинов: MA  ; CA
; CA  ; NC
; NC  ; PR
; PR  ; RT
; RT  ; DU ( у всех кроме лентивирусов приматов); IN
; DU ( у всех кроме лентивирусов приматов); IN  ; SU
; SU  ; TM
; TM  . Размер генома 9,3 kb; расположение генов: gag-pro-pol-vif-vpr-tat-rev-vpu-env-nef. Кроме основных генов gag-pro-pol-env присутствуют дополнительные гены (например, для HIV-1: vif, vpr, tat, rev, vpu и nej) продукты которых участвуют в регуляции и синтезе вирусной РНК и других репликативных процессах. У другого вируса могут быть дополнительные гены неструктурных белков (например, у HIV-2: vpx). Размер LTR 600 нуклеотидов, 450 нуклеотидов- регион U3, 100 нуклеотидов- R, 80 нуклеотидов- U5.
. Размер генома 9,3 kb; расположение генов: gag-pro-pol-vif-vpr-tat-rev-vpu-env-nef. Кроме основных генов gag-pro-pol-env присутствуют дополнительные гены (например, для HIV-1: vif, vpr, tat, rev, vpu и nej) продукты которых участвуют в регуляции и синтезе вирусной РНК и других репликативных процессах. У другого вируса могут быть дополнительные гены неструктурных белков (например, у HIV-2: vpx). Размер LTR 600 нуклеотидов, 450 нуклеотидов- регион U3, 100 нуклеотидов- R, 80 нуклеотидов- U5.
В состав рода входят экзогенные вирусы (с горизонтальной и вертикальной передачей) человека и многих других млекопитающих. О существовании родственных эндогенных вирусах сведений нет. Лентивирусы приматов отличаются по использованию хемокиннового рецептора, протеина CD4 и по отсутствию DU. Некоторые группы проявляют перекрестную активность по антигенам Gag (лентивирусы овец, коз и кошек). Bирусы, родсственные Feline immunodeficiency virus (FIV) были выделены от других крупных кошачьих (например, Puma lentivirus), а наличие антител к антигену Gag у львов и других крупных кошачьих свидетельствует о существовании других вирусов, близких FIV и лентивирусам овец и коз.
Вирус ассоциируется с различными болезнями, включая иммунодефициты, нейрологические нарушения, артриты и другие прочие болезни. Онкоген-содержащие вирусы не обнаружены.
В настоящее время официально зарегистрировано 10 видов.
Род: Spumavirus.
Типовой вид: Chimpanzee foamy virus (CFV) (пенящий вирус шимпанзе).
Характерные особенности: Вирион имеет характерную морфологическую, со слабозаметным поверхностными выступами и центральным неплотным ядром. Сборка капсида происходит в цитоплазме, после чего он отпочковывается в эндоплазматическую сеть или через плазматическую мембрану. Для почкования капсида необходим протеин env. Нет сведений о разрезании в инфекционном вирионе протеина-предшественника gag до субъединицы MA, CA, NC. Молекулярная масса протеинов: gag-предшественник  N-концевой продукт разрезания gag
N-концевой продукт разрезания gag  ; pol-предшественник
; pol-предшественник  ; RT
; RT  ; IN
; IN  ; env -предшественник
; env -предшественник  ; SU
; SU  ; TM
; TM  ; Itas / Bet
; Itas / Bet  ; Bet (Bel-1/ Bel - 2 fusionprotein),
; Bet (Bel-1/ Bel - 2 fusionprotein), 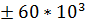 ; Env-Bet fusion protein;
; Env-Bet fusion protein;
 Размер генома от 11,6 kb; расположение генов: gag-pro-pol-env-tas-bet, Tas является ДНК-связывающим протеином с трансактиваторной функцией. Функции другого дополнительного протеина не известны. Размер LTR 1770 нуклеотидов, 1400 нуклеотидов-регион U3, 200 нуклеотидов - R, 150 нуклеотидов- U5. У вирусов КРС и кошек размер соответствует от 950 до 1000 нуклеотидов. Спумавирусы могут использовать два сайта начала транскрипции: R а LTR и внутренний промотор (IP), расположен выше дополнительных рамок считывания в гене env. Активность обоих промоторов зависит от tas. Другим важным критерием отличия спумавирусов от представителей других родов семейства Retroviridae - экспрессия протеина pol со сплайсированной субгеномной мРНК и присутствие в вирионе большого количества обратнотранскрибированной ДНК.
Размер генома от 11,6 kb; расположение генов: gag-pro-pol-env-tas-bet, Tas является ДНК-связывающим протеином с трансактиваторной функцией. Функции другого дополнительного протеина не известны. Размер LTR 1770 нуклеотидов, 1400 нуклеотидов-регион U3, 200 нуклеотидов - R, 150 нуклеотидов- U5. У вирусов КРС и кошек размер соответствует от 950 до 1000 нуклеотидов. Спумавирусы могут использовать два сайта начала транскрипции: R а LTR и внутренний промотор (IP), расположен выше дополнительных рамок считывания в гене env. Активность обоих промоторов зависит от tas. Другим важным критерием отличия спумавирусов от представителей других родов семейства Retroviridae - экспрессия протеина pol со сплайсированной субгеномной мРНК и присутствие в вирионе большого количества обратнотранскрибированной ДНК.
Вирусы распространены повсеместно, экзогенные вирусы найдены у многих млекопитающих. Естественного инфицирования людей от не человекообразных обезьян нет. Есть данные о существовании родственных (но не близких) эндогенных вирусов. Многие изоляты вызывают характерную «пенистую» цитопатологию в культуре клеток. Болезней, ассоциированных со спумавирусной инфекцией, не отмечается. Онкоген-содержащих вирусов не обнаружено.
Лейкоз (лейкемия, белокровие, рак крови) – злокачественное новооброзование, встречающееся у человека и животных.
Лекоз- системное заболевание крови, характеризующиеся: 1) прогрессивной клеточной гиперплазней в органах кроветворения, а также не редко и в периферической крови, с редким преобладанием пролифертивных процессов над процессами нормальных дифференцируемых клеток крови; 2) мегопластическим разрастанием патологических (анапластических, дедиференцированных) элементов, развивающихся из исходных клеток ретикулярной стромпы с их превращением в клетку, составляющей морфологическую сущность данного типа лейкоза.
В зависимости от клеточной морфологии гиперпластических и метопластических разрастании лейкозы человека подразделяются на: ретикулярную, гемоцитопластозную, миелолейкозы, лимфолейкозы, эритромиелозы, мегокариоцитарные (И. А. Кассирский, 1962).
В дальнейшем изложении патологических лейкозов животных ученные используют классификацию и номенклатуру лейкозов по И. А. Кассирскому (1962):
«I группа. Сюда входит комплекс так называемая миелопролиферативных процессов: хронический миелейкоз, хронический эритромиелоз (эритремия), хронический остео- и миелосклеротический лейкоз. Далее идет хронический лимфолейкоз и, наконец, хронический моноцитарный лейкоз (хронический ретикуло-гистеоцитоз).
II группа. Острый лейкоз: гемоцитобластоз, миелобластоз, эритромиелоз (болезнь Ди Гульельмо).
III группа. Острый и подострый ретикулозы. Лейкемический ретикулоз (гепато-спленомегалический, опухолевый лейкоритикулоз, сарколейкоз); лейкопенический и алейкемический лейкоз-ретикулоз (с ретикуло-синцитиальным субстратом патоморфологического процесса); остеомиелоретикулоз подострый (болезнь Рора); ретикуло-миеломатоз (миеломная болезнь, болезнь Раститского); нелейкимический ретикулоз (спленомегалический) с возможной - в терминальной фазе - сублейкемический или лейкемической инфильтрации костного мозга и трансформации болезней в лейкоз; ретикулосаркоматоз (лимфосаркоматоз, лимфогранулематоз)».
II.I Род: Deltaretrovirus. Вид: Bovine leukemia virus (BLV) (вирус лейкемии (лейкоза) КРС).
Этиология.
Возбудитель - вирус рода Lentivirus подсемейства Lentivirinae семейства Retroviridae. Геном свободной частицы ВИЧ образован двухнитевой РНК. В пораженных клетках ВИЧ формирует ДНК. Наличие обратной транскриптазы обеспечивает обратную направленность потока генетической информации (не от ДНК к РНК, а наоборот, от РНК к ДНК), что определило название семейства. В настоящее время выделяют вирусы двух типов - ВИЧ-1 и ВИЧ-2, различающиеся по своим структурным и антигенным характеристикам.
ВИЧ-1 - основной возбудитель пандемии ВИЧ-инфекции и СПИДа; его выделяют в Северной и Южной Америке, Европе и Азии.
ВИЧ-2 не так широко распространен. Впервые выделен из крови выходцев из Гвинеи-Бисау с подтверждённым диагнозом СПИД, не имеющих в крови ВИЧ-1. В эволюционном плане он родственен ВИЧ-1. Его выделяют преимущественно в Западной Африке.
По вариантам строения отдельного фрагмента гена env среди ВИЧ-1 в последнее время стали выделять субтипы, обозначаемые заглавными буквами латинского алфавита А-Н, О и т.д. Различные субтипы ВИЧ с разной частотой выделяют в разные периоды времени на различных территориях. Каких-либо данных, убедительно свидетельствующих о связи выраженности клинических проявлений с субтипом ВИЧ, пока не опубликовано, однако обнаружение такой зависимости не исключается. Определение субтипа пока имеет в основном эпидемиологическое значение. Вирус отличается высокой антигенной изменчивостью. Полный жизненный цикл вируса реализуется довольно быстро, всего за 1-2 суток; в день формируется до 1 млрд. вирионов.
ВИЧ чрезвычайно чувствителен к внешним воздействиям, гибнет под действием всех известных дезинфектантов. Нагревание до 56°С резко снижает инфекционность вируса, при нагревании до 70-80°С он инактивируется через 10 мин. Вирионы чувствительны к действию 70% этилового спирта (инактивируются через 1 мин), 0,5% раствора гипохлорида натрия, 1% раствора глутаральдегида. Устойчив при лиофильной сушке, воздействии ультрафиолетовых лучей и ионизирующей радиации. В крови, предназначенной для переливания, вирус сохраняется годами, хорошо переносит низкие температуры.
Патогенез
Основу составляет селективное поражение иммунокомпетентных клеток с развитием прогрессирующего иммунодефицита. ВИЧ способен проникать в любые клетки организма человека, несущие поверхностные CD4 рецепторы. Основной мишенью вируса становятся лимфоциты, макрофаги и клетки микроглии. При взаимодействии вируса с рецепторной системой макрофагов нарушается его «распознавание» как чужеродного антигена. Репродукция дочерней популяции ВИЧ вызывает гибель заражённой клетки. Вирусы выходят в кровь и внедряются в новые функционально активные лимфоциты. Непораженные вирусом лимфоциты «прилипают» к пораженным, образуя симпласты и синцитий, их функциональная активность снижается под воздействием токсичных веществ, образующихся при гибели клеток. Развитие иммунодефицита идет медленно и волнообразно, в течение месяцев и лет, поскольку уменьшение количества лимфоцитов сначала компенсируется продукцией новых иммунных клеток. По мере накопления вируса в организме, поражения им все более ранних популяций клеток вплоть до первичных стволовых и истощения лимфоидной ткани прогрессирует разрушение иммунной системы, нарастает иммунодефицит с поражением всех звеньев иммунитета.
Противовирусные антитела, синтезируемые неинфицированными лимфоцитами, проявляют сравнительно низкий аффинитет, что обусловлено свойствами антигенов вируса, а также появлением антигенов с изменёнными свойствами вследствие высокой частоты мутаций. Кроме того, антитела не способны связывать вирус внутри инфицированных клеток, что делает формирующиеся гуморальные иммунные реакции заведомо малоэффективными. Вместе с тем в крови определяют высокие уровни иммуноглобулинов всех классов (полииммуноглобулинопатия) и циркулирующих иммунных комплексов.
Вследствие развивающегося иммунодефицита иммунная система теряет способность противодействовать не только патогенным микроорганизмам, но и условно-патогенной и даже сапрофитной флоре, ранее латентно персистировавшей в различных органах и тканях. Активизация условно-патогенных микроорганизмов и сапрофитов обусловливает возникновение так называемых «оппортунистических» инфекций.
При ВИЧ-инфекции происходит активное размножение бластных клеток, развитие которых остановилось на первых этапах клеточной дифференцировки. Эти клетки, не достигая полного созревания и представляя собой чужеродные для организма антигены, разрушаются при нормальном функционировании иммунной системы и безудержно размножаются в условиях иммунодефицита. Указанное лежит в основе возникновения у больного ВИЧ-инфекцией быстро прогрессирующих болезней злокачественного роста (Т-лимфомы, саркомы Капоши и др.).
Паразитирование ВИЧ в нервной ткани сопровождается развитием аутоиммунных реакций, приводящих к гибели клеток. Этим обусловлено развитие неврологических нарушений, которые могут даже предшествовать иммунодефициту.
Клиническая картина
Многообразие проявлений заболевания на различных этапах его развития вызывает необходимость применения в практической работе клинических классификаций ВИЧ-инфекции.
Клиническая классификация ВИЧ-инфекции 2001 г.:
1. Стадия инкубации;
2. Стадия первичных проявлений
Варианты течения:
A. Бессимптомная.
Б. Острая ВИЧ-инфекция без вторичных заболеваний.
B. Острая инфекция с вторичными заболеваниями.
3. Латентная стадия;
4. Стадия вторичных заболеваний
4А. Потеря веса менее 10%; грибковые, вирусные, бактериальные поражения кожи и слизистых оболочек; опоясывающий лишай; повторные фарингиты, синуситы, повышенная утомляемость.
Фазы:
Прогрессирование (на фоне отсутствия противоретровирусной терапии, на фоне противоретровирусной терапии).
Ремиссия (спонтанная, после ранее проводимой противоретровирусной терапии, на фоне противоретровирусной терапии).
4Б. Потеря веса более 10%; необъяснимая диарея или лихорадка более одного месяца; волосистая лейкоплакия; туберкулез легких; повторные или стойкие вирусные, бактериальные, грибковые, протозойные поражения внутренних органов; повторный или диссеминированный опоясывающий лишай; локализованная саркома Капоши, прогрессирующая общая слабость.
Фазы:
Прогрессирование (на фоне отсутствия противоретровирусной терапии, на фоне противоретровирусной терапии).
Ремиссия (спонтанная, после ранее проводимой противоретровирусной терапии, на фоне противоретровирусной терапии).
4В. Кахексия; генерализованные бактериальные, вирусные, грибковые, протозойные и паразитарные заболевания; пневмоцистная пневмония; кандидоз пищевода, бронхов, легких; внелегочный туберкулез; атипичные микобактериозы; диссеминированная саркома Капоши; поражения центральной нервной системы различной этиологии.
Фазы:
Прогрессирование (на фоне отсутствия противоретровирусной терапии, на фоне противоретровирусной терапии).
Ремиссия (спонтанная, после ранее проводимой противоретровирусной терапии, на фоне противоретровирусной терапии).
5. Терминальная стадия.
Стадия 1. «Стадия инкубации» - период от момента заражения до появления реакции организма в виде клинических проявлений «острой инфекции» и/или выработки антител. Продолжительность ее обычно составляет от 3 нед до 3 мес, но в единичных случаях может затягиваться и до года. В этот период идет активное размножение ВИЧ, однако клинических проявлений заболевания нет и антитела к ВИЧ еще не выявляются. Диагноз ВИЧ-инфекции на данной стадии ставится на основании эпидемиологических данных и лабораторно должен подтверждаться обнаружением в сыворотке крови пациента вируса иммунодефицита человека, его антигенов, нуклеиновых кислот ВИЧ.
Стадия 2. «Стадия первичных проявлений». В этот период активная репликация ВИЧ в организме продолжается, однако проявляется уже первичный ответ организма на внедрение этого возбудителя в виде клинических проявлений и/или выработки антител. Стадия ранней ВИЧ-инфекции может протекать в нескольких формах.
2А. «Бессимптомная», когда какие-либо клинические проявления ВИЧ-инфекции или оппортунистических заболеваний, развивающихся на фоне иммунодефицита, отсутствуют. Ответ организма на внедрение ВИЧ проявляется при этом лишь выработкой антител.
2Б. «Острая ВИЧ-инфекция без вторичных заболеваний» может проявляться разнообразной клинической симптоматикой. Наиболее часто это - лихорадка, высыпания (уртикарные, папулезные, петехиальные) на коже и слизистых, увеличение лимфатических узлов, фарингит. Может отмечаться увеличение печени, селезенки, появление диареи. В крови больных с острой ВИЧ-инфекцией могут обнаруживаться широкоплазменные лимфоциты («мононуклеары»).
Острая клиническая инфекция отмечается у 50-90% инфицированных лиц в первые 3 мес после заражения. Начало периода острой инфекции, как правило, опережает сероконверсию, т.е. появление антител к ВИЧ. В стадии острой инфекции часто отмечается транзиторное снижение уровня СD4-лимфоцитов.
2В. «Острая ВИЧ-инфекция с вторичными заболеваниями». В 10-15% случаев у больных острой ВИЧ-инфекцией на фоне снижения уровня СD4-лимфоцитов и развившегося вследствие этого иммунодефицита появляются вторичные заболевания различной этиологии (ангина, бактериальная и пневмоцистная пневмония, кандидозы, герпетическия инфекция и др.).
Продолжительность клинических проявлений острой ВИЧ-инфекции варьирует от нескольких дней до нескольких месяцев, однако обычно она составляет 2-3 нед. У подавляющего большинства пациентов стадия начальной ВИЧ-инфекции переходит в латентную стадию.
Стадия 3. «Латентная». Характеризуется медленным прогрессированием иммунодефицита, компенсируемого за счет модификации иммунного ответа и избыточного воспроизводства СD4-клеток. В крови обнаруживаются антитела к ВИЧ. Единственным клиническим проявлением заболевания является увеличение двух и более лимфатических узлов не менее чем в двух не связанных между собой группах (не считая паховые).
Лимфатические узлы обычно эластичные, безболезненные, не спаяны с окружающей тканью, кожа над ними не изменена.
Длительность латентной стадии может варьироовать от 2-3 до 20 и более лет, в среднем - 6-7 лет. В этот период отмечается постепенное снижение уровня СD4-лимфоцитов, в среднем со скоростью 0,05-0,07x109/л в год.
Стадия 4. «Стадия вторичных заболеваний». Продолжающаяся репликация ВИЧ, приводящая к гибели С04-клеток и истощению их популяций, приводит к развитию на фоне иммунодефицита вторичных (оппортунистических) заболеваний, инфекционных и/или онкологических.
В зависимости от тяжести вторичных заболеваний выделяют стадии 4А, 4Б, 4В.
В стадии вторичных заболеваний выделяют фазы прогрессирования (на фоне отсутствия противоретровирусной терапии или на фоне противоретровирусной терапии) и ремиссии (спонтанной или на фоне противоретровирусной терапии).
Стадия 5. «Терминальная стадия». В этой стадии имеющиеся у больных вторичные заболевания приобретают необратимое течение. Даже адекватно проводимые противовирусная терапия и терапия вторичных заболеваний не эффективны, и больной погибает в течение нескольких месяцев. Для этой стадии типично снижение количества СD4-клеток ниже 0,05x109/л.
Следует отметить, что клиническое течение ВИЧ-инфекции отличается большим разнообразием. Последовательность прогрессирования ВИЧ-инфекции через прохождение всех стадий болезни не обязательна. Продолжительность течения ВИЧ-инфекции колеблется в широких пределах - от нескольких месяцев до 15-20 лет.
У потребителей психоактивных веществ течение заболевания имеет некоторые особенности. В частности, грибковые и бактериальные поражения кожи и слизистых, а также бактериальные абсцессы, флегмоны, пневмонии, сепсис, септический эндокардит могут развиваться у них на фоне нормального уровня CD4-лимфоцитов. Вместе с тем наличие этих поражений способствует более быстрому прогрессированию ВИЧ-инфекции.
Диагностика
Главным клиническим признаком ВИЧ-инфекции является увеличение лимфатических узлов нескольких групп, встречающееся у 60-80% зараженных во всех периодах болезни, в ранних стадиях как моносимптом. Поэтому дифференцировать ее приходится со всеми заболеваниями, протекающими с увеличением лимфоузлов.
Выделяют следующие клинические признаки-индикаторы, позволяющие заподозрить ВИЧ-инфекцию:
- похудание на 10% массы тела и более в течение нескольких месяцев без видимых причин;
- стойкая беспричинная лихорадка в течение 1 мес и более;
- беспричинная диарея в течение 1 мес и более;
- беспричинное увеличение более чем двух групп лимфатических узлов (исключая паховые) на протяжении более 2 мес;
- постоянное и необъяснимое ночное потоотделение;
- быстрая утомляемость, заставляющая все больше время проводить лежа.
Кроме того, следует подумать о ВИЧ-инфекции при выявлении пневмоцистной пневмонии, хронических интерстициальных пневмоний с лимфоидной инфильтрацией (у детей моложе 13 лет), гистологически подтверждённой саркомы Капоши у лиц моложе 60 лет, бронхиального или лёгочного кандидоза, криптоспоридиоза кишечника, диссеминированного гистоплазмоза, криптококкового менингоэнцефалита, токсоплазмоза мозга, цитомегаловирусного хориоретинита, злокачественных лимфом. Их проявления позволяют предполагать ВИЧ-инфекцию, но они могут развиваться и при других иммунодефицитных состояниях: после лучевой терапии, длительного применения глюкокортикостероидов. Список СПИД-индикаторных инфекций и опухолей постоянно расширяется
Лечение и профилактика
Систематический контроль за состоянием здоровья пациента, предупреждение и лечение оппортунистических инфекций, сопутствующих заболеваний, консультирование, психологическая и социальная помощь, организация доступа к программам уменьшения вреда, заместительной поддерживающей терапии, наркологической помощи, реабилитационных программ могут быть эффективной подготовкой к антиретровирусной терапии (АРТ) и основой высокого уровня приверженности во время проведения антиретровирусной терапии.
Исскуство назначения антиретровирусной терапи является специализированной дисциплиной, которая быстро развивается. Считается, что каждые два года происходит 100% обновление знаний. Назначение и проведение антиретровирусной терапии всегда требует индивидуального подхода.
Задача антиретровирусной терапии заключается в угнетении вирусной нагрузки до уровня, который не определяется исследованием на максимально длительное время (годы) и увеличение количества лимфоцитов CD4. В Украине рекомендовано назначать антиретровирусную терапию, исходя из клинических и иммунологических критериев, которые отвечают стандартам ВОЗ.
В мировой практике для подавления репродукции вируса применяют комбинации противовирусных препаратов следующих групп:
· нуклеозидные ингибиторы обратной транскриптазы ВИЧ (НИОТ):
· аналоги тимидина (ретровир, зерит);
· аналоги цитидина (хивид, эпивир);
· аналоги аденина (видекс);
· аналоги гуанина (зиаген)
· комбинации НИОТ: комбивир, тризивир
· нуклеотидные ингибиторы обратной транскриптазы ВИЧ (НтИОТ):
· виреад, трувада
· ненуклеозидные ингибиторы обратной транскриптазы ВИЧ (ННИОТ): вирамун, стокрин, интеленс (этраверин);
· ингибиторы протеазы (ИП): презиста (дарунавир), инвираза, норвир, вирасепт, ритонавир, индинавир, нельфинавир и др.
· ингибиторы слияния: фузеон
Согласно с совеременными рекомендациями, после начала лечения пациентам необходимо применять антиретровирусную терапию длительное время, практически на протяжении всей жизни. Достижение наилучших результатов лечения возможно только при условии высокого уровня приверженности к терапии.
Приверженность к терапии означает, что пациент:
· вовремя принимает лекарства;
· принимает их в необходимой, назначенной врачем дозе
· придерживается рекомендаций по диете
· придерживается назначенного режима лечения (непрерывность для АРТ, кратность приема и др.)
Кроме того, проводят интенсивное лечение имеющихся у больного оппортунистических инфекций, что требует применения разнообразных этиотропных средств: орунгала, дифлукана (диссеминированный кандидоз), бисептола (пневмоцистная пневмония), ацикловира, ганцикловира (герпетические инфекции) и т.д. Назначение цитостатиков при опухолях усугубляет иммунодефицит.
Иммуностимулирующая терапия не показана, так как способствует более быстрому прогрессированию заболевания.
Информация о заражении ВИЧ, необратимость и фатальный прогноз вызывает у инфицированного тяжелые эмоциональные реакции, вплоть до суицида. Поэтому создание охранительного режима является важнейшей терапевтической мерой. Консультирование и психологическая поддержка ВИЧ-инфицированных, так же как и назначение лекарственной терапии, осуществляется с их добровольного согласия. (В. И. Покровский, 2007).
III. Заключение
Ретровирусы (лат. Retroviridae, от лат. retro — обратный) — семейство РНК-содержащих вирусов, заражающих преимущественно позвоночных. Наиболее известный и активно изучаемый представитель — вирус иммунодефицита человека.
После инфицирования клетки ретровирусом в цитоплазме начинается синтез вирусного ДНК-генома с использованием вирионной РНК в качестве матрицы. Все ретровирусы используют для репликации своего генома механизм обратной транскрипции: вирусный фермент обратная транскриптаза (или ревертаза) синтезирует одну нить ДНК на матрице вирусной РНК, а затем уже на матрице синтезированной нити ДНК достраивает вторую, комплементарную ей нить. Образуется двунитевая молекула ДНК, которая интегрируется в хромосомную ДНК клетки во время клеточного деления, когда нет ядерной оболочки, (исключением является ВИЧ, ДНК которого активно проникает в ядро) и далее служит матрицей для синтеза молекул вирусных РНК. Эти РНК выходят из клеточного ядра и в цитоплазме клетки упаковываются в вирусные частицы, способные инфицировать новые клетки.
По одной из гипотез, ретровирусы могли произойти от ретротранспозонов — подвижных участков генома эукариот.






