Тема. «Контроль качества неорганических лекарственных средств элементов VI группы периодической системы
Д.И. Менделеева.
Контроль качества неорганических лекарственных средств элементов IV и III групп периодической системы
Д.И. Менделеева»
Контроль качества неорганических лекарственных средств элементов VI группы периодической системы
Aqua purificata. Вода очищенная. H2O
Вода очищенная получается методом дистилляции, обратным осмосом, ионным обменом и др. методами. Это наиболее часто используемый растворитель для лекарственных веществ. На воде очищенной готовят микстуры, жидкости для наружного применения. На воде для инъекций готовят инъекционные растворы, глазные капли.
Вода очищенная должна соответствовать определенным требованиям в отношении чистоты. Она должна быть бесцветной, прозрачной жидкостью без запаха и вкуса. Значение величины рН воды очищенной должно лежать в пределах 5 – 7. Определение, по требованиям ГФ, должно проводиться потенциометрическим методом.
В воде очищенной должны отсутствовать хлориды, сульфаты, ионы кальция и тяжелых металлов.
Хлорид-ионы открывают по реакции с раствором AgNO3 в присутствии HNO3. Не должно быть помутнения или опалесценции.
Сульфаты обнаруживаются по реакции с раствором BaCl2 в присутствии HCl. Не должно быть помутнения.
Ионы кальция обнаруживаются с раствором оксалата аммония в присутствии аммиачного буфера, создающего оптимальные условия для реакции, рН = 6,0 – 7,5. Не должно быть помутнения.
Ионы тяжелых металлов обнаруживаются по реакции с раствором натрия сульфида в среде кислоты уксусной. По данной реакции обнаруживают ионы тяжелых металлов, дающие с S2- ионами темные осадки. Так как концентрация ионов крайне мала, то наличие примесей ионов тяжелых металлов характеризуется появлением бурого окрашивания
В воде очищенной не должно быть восстанавливающих веществ (остатки микроорганизмов). Это определение проводят путем кипячения 100 мл воды, 1 мл 0,01 Н раствора KMnO4 и 2 мл разведенной H2SO4 в течение 10 минут. Розовая окраска раствора должна сохраниться.
Вода легко поглощает СО2. Этого примесного вещества в воде очищенной не должно быть. Обнаруживают его по помутнению с известковой водой (Са(ОН)2). Определение ведут в закрытом сосуде, заполненном доверху равными объёмами испытуемой воды и воды известковой в течение часа.
В воде очищенной должны отсутствовать нитраты и нитриты, которые определяют по посинению раствора дифениламина.
Примесный ион аммония в воде очищенной допускается в количестве не более 0,00002%. Для оценки регламентированного количества аммиака в воде необходимо использовать эталонный раствор, содержащий 0,00002% аммиака. В испытуемой воде и в эталонном растворе проводим реакцию с реактивом Несслера (раствор K2HgI4 в КОН). Окраска в испытуемой воде не должна превышать окраску в эталонном растворе.
Микробиологическая чистота должна соответствовать требованиям на питьевую воду (не более 100 микроорганизмов в 1 мл) при отсутствии бактерий сем. Enterobacteriaceae, Staphylococcus aureus, Pseudomonas aeruginosa. Испытания проводят в соответствии со статьей «Испытание на микробиологическую чистоту».
Хранится вода очищенная в закрытых емкостях, изготовленных из материалов, не изменяющих свойств воды и защищающих её от инородных частиц и микробиологических загрязнений.
Aqua pro injectionibus. Вода для инъекций.
Вода для инъекций должна отвечать требованиям, предъявляемым к воде очищенной. Кроме того, вода для инъекций должна быть апирогенной, не содержать антимикробных веществ и других добавок.
Для определения пирогенности инъекционных препаратов и, в том числе, воды для инъекций в настоящее время используют ЛАЛ-реактив, наряду с испытаниями на кроликах.
Используют воду для инъекций свежеприготовленной или хранят при температуре от 5°С до 10°С или от 80°С до 95°С в закрытых ёмкостях, изготовленных из материалов, не изменяющих свойств воды, защищающих воду от попадания механических включений и микробиологического загрязнения, но не более 24 ч.
Водорода пероксид (Н2О2)
Hydrogenii peroxydum – бесцветная жидкость с температурой кипения 152° С. Повышение температуры кипения (по сравнению с водой) связано с ассоциацией молекул за счет образования водородных связей, что приводит к повышению вязкости жидкости.
Водорода пероксид обладает свойствами, как окислителя, так и восстановителя и диспропорционирует с образованием воды и кислорода:
2H2O2 → 2H2O + O2↑ + 188,55 кДж
Процесс катализируют свет, марганца (IV) оксид, ионы тяжелых металлов, щелочи. Кислоты карбоновые и их амиды стабилизируют растворы водорода пероксида. В качестве стабилизатора раствора водорода пероксида концентрированного используют натрия бензоат.
Препаратами водорода пероксида являются:
− раствор водорода пероксида концентрированный, пергидроль (Solutio Hydrogenii peroxydi concentrata), содержание водорода пероксода 30%;
− раствор водорода пероксида (Solutio Hydrogenii peroxydi diluta), содержание водорода пероксида 3%;
Окислительно-восстановительные свойства водорода пероксида используют для идентификации и количественного определения его в препаратах. Так реакция окисления водорода пероксида стандартным раствором марганца перманганта лежит в основе его количественного перманганатометрического количественного определения:
2KMnO4 + 5H2O2 + 3H2SO4 ⇒ 2MnSO4 + K2SO4 + 8H2O + 5O2↑
При взаимодействии с выраженными восстановителями (например, с калия йодидом) водорода пероксид ведет себя как окислитель:
H2O2 + 2KI + H2SO4 ⇒ I2 + 2H2O + K2SO4
Данную реакцию можно использовать как для идентификации, так и для количественного определения водорода пероксида и его препаратов.
Специфичной реакцией на водорода пероксид является образование кислот надхромовых, образующихся при взаимодействии его с раствором калия дихромата. Состав кислот надхромовых зависит от условий проведения реакции (температуры, рН, концентрации водорода пероксида):
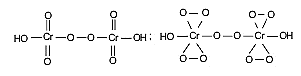
Данные вещества, содержащие пероксидную цепочку, крайне неустойчивы, особенно в таком полярном растворителе, как вода. Синий цвет, характерный для них быстро исчезает в воде и раствор приобретает зеленую окраску за счет образования солей трехвалентного хрома. Добавление неполярного растворителя − эфира диэтилового, в котором кислоты надхромовые устойчивы, сохраняет синий цвет продуктов реакции.
Натрия тиосульфат
Natrii thiosulfas
По агрегатному состоянию представляет собой бесцветные прозрачные кристаллы состава Na2S2O3 ⋅ 5H2O. Легко растворим в воде. В теплом сухом воздухе выветривается, во влажном воздухе слегка расплывается. При температуре около 50 оС плавится в кристаллизационной воде.
Натрия тиосульфат является солью средней по силе и крайне неустойчивой кислоты тиосерной. Обладает сильными восстановительными свойствами и способностью к комплексообразованию.
Подлинность.
1. В кислой среде разлагается с образованием свободной серы и оксида серы (IV):
Na2S2O3 + 2HCl ⇒ 2NaCl + SO2↑ + S↓ + H2O
2. Реакция «хамелеона»
При взаимодействии раствора натрия тиосульфата с водным раствором серебра нитрата сначала образуется белого цвета нерастворимая соль – серебра тиосульфат:
Na2S2O3 + 2AgNO3 ⇒ Ag2S2O3↓ + 2NaNO3
Затем серебра тиосульфат разлагается в результате внутримолекулярной окислительно-восстановительной реакции до серебра сульфида:
Ag2S2O3 + H2O ⇒ Ag2S + H2SO4
Цвет осадка при этом меняется последовательно от белого через желтый и бурый до черного.






