Якщо зв’язок утворено між атомами одного елементу, то спільні електронні хмари розподіляється у просторі симетрично відносно ядер обох атомів. Такий ковалентний зв’язок називається неполярним або гомеополярним, наприклад, Н – Н, Сl – Cl. Але у випадку утворення зв’язку між атомами різних елементів виникає асиметрія в розподілі електронної густини і, відповідно, заряду і утворюється гетерополярний зв’язок, наприклад, Н – Сl.
Полярністю зв’язку називається наявність електричних зарядів на атомах внаслідок асиметричного розподілу електронної густини між ними. Поляризацією називається зміщення електронної густини відносно ядер атомів в залежності від їх природи і під дією поля сусідніх атомів і молекул (цей фактор має велике значення у органічній хімії). Поляризація виникає також і під впливом зовнішного електромагнітного поля. Отже полярність виникає внаслідок поляризації.
Полярність зв’язку залежить від довжини його і різниці в електро-негативностях атомів, які утворюють зв’язок. Чим більша ця різниця, тим більше полярність. Найбільшу електронегативність мають галогени і Оксиген, тому вони легко перетягують до себе електронну густину зв’язку, утвореного з атомами інших елементів.
В результаті поляризації на атомах утворюється частковий позитивний або негативний заряд, який називається ефективним зарядом (d+, d–).
Наприклад: d+ d−
Н – СІ
Ефективні заряди змінюються в межах від 0 до 1. Якщо d= 0 молекула неполярна, якщо d®1 полярний ковалентний зв¢язок наближується до іонного.
Диполь – це система, яка складається з двох рівних за величиною зарядів протилежного знаку, розташованих на певній відстані один від одного. Сумарний заряд діполя дорівнює нулю. Диполями є полярні молекули або їх фрагменти. Полярність оцінюється за допомогою дипольного моменту (m) – добутку абсолютної величини заряду і відстані між центрами зарядів та вимірюється у дебаях (D); 1 D = 10-18 ел.ст.о. . см = 3,33 . 10–30 Кл . м. Для більшості ковалентних зв’язків величина ефективних зарядів не перевищує 0,3 заряда електрона, а дипольний момент зв’язку – 4 D.
В загальному випадку необхідно розрізняти поняття полярності молекули уцілому і полярності окремих зв’язків. Дипольний момент молекули є векторна величина, яка дорівнює векторній сумі всіх дипольних моментів окремих зв‘язків і неподілених електроних пар в молекулі. Для двохатомних сполук дипольні моменти зв¢язків і молекул збігаються. Наприклад, молекула НСІ і зв’язок Н – СІ полярні, mзв= mмол = 1,08 D (рис.5); у лінійній молекулі СО2 зв’язок полярний, mзв(С–О) = 2,7 D, але в цілому молекула неполярна, тому що векторна сума дипольних моментів зв’язків дорівнює 0, mмол= 0. Навпаки, у молекулі Н2О mзв (Н–О) = 1,5 D, полярні зв’язки розташовані під кутом 104,5°, тому їх моменти взаємно не компенсуються і молекула стає полярною (mмол=1,84 D).
d+ d– d– d+ d– d–
Н СІ О С О О
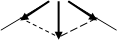

 ○ ○ ○ ○ ○ d+ ○ d+
○ ○ ○ ○ ○ d+ ○ d+
Н ○ ○ Н
mзв = mмол = 1,08 D mмол = Smзв = 0 mмол = Smзв = 1,84 D
Рис.4 Дипольні моменти окремих звязків і молекул






