Как было сказано, скорость гомогенной химической реакции зависит от температуры. Эту зависимость приближенно выражают эмпирическим правилом Вант-Гоффа: при увеличении температуры на 10 градусов скорость гомогенной химической реакции возрастает в 2 — 3 раза. Число γ, которое показывает, во сколько раз возрастает скорость реакции при увеличении температуры на 10 град, называют температурным коэффициентом скорости реакции. Нижний индекс при γ показывает температуру, которой соответствует константа. Вычисляют температурный коэффициент скорости реакции по уравнению:
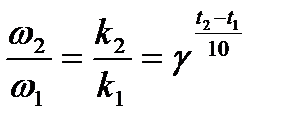 (13)
(13)
Самое простое объяснение факта возрастания скорости реакции с увеличением температуры, которое первым приходит в голову, связано с тепловым движением частиц (атомов, молекул). С увеличением температуры повышается скорость движения частиц, возрастает вероятность их столкновения, и, как следствие, увеличивается скорость реакции.
Но оказывается, что не любое столкновение частиц приводит к химическим превращениям. Столкновения будут эффективными при условии, что сталкивающиеся частицы обладают некоторым запасом энергии необходимым для разрыва старых связей и образования новых. Молекулы несущие эту избыточную энергию называются активными, а сам избыток энергии - энергией активации.
Зависимость скорости химической реакции от температуры более точно выражают уравнением Аррениуса:
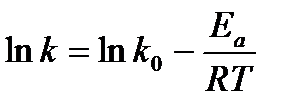 (14)
(14)
или после потенцирования получим:

где к — константа скорости реакции; R — газовая постоянная; Т — абсолютная температура; Еа — энергия активации; ко – предэкспоненциальный множитель.
Энергия активации — это минимальная энергия, которой должны обладать реагирующие молекулы, чтобы их столкновение приводило к химическому взаимодействию. Энергию активации выражают в джоулях на моль (Дж/моль). После преобразования уравнения Аррениуса, если известно значение константы скорости при температуре Т1 и Т2, получают довольно простое выражение
 (15)
(15)
где кt2 — константа скорости реакции при температуре Т2; kt1 − константа скорости реакции при температуре Т1; R — газовая постоянная. Следовательно, найдя из опытных данных константы скорости реакции при двух температурах, можно аналитически рассчитать энергию активации данной реакции.
Чаще всего прибегают к графическому способу определения энергии активации. Для чего выражение (14) представляют в координатах: lnk - 1/T. На графике получается прямая линия, тангенс угла наклона которой равен:

Тангенс угла наклона рассчитывают по отношению катетов треугольника.
Лабораторная работа.






