МИНИСТЕРСТВО ОБРАЗОВАНИЯ РЕСПУБЛИКИ БЕЛАРУСЬ
УЧРЕЖДЕНИЕ ОБРАЗОВАНИЯ
«МОГИЛЕВСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
им. А.А. КУЛЕШОВА»
А.В. Клебанов
М.А. Бандюк
РЕШЕБНИК ПО ФИЗИЧЕСКОЙ ХИМИИ.
ВТОРОЙ ЗАКОН ТЕРМОДИНАМИКИ
Методическая разработка
МОГИЛЕВ 2012
СОДЕРЖАНИЕ
1. ВТОРОЙ ЗАКОН ТЕРМОДИНАМИКИ..ИЗМЕНЕНИЕ ЭНТРОПИИ………………………………………………..3
2. ХАРАКТЕРИСТИЧЕСКИЕ ФУНКЦИИ……………………………………………….105
ТЕМА 1. ВТОРОЙ ЗАКОН ТЕРМОДИНАМИКИ.
ИЗМЕНЕНИЕ ЭНТРОПИИ
1. Энтальпия плавления льда при 00С равна 6012 Дж/моль. Чему равна энтропия плавления льда? Найти энтропию льда при 00С, если энтропия воды при этой температуре равна 63,34 Дж/моль∙К.
Решение.
ΔSпл.=  =22,01
=22,01
ΔSльда=ΔSводы-ΔSпл.=63,34-22,01=41,33 Дж/моль∙К
Ответ: 41,33 Дж/моль∙К
2. Энторопия жидкого ацетона при температуре кипения 56,20С равна 213,31 Дж/моль∙К. Энтальпия испарения ацетона 29090 Дж/моль. Найти энтропию парообразного ацетона при температуре 56,20С и давлении 1 атм.
Решение.
ΔSисп.= 
Ответ: 
3. Диоксид углерода CO2 сублимирует при температуре -78,50С и давлении 1 атм. Энтальпия сублимации 25230 Дж/моль. Чему равна энтропия сублимации?
Решение.
ΔSсубл.= 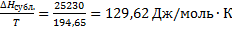
Ответ: 
4. Серое олово при температуре 130С обратимо превращается в белое олова. Энтальпия превращения 20,92 Дж/моль. Чему равна энтропия превращения?
Решение.
ΔSпревр.= 
Ответ: 
5. При температуре 95,50С и давлении 1 атм. Ромбическая сера обратимо превращается в моноклинную. Энтальпия превращения 450 Дж/моль. Чему равна энтропия моноклинной серы, если энтропия ромбической серы при этой температуре 36,73 Дж/моль∙К
Решение.
ΔSпревр.=  =1,22 Дж/моль∙К
=1,22 Дж/моль∙К
Ответ: 1,22 Дж/моль∙К
6. Молярная энтропия водорода при 250С и 1 атм. Равна 130,62 Дж/моль∙К. Чему равна энтропия водорода при 1000С и 1 атм., если теплоёмкость Ср(г)=28,85 Дж/моль∙К?
Решение.
ΔS=  = 6,47 Дж/моль∙К
= 6,47 Дж/моль∙К
ΔS1000C= ΔS250C+ ΔS=130,52+6,47=136,99 Дж/моль∙К
Ответ: 136,99 Дж/моль∙К
7. Энтропия CO при 25  и 1атм. равна 197,55 Дж/моль∙К. Чему равна энтропия CO при 200
и 1атм. равна 197,55 Дж/моль∙К. Чему равна энтропия CO при 200  и 50 атм., предполагая, что CO является идеальным газом?
и 50 атм., предполагая, что CO является идеальным газом?
Решение.
ΔS=Cvln 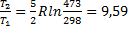 Дж/моль∙К
Дж/моль∙К
ΔS200= ΔS+ ΔS25=9,59+197,55=207,1 Дж/моль∙К
Ответ: 207,1 Дж/моль∙К
8. Один моля кислорода расширяется до десятикратного увеличения объёма и одновременно охлаждается от 127 до 27 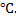 Чему равно изменение энтропии, если теплоёмкость Ср(г)=29,2 Дж/моль∙К
Чему равно изменение энтропии, если теплоёмкость Ср(г)=29,2 Дж/моль∙К
Решение:
ΔS=Cрln  =29,2ln
=29,2ln  =8,39 Дж/моль∙К
=8,39 Дж/моль∙К
Ответ: 8,39 Дж/моль∙К
9. Энтропия NH3 при 25  и 1 атм. равна 192,66 Дж/моль∙К. Зависимость теплоёмкости Ср от температуры выражается уравнением: Ср(г)= 29,80+25,48∙10-3T-1,67∙105T-2 Дж/моль∙К. Чему равна энтропия аммиака при 500
и 1 атм. равна 192,66 Дж/моль∙К. Зависимость теплоёмкости Ср от температуры выражается уравнением: Ср(г)= 29,80+25,48∙10-3T-1,67∙105T-2 Дж/моль∙К. Чему равна энтропия аммиака при 500  и 10 атм.?
и 10 атм.?
Решение.
ΔS=  =29,80∙ln
=29,80∙ln  +25,48∙
+25,48∙  (1,67
(1,67  )=39,699
)=39,699
ΔS=39,699-8,314∙ln 
ΔS500= ΔS+ ΔS25=20,55+192,66=213,21
Ответ: 213,21 Дж/моль∙К
10. Найти изменение энтропии при переходе двух молей кислорода от объёма 30 л под давлением 3 атм. к объёму 15 л под давлением2 атм. Считать кислород идеальным газом.
Решение.
ΔS=n (Cp ln  )=2(
)=2( )=-23,49
)=-23,49
Ответ: -23,49 Дж/моль∙К
11. Один моль идеального газа, занимающий объём 26 л, подвергается изотермическому расширению. Изменение энтропии 40 Дж/моль∙К. Каков конечный объём газа?
Решение:
ΔS=R ln 
40=8,314ln 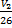
ln 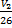 =4,81
=4,81
V2=3191 л
Ответ: 3191 л
12. 11,2 л азота нагревают от 0 до 100  и одновременно уменьшают давление от 1 до 0,01 атм. Найти изменение энтропии, считая азот идеальным газом.
и одновременно уменьшают давление от 1 до 0,01 атм. Найти изменение энтропии, считая азот идеальным газом.
Решение.
ΔS=n (Cp ln  )
)
n(N2)=  =0,5 моль
=0,5 моль
ΔS=0,5 
Ответ:  Дж/моль∙К
Дж/моль∙К
13. Один моль двухатомного идеального газа находится при 200  и 5 атм. В результате нагревания и сжатия газа температура стала 500
и 5 атм. В результате нагревания и сжатия газа температура стала 500  , давление равно 10 атм. Найти изменение энтропии газа.
, давление равно 10 атм. Найти изменение энтропии газа.
Решение.
ΔS=nCp ln 
ΔS=3,5∙8,314ln 
Ответ:  Дж/моль∙К
Дж/моль∙К
14. Вычислить изменение энтропии при нагревании одного моля CdS от -120до 0°С, если зависимость мольной теплоемкости от температуры выражается уравнением Ср=54,0+3,8  ,Дж/моль∙К
,Дж/моль∙К
Решение.
Изменение энтропии рассчитывается по формуле

Ответ: 
15. При охлаждении 12 л кислорода от 200 до -40 °С давление повышается от  до 6,0
до 6,0 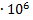 H/
H/  . Рассчитать изменение энтропии, если
. Рассчитать изменение энтропии, если  = 29,2 Дж/моль
= 29,2 Дж/моль  К (считать кислород идеальным газом).
К (считать кислород идеальным газом).
Решение.
Находим число молей кислорода из уравнения состояния идеального газа:
n=  =
= 
Поскольку в процессе меняется и давление и температура,

 Дж/моль∙К
Дж/моль∙К
Ответ:  Дж/моль∙К
Дж/моль∙К
16. Определить изменение энтропии припревращении 2 г воды в пар при изменении температуры от 0 до 150°С и давлении I ат, если скрытая удельная теплота парообразования воды 2,255 кДж/г, мольная теплоемкость пара при постоянном давлении
Ср=30,13+11,3  103Т, Дж/моль
103Т, Дж/моль  К.
К.  жидкой воды 75,30 Дж/моль
жидкой воды 75,30 Дж/моль  К
К
Решение. Общее изменение энтропии складывается из трех составляющих:
1) нагревание жидкой воды от 0 до 100°С;
2) переход жидкой воды в пар при 100°С;
3) нагревание водяного пара от 100 до 150°С.
Для первой стадии изменение энтропии рассчитывается по формуле

где n - количество молей воды. Учитывая, что Ср является постоянной

Изменение энтропии на второй стадии определяется но формуле

Изменение энтропии на третьей стадии рассчитывается по формуле 
Общее изменение энтропии равно:

Ответ: 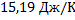
17. Найти изменение энтропии при нагревании 1 моля кадмия от 25 до 7270С, если температура плавления 3210С и энтальпия плавления 6109 Дж/моль. Теплоёмкость кристаллического и жидкого кадмия Ср(кр)=22,22+0,0123T Дж/моль∙К, Ср(ж)=29,83 Дж/моль∙К
Решение.
25  727
727 


 Cd(тв.) Cd(тв.)
Cd(тв.) Cd(тв.)
S1 S3
 Cd(ж.) Cd(ж.)
Cd(ж.) Cd(ж.)
321  S2 321
S2 321 
ΔS1=22,22 
ΔS2= 
ΔS3=29,83 
ΔS= ΔS1+ ΔS2+ ΔS3=18,96-10,28+15,53=44,78 Дж/моль∙К
Ответ: 44,78 Дж/моль∙К
18. Энтропия кристаллического хлорида натрия равна 72,13 Дж/моль∙К при Т=298,15 К и Р=1 атм. Найти энтропию расплавленной соли при температуре 850  , если температура плавления 800
, если температура плавления 800  а энтальпия плавления 31,0 Дж/моль∙К. Теплоёмкость NaCl в твёрдом и жидком состоянии равна:
а энтальпия плавления 31,0 Дж/моль∙К. Теплоёмкость NaCl в твёрдом и жидком состоянии равна:
Ср(кр)= 49,94+16,32∙10-3T Дж/моль∙К
Ср(ж)=66,53 Дж/моль∙К
Решение.
298,150K 8500С

 NaCl (кр) NaCl(расп.)
NaCl (кр) NaCl(расп.)
 NaCl(пл.) NaCl(пл.)
NaCl(пл.) NaCl(пл.)
8000С 8000С
ΔS1=49,94 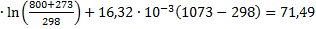 Дж/моль ∙К
Дж/моль ∙К
ΔS2= 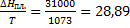 Дж/моль ∙К
Дж/моль ∙К
ΔS3=66,53  Дж/моль∙К
Дж/моль∙К
ΔS850=ΔSNaCl+ ΔS1+ ΔS2+ ΔS3=72,13+71,49+28,89+3,03=175,53 Дж/моль∙К
Ответ: 175,53 Дж/моль∙К
19. Вычислите изменение энтропии при нагревании 1 моля твёрдого брома от температуры плавления -7,32 до 100  , если энтальпия плавления 10544 Дж/моль, энтальпия испарения 30710 Дж/моль, температура кипения 59
, если энтальпия плавления 10544 Дж/моль, энтальпия испарения 30710 Дж/моль, температура кипения 59  . Теплоёмкость брома в жидком и парообразном состоянии равна:
. Теплоёмкость брома в жидком и парообразном состоянии равна:
Ср(ж)= 75,71 Дж/моль∙К
Ср(г)= 37,20+0,71∙10-3T-1,19∙105T-2Дж/моль∙К
Решение.
265,60K 2730K

 Br(ж.) Br(тв.)
Br(ж.) Br(тв.)
 Br(ж.) Br(тв.)
Br(ж.) Br(тв.)
3320K 3320K
ΔSпл.=  Дж/моль∙К
Дж/моль∙К
ΔS1=75,71 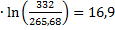
ΔS2=  Дж/моль∙К
Дж/моль∙К
ΔS3=37,20 
ΔS=16,91+92,46+4,135=113,51 Дж/моль∙К
Ответ: 113,51 Дж/моль∙К
20. Энтропия жидкого бензола при 25  и 1 атм. равна 173,26 Дж/моль∙К. Найти энтропию газообразного бензола при 500
и 1 атм. равна 173,26 Дж/моль∙К. Найти энтропию газообразного бензола при 500  и 1 атм., если энтальпия испарения бензола при температуре кипения 80,1
и 1 атм., если энтальпия испарения бензола при температуре кипения 80,1  равна 30752 Дж/моль. Теплоёмкость жидкого и газообразного бензола выражается уравнениями:
равна 30752 Дж/моль. Теплоёмкость жидкого и газообразного бензола выражается уравнениями:
Ср(ж)= 59,50+255,0 ∙10-3T Дж/моль∙К
Ср(г)= -21,09+400,1∙10-3T-169,9∙10-6T-2 Дж/моль∙К
Решение.
ΔSисп.(500)= 
ΔS(ж)=59,50∙ ln 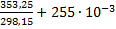 ∙(353,25-298,15)=24,16
∙(353,25-298,15)=24,16
ΔS(г)= -21б09∙ ln 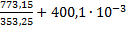 ∙(773,15-353,25)-
∙(773,15-353,25)-  =111,282
=111,282
ΔS=173,26+87,05+24,16+111,282=395,752 Дж/моль∙ К
Ответ: 395,752 Дж/моль∙ К
21. Вычислить изменение энтропии системы и окружающей среды при изотермическом затвердевании 1 моля меди, переохлаждённой ниже температуры плавления на 180 градусов. Температура плавления меди 1356 К, энтальпия плавления Δпл.H1356 K=12970 Дж/моль. Теплоёмкость твердой и жидкой меди: Ср=22.64+6,28∙  , Дж/моль∙ К
, Дж/моль∙ К
Ср= 31,38 Дж/моль∙ К
Решение.


 1176 K Cu(ж) Cu(кр)
1176 K Cu(ж) Cu(кр)
 1356Cu(ж) Cu(кр)
1356Cu(ж) Cu(кр)
T=1082,85-180=902,85  =1176 K
=1176 K
ΔS1=31,38 ln  Дж/моль∙ К
Дж/моль∙ К
ΔS2=-  Дж/моль∙ К
Дж/моль∙ К
ΔS3=22,64 ln  Дж/моль∙ К
Дж/моль∙ К
ΔSобщ= ΔS1+ ΔS2+ ΔS3=4,469+(-9,565)+(-4,355)=-9,45 Дж/моль∙ К
ΔSсреда= 
Q=-12970+((22,64∙(-180)+3,14∙ 
ΔSсреда= 
ΔSобщ=10,91-9,45=1,46 Дж/моль∙ К
Ответ: 1,46 Дж/моль∙ К
22. Рассчитать разность между мольными энтропиями твёрдой и жидкой ртути при температуре -50  . Температура плавления ртути -39
. Температура плавления ртути -39  , энтальпия плавления при этой температуре 2340 Дж/моль. Теплоёмкость жидкой и твёрдой ртути равна: Ср(кр)=29,71+6,69∙
, энтальпия плавления при этой температуре 2340 Дж/моль. Теплоёмкость жидкой и твёрдой ртути равна: Ср(кр)=29,71+6,69∙  , Дж/моль∙ К
, Дж/моль∙ К
Ср(ж)= 26,9 Дж/моль∙ К
Решение.
ΔS1=26,9 ln  Дж/моль∙ К
Дж/моль∙ К
ΔS2=-  Дж/моль∙ К
Дж/моль∙ К
ΔS3=29,71 ln  Дж/моль∙ К
Дж/моль∙ К
ΔS=-1,5-9,99+1,29=-10,20 Дж/моль∙ К
Ответ: -10,20 Дж/моль∙ К
23. Два сосуда объёмом 1 л каждый соединены трубкой с краном. В одном находится водород при 1 атм. и 20  , в другом – гелий при 3 атм. и 100
, в другом – гелий при 3 атм. и 100  . Найти изменение энтропии системы после открытия крана и достижения равновесной температуры, если стенки сосудов и трубки теплоизолированные от окружающей среды, Газы считать идеальными.
. Найти изменение энтропии системы после открытия крана и достижения равновесной температуры, если стенки сосудов и трубки теплоизолированные от окружающей среды, Газы считать идеальными.
Решение.


ΔS=nRln 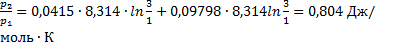
Ответ: 
24. Вычислите изменение энтропии при плавлении 5 молейбензола, если температура плавления бензола равна 278.68 К, а теплота плавления 2,351 ккал/моль.
Решение.
Плавление бензола - фазовый переход, протекающий при постоянной температуре. Изменение энтропии при переходе 5 молей вещества из твердого в жидкое состояние определим, используя формулу 

Ответ: 
25. Определите изменение энтропии при превращении 2 гводы в пар при изменении температуры от 0 до 100  и давлении 1 атм., если скрытая удельная теплота парообразования воды равна 2,255 кДж/г.Мольная изобарическая теплоемкость жидкой воды в рассматриваемом температурном интервале постоянна и равна 75,30Дж/(моль К).
и давлении 1 атм., если скрытая удельная теплота парообразования воды равна 2,255 кДж/г.Мольная изобарическая теплоемкость жидкой воды в рассматриваемом температурном интервале постоянна и равна 75,30Дж/(моль К).
Решение.
Изменение энтропии системы в рассматриваемом температурном интервале происходит в результате течения следующих процессов: а) нагревания воды от 0  до 100
до 100  в изобарических условиях; б) испарения воды при температуре кипения в изотермических условиях. Следовательно, суммарное изменение энтропии AS равно сумме изменений энтропии в процессах а) и б):
в изобарических условиях; б) испарения воды при температуре кипения в изотермических условиях. Следовательно, суммарное изменение энтропии AS равно сумме изменений энтропии в процессах а) и б):
А) 

Б)  или
или 
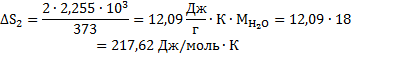

Ответ: 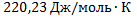
26. Определите изменение энтропии при нагреве I моля Аl от 25 до 600  , если для него в этом интервале теплоёмкость зависит от температуры следующим образом: Ср = 20,945 + 0,010728 Т. (Дж/(моль К)).
, если для него в этом интервале теплоёмкость зависит от температуры следующим образом: Ср = 20,945 + 0,010728 Т. (Дж/(моль К)).
Решение.
Для нагревания вещества при постоянном давлении:


Ответ: 
27. Определите изменение энтропии при плавлении меди массой 63,5 г, если теплота плавления меди равна 12980 Дж/моль. а температура плавления меди 1083 °С.
Решение.
n(Сu)= 
ΔS=n 
Ответ: 9,57 Дж
28. Вычислите изменение энтропии при плавлении свинца массой 100 г, если температура плавления свинца 327,4 °С, а теплота плавления 5485 Дж/моль.
Решение.
m(Pb)=100 г
Tпл=327,4 
Qпл=5485 Дж/моль
n(Pb)= 

Ответ: 
29. В двух сосудах одинаковой вместимости находится: в первом - азот массой 2,8 г, во втором аргон массой 4 г. Определите изменение энтропии при диффузии, возникающей в результате соединения сосудов с газами. Температура и давление постоянны.
Решение.
n(Ar)= 
n(
ΔS=  =0,1
=0,1 
Ответ: 
30. Найдите изменение энтропии в процессе обратимого изотермического сжатия 1 моля кислорода от 1,013  105до 10,13
105до 10,13  105Па.
105Па.
Решение.
ΔS=nRln 
Ответ: 
31. Вода массой 100 г при 25 °С превращена в пар с температурой 150 °С и давлением 1,013  105 Па. Вычислите изменение энтропии этого перехода, если удельная теплота испарения воды при 100
105 Па. Вычислите изменение энтропии этого перехода, если удельная теплота испарения воды при 100  равна 2257 Дж/ г, удельная теплоемкость воды - 4,187 Дж/(г
равна 2257 Дж/ г, удельная теплоемкость воды - 4,187 Дж/(г  К), а удельная теплоемкость водяного пара при давлении 1,013
К), а удельная теплоемкость водяного пара при давлении 1,013  105 Па равна 1,968 Дж/(г
105 Па равна 1,968 Дж/(г  К).
К).
Решение.
Δ 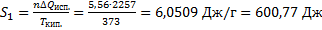



Ответ: 
32. Найдите изменение энтропии при переходе 3 молей кислорода от объема 0,0336 м3 под давлением 2,026  105 Па к объему 0,0672 м3 под давлением 1,013
105 Па к объему 0,0672 м3 под давлением 1,013  105 Па. Молярная теплоемкость кислорода Ср равна 29,37 Дж/(моль
105 Па. Молярная теплоемкость кислорода Ср равна 29,37 Дж/(моль  К), температура постоянна.
К), температура постоянна.
Решение.
 =20,785
=20,785
ΔS=n 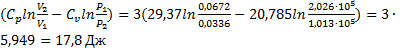
Ответ: 
33. Определите разность энтропии 1г воды при 0 и 100  (давление нормальное), считая теплоемкость воды постоянной и равной 4,19 Дж/(г
(давление нормальное), считая теплоемкость воды постоянной и равной 4,19 Дж/(г  К).
К).
Решение.

Ответ: 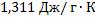
34. Определите изменение энтропии при охлаждении 5 молей алюминия от 0 до -100 °С. Средняя массовая
теплоемкость алюминия в указанном интервале температур 0,8129 Дж/(г  К).
К).
Решение.

Ответ: 
35. Чему равно изменение энтропии 1 моля нафталина при нагревании от 0 до 80,4 °С (температура плавления), если теплота плавления 149,6 Дж/г, а средняя массовая теплоемкость кристаллического нафталина 1,315 Дж/(г  К).
К).
Решение.


ΔS= 
Ответ: 
36. Рассчитайте суммарное изменение энтропии при нагревании 1 моля бензола от температуры плавления (5,49 °С) до полного испарения при температуре кипения (80,2 °С). Теплота плавления бензола 126,54 Дж/г, теплота парообразования 396 Дж/г, массовая теплоемкость бензола 1,94 Дж/(г  К).
К).
Решение.
ΔS= 



ΔS=  =159,2Дж/(моль
=159,2Дж/(моль  К)\
К)\
Ответ: 159,2Дж/(моль  К)
К)
37. В 0,30 кг жидкого ацетона поместили серебряную ложку массой 53 г. Определите энтропию системы при 25  .
.
Решение.
Находим значения стандартных энтропий: для жидкого ацетона
 Дж/моль ∙К и для серебра
Дж/моль ∙К и для серебра  Дж/моль ∙К. Молярные массы равны: ацетона-0,058 и серебра-0,108 кг/моль.
Дж/моль ∙К. Молярные массы равны: ацетона-0,058 и серебра-0,108 кг/моль.
По полученным данным:
Энтропия 0,30 кг ацетона-
 Дж/К
Дж/К
Энтропия серебряной ложки-
 Дж/К
Дж/К
Отсюда энтропия всей системы:
 Дж/К
Дж/К
Ответ:  Дж/К
Дж/К
38. Вычислите изменение энтропии в процессе затвердения 1 моль переохлажденного бензола при 268 К, если при 278 К  ,
,  ,,
,,  , P=const=1,01∙
, P=const=1,01∙  Па
Па
Решение.
Этот процесс необратим, поэтому мысленно проводим его обратимо в три стадии

Тогда 
Вычисляем  и
и 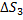 по уравнению (VII,5), а
по уравнению (VII,5), а  -по уравнению (VII.14). Тогда
-по уравнению (VII.14). Тогда


Ответ: 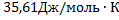
39. Вычислить энтропию хлорид серебра при 870 К.
Решение.
Согласно уравнению (VII. 15)

Выписываем из справочника необходимые данные  ,
,  ,
, 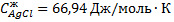 ,
,  ,
,  .
.
Подставляем числа в уравнение

После интегрирования получаем

Приращение энтропии AgCl за счёт нагревания составит
( и
и 
Ответ: 
40. В одном из сосудов одинаковой вместимости 3 м3 находится 28 кг азота, а в другом 32 кг кислорода при одной и той же температуре. Вычислите изменение энтропии при диффузии в результате соприкосновения содержимого этих сосудов. Принять кислород и азот идеальными газами.
Решение.
 моль
моль
 моль
моль
 Дж/моль
Дж/моль
Ответ:  Дж/моль
Дж/моль
41. Определите ΔS для изобарического нагревания 1 моля азота от 300 до 10000 К. Ср = 6,4492 + 1,4125 · 10-3 Т – 0,807 · 10-7 Т2.
Решение.
ΔS= 

 кал·0К-1·моль-1.
кал·0К-1·моль-1.
Ответ:  кал·0К-1·моль-1.
кал·0К-1·моль-1.
42. Нормальная температура кипения бензола равно  . Оцените мольную теплоту испарения бензола при этой температуре.
. Оцените мольную теплоту испарения бензола при этой температуре.
Решение.
Используя правило Трутона ΔН пар /Ткип≈21  , получим ΔНпар≈Ткип·21=353·21=7400
, получим ΔНпар≈Ткип·21=353·21=7400 
Экспериментально значение равно 7220 кал. 
Ответ: 7400 
43. Найти изменение энтропии при превращении двух молей льда, взятых при О°С р = 1 атм, в пар при 200 °С и 3 атм. Теплота плавления льда равна 332,2 Дж∙г-1, теплота парообразования при 100 °С равна 2259 Дж∙г-1. Удельная теплоемкость пара равна 1,87 Дж∙г-1 ∙К-1, воды - 4,184 Дж∙г-1 ∙К-1.
Решение.
 Дж∙К-1
Дж∙К-1
 Дж∙К-1
Дж∙К-1
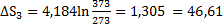 Дж∙К-1
Дж∙К-1
 Дж∙К-1
Дж∙К-1
 Дж∙К-1
Дж∙К-1
Ответ:  S= 306,32 Дж∙К-1.
S= 306,32 Дж∙К-1.
44. В одном из сосудов емкостью 0,1м3 находится кислород, в другом емкостью 0.4 м3.В обоих сосудах температура 17е С и давление 1,013∙105 н/м2.Найти изменение энтропии при взаимной диффузии газов из одного сосуда в другой при Р и Т=const. Считать оба газа идеальными.
Решение.
Изменение энтропии определяем по формуле. Число молей каждого газа находим из уравнения Менделеева — Клапейрона


ΔS=2,3∙8,314 
Ответ: 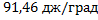
45. Вычислить изменение энтропии в процессе изотермного расширения 2 моль метана от  =101,3∙
=101,3∙ 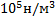 до
до  =1,013∙
=1,013∙ 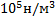 Газ считать идеальным.
Газ считать идеальным.
Решение.
По формуле (111,6) при Т=const находим
ΔS=-2∙8,314∙2,3lg 
Ответ: 
46. Рассчитать мольную энтропию окиси углерода при 200° С и 50,67∙105 н/м2, если энтропия при 25° С и1,013∙105 н/м2равна 197,9 дж/град∙моль, а зависимость мольной теплоемкости от температуры выражается уравнением
СР = 28,41+4,10∙10-3T — 0,46∙105T2 дж/моль∙ град.
Решение.


 Дж/моль∙К
Дж/моль∙К
Ответ:  Дж/моль∙К
Дж/моль∙К
47. Найти изменение энтропии при нагревании I г∙атомкадмия от 25 до 727°С, если температура плавления 321°С и теплота плавления равна 6109 дж/г∙атом
 = 22,22+ 12,30∙
= 22,22+ 12,30∙  T дж/моль∙град;
T дж/моль∙град;
 = = 29,83 дж/моль∙град.
= = 29,83 дж/моль∙град.
Решение.
ΔS1=22,22 
ΔS2= 
ΔS3=29,83 
ΔS= ΔS1+ ΔS2+ ΔS3=18,96-10,28+15,53= 44,78 Дж/моль∙К
Ответ: 44,78 Дж/моль∙К
48. Какому конечному объему отвечает изменение энтропии, равное 38,28 дж/моль∙град, если 1 мольидеального газа, занимающий в данных условиях 0,02 м3,изотермически расширяется.
Решение.
ΔS=nRln 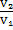
38,28=1∙8,314ln 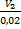
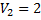 л
л
Ответ: 2 м3
49. Насколько изменится энтропия в процессе изотермического расширения
10 гкриптона от объема 0,05 м3 и давления 1,013∙105 н/м2 до объема 0,2 м3 и давления 0,2133∙105 н/м2 ?.
Решение.

n(Kr)=0,1193 моль

Ответ: 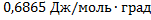
50. Найти изменение энтропии при изотермическом сжатии 1 моль паров бензола при 80°С от 0,4053∙105 до 1,013∙105 н/м2с последующей конденсацией в охлаждением жидкого бензола до 60°С. Нормальная температура кипения бензола 80°С; мольная теплота испарения бензола 30,88 кдж/моль;удельная теплоемкость жидкого бензола 1,799 дж/г∙град.
Решение.
 Дж/моль∙град
Дж/моль∙град
 Дж/моль∙град
Дж/моль∙град
 Дж/моль∙град
Дж/моль∙град
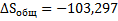 Дж/моль∙град
Дж/моль∙град
Ответ:  Дж/моль∙град
Дж/моль∙град
51. Определить изменение энтропии в процессе сжижения 1 мольметана, если начальная температура равна 25°С, а конечная 111,8° К. Мольная теплота испарения метана при 111,8° К равна 8234,0 дж/мольи мольная теплоемкость 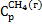 =35,79 дж/моль∙град.Вычислить работу сжижения метана, приняв к. п. д. равным 10%.
=35,79 дж/моль∙град.Вычислить работу сжижения метана, приняв к. п. д. равным 10%.
Решение.
 дж/моль∙град
дж/моль∙град
 дж/моль∙град
дж/моль∙град
 дж/моль∙град
дж/моль∙град
A=-143,11
Ответ: -108,75; -143,11
52. Рассчитать-изменение энтропии 1 мольбензола при переходе из жидкого состояния при 25°С в пар при 100°С, если теплота испарения бензола 393,3 дж/г и температура кипения бензола 80,2°С, мольная теплоемкость жидкого бензола равна Ср (ж) = 136,1 дж/моль∙град,а мольная теплоемкость паров бензола Ср(г) = - 33,90 + 471,87∙  -298,34∙
-298,34∙  + 70,84∙
+ 70,84∙  дж/моль∙град.
дж/моль∙град.
Решение.
Δ 
Δ 

ΔS= Δ 
Ответ: 107 
53. Вычислить возрастание энтропии 1 мольброма Вr2. взятого при температуре плавления —7,32°С, и переходе его из твердого состояния в пар при температуре кипения 61,55°С; мольная теплоемкость жидкого брома
Ср(ж) = 0,4477 дж/г∙град; теплота плавления 67,72 дж/г;теплота испарения 182,8 дж/г.
Решение.
Δ 
Δ 
Δ 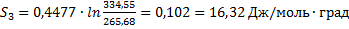
ΔS= Δ 
Ответ: 
54. Определить увеличение энтропии 1 моля кристаллического магния при нагревании от 300 до 800 К при постоянном давлении, если теплоёмкость магния равна Ср(кр)= 22,3+10,64∙10-3T-0,42∙105T-2, Дж/моль∙К
Решение.
ΔS=  (
( -
-  Дж/моль∙К
Дж/моль∙К
Ответ:  Дж/моль∙К
Дж/моль∙К
55. Определить увеличение энтропии 1 моля азота при нагревании от 25 до 10000С: а) при постоянном давлении; б) при постоянном объёме. Зависимость теплоёмкости от температуры выражается уравнением Ср=27,88+4,27∙10-3T Дж/моль∙К
Решение.
А)ΔS=  )=40,47+4,16325=44,64 Дж/моль∙К
)=40,47+4,16325=44,64 Дж/моль∙К
Б) Cp-Cv=R
Cv= Cp-R=27,88+4,27∙10-3T-8,314=19,566+4,27∙10-3T
ΔS=  )=28,4+4,16325=32,56 Дж/моль∙К
)=28,4+4,16325=32,56 Дж/моль∙К
Ответ: 44,64 Дж/моль∙К; 32,56 Дж/моль∙К
56. Как изменится энтропия 1 моля гелия при нагревании его от 20 до 70 °С, если объем газа при этом изменится от 24 до 28,1 л?
Решение.

ΔS=n 
Ответ: 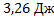
57. Средняя массовая теплоемкость железа в пределах температур 0 - 200 °С равна 0.486 Дж/(г  К). Определите изменение энтропии при нагревании 1 кг железа oт 100 до 150 °С.
К). Определите изменение энтропии при нагревании 1 кг железа oт 100 до 150 °С.
Решение.

Ответ: 
58. Вычислите изменение энтропии при нагревании 1 кг свинца от температуры его плавления (327,4 °С) до 800  . Теплота плавления свинца 24,8 кДж/кг, а теплоемкость жидкого свинца в интервале температур 327 - 1000 °С равна 0,1415 кДж/(кг
. Теплота плавления свинца 24,8 кДж/кг, а теплоемкость жидкого свинца в интервале температур 327 - 1000 °С равна 0,1415 кДж/(кг  К).
К).
Решение.

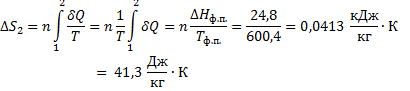
ΔS= 
Ответ: 
59. Вычислите изменение энтропии при нагревании 16кг О2 от 273 до 373К:
1) при постоянном объёме;
2) при постоянном давлении.
Считать кислород идеальным газом
Решение.
1) при постоянном объёме
n(О2)=16000/32=500 (моль)
ΔS=(5/2)∙n∙R∙ ln(T2/T1);
ΔS=5/2∙500∙8,314∙ ln(373/273)=3243,6 Дж/К.
2) при постоянном давлении
ΔS=(5/2)∙n∙R∙ ln(T2/T1)+R;
ΔS=(5/2)∙500∙8,314∙ln(373/273)+8,314=4539,4 Дж/К.
Ответ: 3243,6; 4539,4 Дж/К.
60. Рассчитайте изменение энтропии при нагревании 58,82 кг В2О3 от 298 до 700К, теплоемкость В2О3 Ср0=36,5525+106,345*10-3Т Дж/(моль*К).
Решение.
n(В2О3)=58820/70=840,3 (моль)
ST=∫T1T2(Ср(T)/T)dT=∫700298=(36,5525+106,345∙103/T/T)dT=840,3∙(36,5525ln(700/298)+106,345∙10-3∙840,3(700-298))=26230,2622+35923,40481=62153,7 Дж/К.
Ответ: 62153,7 Дж/К.
61. Бромбензол кипит при 429,8К, его теплота парообразования при этой температуре 241,9∙103 Дж/кг. Рассчитайте изменение энтропии при испарении 10 кг бромбензола.
Решение.
n(C6H5Br)=10/157=0,0637 моль,
S=0,0637∙241,9∙103∙ln(429,8/273)=6993,4 (Дж/К)
Ответ: 6993,4 (Дж/К)
62. Вычислите изменение энтропии при охлаждении 12∙10-3 кг (12 г) кислорода от 290 до 233К и одновременном повышении давления от 1,01∙105 до 60,6∙105 Па, если Ср=32,9 Дж/(моль∙К).
Решение.
n(О2)=12/32=0,375 моль;
S1=0,375∙32,9∙ln(233/290)=-2,7 Дж/(моль∙К)
S2=0,375∙32,9∙ln(60,6∙105 /1,01 ∙105)=50,51 Дж/(моль∙К)
S=50,51- 2,7=47,81 Дж/(моль∙К)
Ответ: 47,81 Дж/(моль∙К).
63. Рассчитать изменение энтропии в процессе нагревания 1 моля ртути от -77°С до 25 °С. Теплота плавления ртути при t = -38,9 °С равна 11,58 Дж  г-1; удельная теплоемкость твердой ртути Ст = 0,138 Дж
г-1; удельная теплоемкость твердой ртути Ст = 0,138 Дж  г-1
г-1  К-1, жидкой ртути
К-1, жидкой ртути
Сж = 0,140 - 2,86  10 -6Т Дж
10 -6Т Дж  г-1
г-1  К-1.Атомный вес ртути равен 200,6.
К-1.Атомный вес ртути равен 200,6.
Решение.
 Дж
Дж  моль-1
моль-1  К-1
К-1
 Дж
Дж  моль-1
моль-1  К-1
К-1
 Дж
Дж  моль-1
моль-1  К-1
К-1
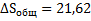 Дж
Дж  моль-1
моль-1  К-1
К-1
Ответ:  S = 21,56 Дж
S = 21,56 Дж  моль-1
моль-1  К-1.
К-1.
64. Определить изменение энтропии, если 0,0112 м3 азота нагреваются от 0 до 50°С. Одновременно давление уменьшается от 1,013∙105 до 1,013∙103 н/м2. Теплоемкость равна 29,29 дж/моль∙град.
Решение.

n=p 1V 1/RT 1=0,499 моль
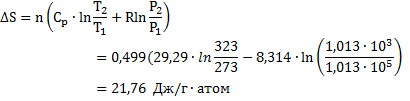
Ответ: 
65. Как изменится энтропия при нагревании 1 мольхлорида натрия от 25°С до 1073° К, если температура его плавления 800°С, удельная теплота плавления 516,7 дж/г. Мольная теплоемкость  (т) = 45,96+ 16,32∙
(т) = 45,96+ 16,32∙  дж/моль∙град.
дж/моль∙град.
Решение.
Δ 
Δ 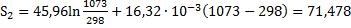


Ответ: 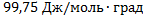
66. Найти изменение энтропии при нагревании 1 мольацетона от 25 до 100°С, если удельная теплоту испарения ацетона равна 514,6 дж/г,температура кипения равна 56°С, мольные теплоемкости жидкого ацетона
СР(ж)= 125 дж/моль∙град, паров ацетона Ср(г) = 22,47 + 201,8∙  63,5∙
63,5∙  дж/моль∙град.
дж/моль∙град.
Решение.
Δ 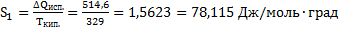


ΔS= Δ 
Ответ: 
67. Рассчитать изменение энтропии при нагревании 2 мольметанола от 25 до 100°С, если удельная теплота испарения СН3ОН 1100,4 дж/г,температура кипения 64,7° С, мольные теплоемкости жидкого метанола СР(ж) = 81,56 дж/моль∙град и паров метанола
СР(г)= 15,28+ 105,2∙10 -3T—31,04∙  дж/моль∙град.
дж/моль∙град.
Решение.

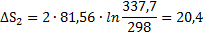

 дж/моль∙град.
дж/моль∙град.
Ответ:  дж/моль∙град.
дж/моль∙град.
68. Определить изменение энтропии при нагревании 1 мольэтанола от 25 до 100°С, если удельная теплота испарения С2Н5ОН 863,6 дж/г,температура кипени






