В определенных условиях (например, при воздействии определенных ферментов), аминокислоты способны реагировать друг с другом. В результате взаимодействия α-аминогруппы (—NH2) одной аминокислоты с α-карбоксильной группой (—СООН) другой аминокислотывозникает пептидная связь.
Образование пептидной связи можно представить себе, как отщепление молекулы воды от присоединяющихся к друг другу карбоксильной и аминогрупп (Рис.):
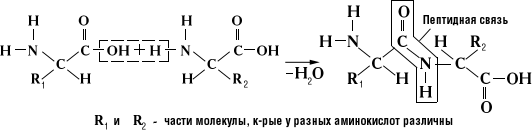
Пептидная связь - это амидная ковалентная связь, соединяющая аминокислоты в цепочку. Полипептидная цепь имеет определенное направление, так как у неё разные концы - либо свободная a -аминогруппа (N-конец), либо свободная a -карбоксильная группа (С-конец).
Изображение последовательности аминокислот в цепи начинается с N-концевой аминокислоты. С неё же начинается нумерация аминокислотных остатков. В полипептидной цепи многократно повторяется группа: -NH-CH-CO-. Эта группа формирует пептидный остов. Последовательность аминокислот в белке уникальна и детерминируется генами. Даже небольшие изменения первичной структуры могут серьезно изменять свойства белка
Функциональные свойства белков определяются их конформацией, т.е. расположением полипептидной цепи в пространстве. Уникальность конформации для каждого белка определяется его первичной структурой. В белках различают два уровня конформации пептидной цепи - вторичную и третичную структуру. Вторичная структура белков обусловлена способностью групп пептидной связи к водородным взаимодействиям: C=O....HN.
Пептид стремится принять конформацию с максимумом водородных связей. Однако возможность их образования ограничивается тем, что пептидная связь имеет частично двойной характер, поэтому вращение вокруг нее затруднено. Пептидная цепь приобретает не произвольную, а строго определенную конформацию, фиксируемую водородными связями.
Известны несколько способов укладки полипептидной цепи:
- a -спираль - образуется внутрицепочечными водородными связями между NH-группой одного остатка аминокислоты и CO-группой четвертого от нее остатка;
- b -структура (складчатый лист) - образуется межцепочечными водородными связями или связями между участками одной полипептидной цепи изогнутой в обратном направлении;
- беспорядочный клубок - это участки, не имеющие правильной, периодической пространственной организации. Но конформация этих участков также строго обусловлена аминокислотной последовательностью.
Содержание a -спиралей и b -структур в разных белках различно: у фибриллярных белков - только a -спираль или только b -складчатый лист; а у глобулярных белков - отдельные фрагменты полипептидной цепи: либо a -спираль, либо b -складчатый лист, либо беспорядочный клубок.
Основные типы вторичной структуры белков.
Часто в полипептидных цепях содержатся участки, последовательность аминокислотных остатков которых, образует локально упорядоченные трёхмерные структуры. Совокупность таких упорядоченных структур называют вторичной структурой белков.
В результате совокупности действия таких факторов, как:
- плоское строение пептидной связи;
- возможность свободного вращения связей у α-углеродного атома
- постоянство углов и межатомных расстояний
формируются следующие типы вторичной структуры белков:
α-спираль, β-структура и β-складка.
α-спираль. Это — правая спираль, которую можно себе представить в виде пептидной цепи, закрученной вокруг гипотетического цилиндра. При графическом изображении спиральные участки изображаются цилиндром.
Характеристики α-спирали:
- содержит 3,6 аминокислотного остатка на виток с периодом повторяемости 5,4 нм *[0,54 Å (Å – ангстремы; 1 Å = 10 нм)];
- полипептидный остов образует плотные витки вокруг длинной оси молекулы;
- боковые радикалы выступают наружу;
- спираль удерживается водородными связями между атомом водорода N-H группы одной пептидной связи и кислородом группы С=О, принадлежащей другой пептидной связи, расположенной через четыре аминокислотных остатка над первой в следующем витке спирали;
- в α-спирали полностью использована возможность образования водородных связей (внутримолекулярные), поэтому она не способна образовывать водородные связи с другими элементами вторичной структуры.
Степень спирализации в белках колеблется от 5 до 80%. Для некоторых белков, например для цитохрома С, α-спираль лежит в основе пространственной структуры, другие, например химотрипсин, не имеют α спирализованных участков.
β-структура. β -структура является вторым элементом вторичной структуры белков.
β-складчатые структуры – графически изображаются стрелкой
β-структуры имеет складчатую поверхность. Водородные связи между β-тяжами изображены пунктиром
Характеристика β-структуры:
- остов полипептидной цепи в β-структуре вытянут таким образом, что имеет уже не спиральную, а зигзагообразную складчатую форму;
- боковые группы аминокислотных остатков (R-группы) направлены перпендикулярно плоскости складчатого слоя и расположены выше и ниже него;
- в отличие от α-спирали β-структура образована за счет межцепочечных водородных связей между соседними участками полипептидной цепи, так как внутрицепочечные контакты отсутствуют.
- в отличие от α-спирали, насыщенной водородными связями, каждый участок полипептидной цепи в β-структуре открыт для образования дополнительных водородных связей.
Соотношение между различными типами вторичных структур в составе белков варьирует в широких приделах, причём доля неупорядоченных структур часто превалирует над регулярными – α-спиралью и
β-структурой.
β-изгиб. В области неупорядоченных структур достаточно протяжённые зоны представлены петлями и резкими изгибами.
Наиболее часто встречаются так называемые β-изгибы, когда полипептидная цепь резко меняет своё направление на 180º. Этот изгиб по форме напоминает шпильку для волос и образуется между тремя аминокислотами за счет водородной связи (см. презентацию к лекции). Он необходим для изменения пространственного расположения полипептидной цепи при образовании третичной структуры белка.
!!! Какую именно конформацию принимают участки полипептидной цепи (α-спираль, β складку, β-изгиб или остаются неструктурированными) в значительной степени определяется первичной последовательностью полипептидной цепи.
Глобулярные булки
Структура глобулярных белков
Кроме структурных функций белки выполняют ещё ряд разнообразных функций. Среди них одна из главных - катализ химических реакций, протекающих в клетке.
1) Для осуществления каталитической (ферментативной) функции белок должен связываться с трехмерным субстратом, т.е. место связывания в молекуле белка, называемое активным центром, должно быть трехмерным. Это возможно только при условии, что сам белок имеет трехмерную третичную (глобулярную) структуру.
Таким образом, соответствие структуры и функции, предопределяет наличие у функциональных белков глобулярной структуры.
2) Кроме того, глобулярная структура обеспечивает растворимость белков в воде, так как большинство реакций протекает в цитоплазме клетки. Действительно, гидрофобные радикалы аминокислотных остатков могут быть спрятаны внутрь глобулы, а в воду экспонированы (направлены) гидрофильные остатки.
3) Для обеспечения компактной трехмерной структуры белок должен обладать элементами вторичной структуры небольшой протяженности, соединенных неструктурированными участками полипептидной цепи. Эти участки позволяют белку сворачиваться в компактную глобулу.
Рассмотрим особенности строения глобулярных белков на примере белка, обладающего ферментативной активностью – рибонуклеазы А
Структура рибонуклеазы А (одна цепь, 128 аминокислотных остатков) построена преимущественно из β-слоев. Тем не менее, основные принципы организации остаются прежними. Дисульфидные связи (4) вместе с большим числом водородных связей (72 связи) служат каркасом молекулы и скрепляют структуру в плотную глобулу.
10)Фибрилярные белки: аминокислотный состав, структура. Конформация и функции фибрилярных белков на примере а-кератина и коллагена.
Как уже говорилось выше, структура биополимеров теснейшим образом связана с их биологической функцией. Для того чтобы выполнять структурную функцию (волосяной покров, укрепление стенок клетки, цитоскелет клетки и т.п.), белок должен обладать вытянутой нитевидной структурой и не растворяться в воде. Такие белки называются фибриллярными.
Особенности конформации фибриллярных белков:
1) Существование вытянутой нитевидной структуры белка возможно только при условии высокой степени структурированности его молекулы, т.е. формировании вторичной структуры (α-спиральной или β-складчатой) практически на всём протяжении полипептидной цепи (более 80%).
2) Кроме того, в первичной структуре должны преобладать неполярные и незаряженные аминокислоты. Высокая степень структурированности фибриллярных белков не позволяет им сворачиваться в компактные структуры (глобулы). Поэтому гидрофобные радикалы аминокислотных остатков развёрнуты в стороны воды, что обеспечивает нерастворимость фибриллярных белков в воде.
α-Структурные фибриллярные белки, сложены из длинных перевитых спиралей (суперсперализация)
В α-кератине такие спирали охватывают всю белковую цепь, — да и большая часть миозиновой цепи образует фибриллу такого типа. Такие структуры содержатся также в шелке — но не обычном шелке тутового шелкопряда, а шелке пчел и муравьев.
Характеристика структуры молекулы коллагена. Особняком стоит тройная спираль коллагена - основного белка соединительной ткани
а) молекула коллагена построена из трёх полипептидных цепей. Каждая полипептидная цепь содержит около 1000 аминокислотных остатков (35% - глицин, 21% - пролин и оксипролин, 11% - аланин);
б) полипептидные цепи коллагена построены из чередующихся блоков --гли–х–про- или -гли–х–оксипро- (х - аланин или другие аминокислоты). Как пролин, так и оксипролин препятствуют образованию α спиралей и β-складок;
в) каждая полипептидная цепь имеет конформацию плотной (3 аминокислотных остатка на виток) левозакрученной спирали (спирализация 1-го порядка);
г) в молекуле коллагена эти три спирали перевиты друг с другом, в результате чего образуется тройная суперспираль коллагена (спирализация 2-го порядка), которая принципиально отличается от α спирали. Это очень слабо закрученная (один оборот на 10 000 нм) правая спираль;
д) между спиралями 1-го порядка за счёт пептидных групп образуются водородные связи.
Такое строение обеспечивает прочность коллагеновых волокон.
Денатурация и ренатурация белков.
Денатурация белков
Специфические биологические функции белков, например ферментов или гормонов, зависят от их конформации, нарушения которой могут привести к потере биологической активности. В связи с этим, о белке, обладающем нормальной конформацией, говорят, что он находится в нативном (естественном) состоянии.
Нативный белок это белок, который обладает конформацией (пространственной структурой), обусловливающей специфическую биологическую функцию молекулы.
Довольно мягкие изменения физических условий, в том числе изменения pH, температуры или обработка водными растворами некоторых органических веществ (детергентов, этанола или мочевины), могут нарушить эту конформацию. В белках, подвергнутых таким воздействиям, происходит денатурация.
Денатурация белков - это разрушение четвертичной, третичной и частично вторичной структур путём разрыва слабых нековалентных взаимодействий, (водородных, ионных, гидрофобных) и дисульфидных связей, сопровождающихся потерей функции белка.
Следует различать денатурацию и деградацию белков. При деградации происходит фрагментация первичной структуры и образование фрагментов белковой макромолекулы, т. е. образуются биологически неактивные олигопептиды.
Примером денатурации белковой молекулы может служить тепловая денатурация белков в растворах при 50-60º, обусловленная разрывом нековалентных взаимодействий, при помощи которых образуется третичная структура.
Денатурация, осуществляемая в мягких условиях, часто оказывается обратимой, т. е. при удалении денатурирующего агента происходит восстановление (ренатурация) нативной конформации белковой молекулы. Для ряда белков восстановление может быть 100%-м, причём это касается ни только водородных и гидрофобных связей, но и дисульфидных мостиков.
При обратимой денатурации восстанавливается и биологическая активность белков.
Эти данные служат дополнительным доказательством того, что вторичная и третичная структуры белков предопределены аминокислотной последовательностью.
Третичная структура белков и природа сил, стабилизирующих её. Инсулини рибонуклеаза А.
Третичная структура белков – это трёхмерная структура полипептидной цепи, которая определяется первичной и вторичной структурой и характеризуется наличием биологической активности.
Это объясняется тем, что в результате взаимодействий аминокислотных остатков полипептидной цепи уменьшается свободное вращение связей полипептидного остова.
Ограничение подвижности и тем самым формирование и поддержание третичной структуры возникает также за счёт общего вклада слабых нековалентных взаимодействий
Гормон инсулин состоит из двух пептидных цепей — короткой (21 аминокислотный остаток) и длинной (30 аминокислотных остатка).
три S–S-мостика играют ключевую роль в организации третичной структуры:
- один из них взаимно ориентирует две α-спирали короткой последовательности;
- два других скрепляют короткую и длинную цепи;
- третичная последовательность буквально пронизана водородными связями;
- третичная структура инсулина состоит в основном из α-спиралей.
Третичная структура белковой молекулы возникает самопроизвольно. Движущей силой, свёртывающей полипетидную цепь белка в строгое трёхмерное образование, является взаимодействие аминокислотных радикалов с молекулами воды.
При этом гидрофобные радикалы втягиваются внутрь белковой молекулы, образуя там гидрофобную зону (гидрофобный карман), а гидрофильные радикалы ориентируются в сторону растворителя – воды.






