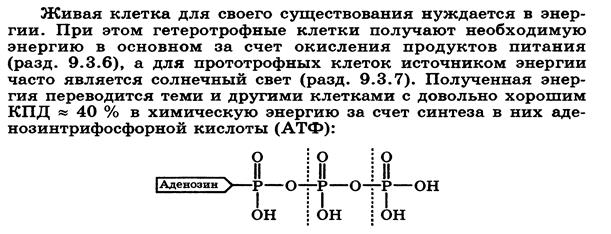
Термодинамические условия равновесия. Стандартная энергия Гиббса образования вещества, стандартная энергия Гиббса биологического окисления вещества. Стандартная энергия Гиббса реакции. Примеры экзергонических и эндергонических процессов, протекающих в организме. Принцип энергетического сопряжения.







Под стандартной энергией Гиббса биологического окисления ΔG°, понимают изменение энергии Гиббса при реакции биологического окисления 1 моль вещества, находящегося в стандартном состоянии
Под стандартной энергией Гиббса образования ΔG°, понимают изменение энергии Гиббса при реакции образования 1 моль вещества, находящегося в стандартном состоянии



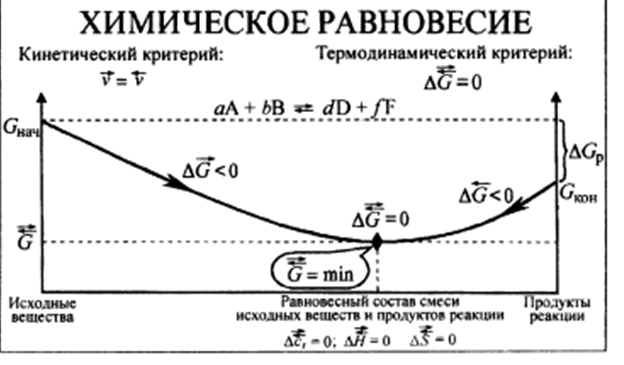
Химическое равновесие. Обратимые и необратимые по направлению реакции. Термодинамические условия равновесия в изолированных и закрытых системах. Константа химического равновесия.





 10.Общая константа последовательно и параллельно протекающих процессов. Уравнения изотермы и изобары химической реакции. Прогнозирование смещения химического равновесия. Понятие о буферном действии, гомеостазе и стационарном состоянии живого организма.
10.Общая константа последовательно и параллельно протекающих процессов. Уравнения изотермы и изобары химической реакции. Прогнозирование смещения химического равновесия. Понятие о буферном действии, гомеостазе и стационарном состоянии живого организма.
Обратимые по направлению химические реакции – реакции, которые при данных внешних условиях могут самопроизвольно протекать как в прямом, так и в обратном направлениях
Константа химического равновесия – для обратимой реакции общего вида aA + bB ó pP + qQ при постоянных внешних условиях в равновесии отношение произведений концентраций продуктов к произведению концентрации реагентов есть величина постоянная, не зависящая от химического состава системы
[P]p [Q]q
Kc = [A]a [B]b = const при p, T = const
Уравнение изотермы химической реакции:
ΔGр-я = RTln(Πc/Kc)
Уравнение изобары химической реакции
K2 ΔrH
ln K1 = R ((1/T1) – (1/T2))
Прогнозирование смещения химического равновесия. С помощью уравнения изотермы можно рассчитать G реакции при заданном значении Πc, если известна Kc реакции. И наоборот, если известна G реакции при заданном Πc, то можно рассчитать Kc.
Гомеостаз - относительное динамическое постоянство внутренней среды (крови, лимфы, тканевой жидкости) и устойчивость основных физиологических функций (кровообращения, дыхания, терморегуляции, обмена веществ и т.д.) организма человека и животных. Регуляторные механизмы, поддерживающие физиологическое состояние или свойства клеток, органов и систем целостного организма на оптимальном уровне, называются гомеостатическими.
Учение о гомеостазе - это учение о жизненных процессах, имеющих только одну цель: поддержание постоянства условий жизни во внутренней среде, как необходимый элемент свободной и независимой жизни.
Основная функция буферных систем предотвращение значительных сдвигов рН путём взаимодействия буфера как с кислотой, так и с основанием. Действие буферных систем в организме направлено преимущественно на нейтрализацию образующихся кислот.
В организме одновременно существует несколько различных буферных систем. В функциональном плане их можно разделить на бикарбонатную и небикарбонатную. Небикарбонатная буферная система включает гемоглобин, различные белки и фосфаты. Она наиболее активно действует в крови и внутри клеток.
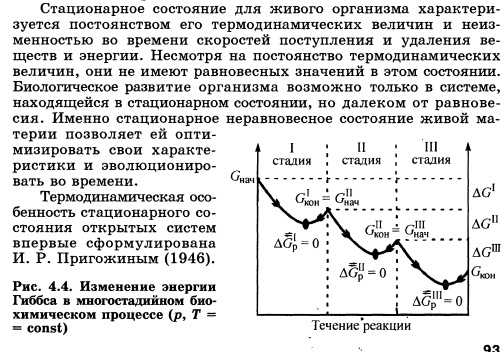
Организм можно определить как физико-химическую систему, существующую в окружающей среде в стационарном состоянии. Именно эта способность живых систем сохранять стационарное состояние в условиях непрерывно меняющейся среды и обусловливает их выживание. Для обеспечения стационарного состояния у всех организмов - от морфологически самых простых до наиболее сложных - выработались разнообразные анатомические, физиологические и поведенческие приспособления, служащие одной цели - сохранению постоянства внутренней среды.


Стационарное состояние
Организм взрослого человека характеризуется относительным постоянством многих параметров, в том числе и биохимических показателей, представляющих собой определенные концентрации биологически активных веществ. Однако такое состояние нельзя назвать равновесием, так как оно не приложимо к открытым системам.
Организм человека, как живая система, постоянно обменивается с окружающей средой различными веществами: потребляет питательные вещества и выделяет продукты их окисления и распада. Следовательно, для организма характерно стационарное состояние, определяемое как постоянство параметров при постоянной скорости обмена системы с окружающей средой веществом и энергией. В первом приближении стационарное состояние можно рассматривать как ряд родственных состояний, связанных между собой процессами релаксации.
Для поддержания стационарного состояния организму взрослого человека требуется поступление извне около 3000 ккал в сутки. Рациональное питание предусматривает сбалансированное питание при соотношении белков, жиров и углеводов по массе 1:1:4.







