МИНОБРНАУКИ РОССИИ
ФЕДЕРАЛЬНОЕ ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ ОБРАЗОВАТЕЛЬНОЕ
УЧРЕЖДЕНИЕ ВЫСШЕГО ОБРАЗОВАНИЯ
«МОСКОВСКИЙ АВИАЦИОННЫЙ ИНСТИТУТ
(национальный исследовательский институт)» (МАИ)
Институт №2
«Аэрокосмические конструкции, технологии и системы управления»
Кафедра
«Технология производства двигателей
летательных аппаратов»
Реферат
“Тантал”
по дисциплине
«Химия»
Студент: Попов А.Б.
Фамилия И.О.
Группа: 2ДЛА-1ДБ-322
Полный номер группы
Преподаватель: Ряховская Е.В.
Фамилия И.О.
Отметка о выполнении (защите) работы
Москва 2015
Оглавление
Введение. 3
Основная информация. 4
Оценка восстановительной активности металла и окислительно-восстановительной способности его соединений. 4
Поведение металла в различных средах. 4
Возможные процессы электрохимической коррозии. 6
Список литературы.. 7
Введение
Тантал открыт в 1802 году шведским химиком А. Г. Экебергом в двух минералах, найденных в Финляндии и Швеции. Однако в чистом виде выделить его не удалось. Из-за трудностей получения этот элемент был назван по имени героя древнегреческой мифологии Тантала.
Пластичный металлический тантал впервые получен немецким учёным В. Болтоном в 1903 году.
Первый промышленный штабик тантала был получен в 1922 году, при этом он не превышал по величине спичечную головку. Тогда элемент начал применяться в выпрямителях тока и радиолампах. Активное производство тантала было развёрнуто в самом конце Второй Мировой войны.
Тантал — редкий металл, в земной коре на его долю приходится 0,0002 %. В природе встречается в виде двух изотопов: стабильного 181Та (99,9877 %) и радиоактивного (вероятно) с периодом полураспада более 1015 лет 180mТа (0,0123 %). Последний является чрезвычайно стабильным изомером (возбуждённым состоянием) изотопа 180Та, период полураспада которого всего чуть более 8 часов.
Известно около 20 собственно минералов тантала — серия колумбит-танталит, воджинит, лопарит, манганотанталит и другие, а также более 60 минералов, содержащих тантал. Все они связаны с эндогенным минералообразованием. В минералах тантал всегда находится совместно с ниобием вследствие сходства их физических и химических свойств. Тантал — типично рассеянный элемент, так как изоморфен со многими химическими элементами. Месторождения тантала приурочены к гранитным пегматитам, карбонатитам и щелочным расслоенным интрузиям.
Основная информация
Положение в ПСXЭ:
● Порядковый номер - 73, показывает количество протонов и определяет заряд ядра.
● Номер периода — 5, показывает количество энергетических уровней.
● Подгруппа — Б, побочная подгруппа, показывает, что 1 или 2 электрона на внешнем уровне, остальные на предвнешнем и предпредвнешнем.
Актиний относится к f-элементам, валентные подуровни: 6s25d3
Степень окисления +5
Оценка восстановительной активности металла и окислительно-восстановительной способности его соединений
Химически тантал очень инертен. В компактном виде начинает окисляться на воздухе выше 300 °С, Наиболее характерна ст. ок+5,+2 и +3 малохарактерны и неустойчивы, за исключением фторидов.
ϕ0= -0,81 В
Поведение металла в различных средах
а) в атмосфере сухого воздуха (О2(г)):
На воздухе тантал покрывается тончайшей пленкой тантала оксидов. Обратимо поглощает Н2 с образованием твердого р-ра внедрения (до 30 ат. %Н) и гидрида состава Та2Н
б) в воде:
2Ta+ 10H2O = 2Ta(OH)5 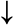 + 5H2
+ 5H2 
в) взаимодействие кислотами:
С галогенводородными кислотами неокислителями реагирует при температуре
2Ta+10HCL=2TaCl5+5H2(темп)
Концентрированные кислоты окислители на тантал не действуют, кроме того он нерастворим в царской водке. Конц. Хлорная, Серная кислота тоже на Тантал фактически не действуют. С температурой Тантал начинает постепенно медленно в них растворятся (H2SO4 выделяет SO2,а HClO4 переходит в HСlO3.Порошкообразный Тантал растворяется в смеси HF+HNO3.Плавиковая кислота (HF)реагирует с порошкообразным танталом со взрывом, что обусловлено по видимому образованием многих неустойчивых фторидов и бифторидов.
При действии на тантал конц. H3PO4 нужна высокая температура
6Тa+10H3PO4 = 2Ta3(PO4)5+15H2  (реакция замещения)
(реакция замещения)
Ta0 – 5e = Ta5+ 2 - восстановитель, процесс окисления
2H+ + 2e =H2 5 - окислитель, процесс восстановления
2Ta+10KOH+10HOH=2K5(Ta(OH)10)+5H2  (реакция замещения)
(реакция замещения)
Ta0 – 5e = Ta5+ 2 - восстановитель, процесс окисления
H+ + e =H2 5 - окислитель, процесс восстановления
В этой реакции тантал вытеснит водород, так как он активее, в результате получается водород (в виде газа).
д) взаимодействие с растворами и расплавами щелочей:
В конц. щелочах тантал медленно растворяется
2Ta+10KOH+10HOH=2K5(Ta(OH)10)+5H2  (реакция замещения)
(реакция замещения)
Ta0 – 5e = Ta5+ 2 - восстановитель, процесс окисления
H+ + e =H2 5 - окислитель, процесс восстановления
В этой реакции тантал вытеснит водород, так как он активее, в результате получается водород (в виде газа).
Возможные процессы электрохимической коррозии с аэрацией и без аэрации при контакте данного металла с металлом Fe в заданной среде (при значении рН=7).
а) сравнив стандартные потенциалы двух металлов, выявить, какой из них будет анодным, какой катодным участниками:
ϕTa 5+ = -0,81 В — анод
Ta0
ϕ Fe 2+ = -0,44 — катод
Fe0
б) написать соответствующие уравнения частных анодной и катодной реакции с:
Aнодный процесс: Ta5+ + 5e- → Ta 2
Kатодный процесс: Ta2O5 + 10H+ + 10e- → 2Ta + 5H2O 1
в) рассчитать ЭДС(корр.) и сделать вывод о возможности э/х коррозии:
ϕ O2 =1,23 -0,0059 pH=0,82 В
OH-
ЭДС(корр.) = ϕк - ϕа = 0,82-(-0,81)=1,63 В
ЭДС(корр.) > 0, значит реакция коррозии возможна
г) суммарная реакция коррозии:
2Ta5+ Ta2O5 + 10H+= 2Ta0+2Ta + 5H2O
продукты коррозии
Список источников
1. Коровин Н.В. Общая химия – М: «Высшая школа», 2002. 556 с.
2. Тептеева Е.С. Химия – М: «Эдвард», 2007. 203 с
3. http//: ru.wikipedia.ru
4. http//: nigma.ru






