82. В патогенезе отравлений и функциональных нарушений организма, экспонированного тяжелыми металлами, тесно сочетаются специфические элементы (избирательная токсичность
1.биохимия - это наука о природе и свойствах веществ, входящих в состав живых организмов, путях биосинтеза и использования этих веществ различными организмами в процессе жизнедеятельности. В зависимости от объекта исследования Б. подразделяют на Б. микробов, растений, животных и человека. принято делить Б. на статическую, занимающуюся преимущественно анализом состава организмов, динамическую, изучающую превращения веществ, и функциональную, выясняющую, какие химические процессы лежат в основе различных проявлений жизнедеятельности. Вся совокупность химических реакций, протекающих в организмах, включая усвоение веществ, поступающих извне (ассимиляция), и их расщепление (диссимиляция) вплоть до образования конечных продуктов, подлежащих выделению, составляет сущность и содержание обмена веществ — главного и постоянного признака всего живого. Понятно, что изучение обмена веществ во всех деталях — одна из основных задач Б. Биохимические исследования охватывают очень широкий круг вопросов: нет такой отрасли теоретической или прикладной биологии, химии и медицины, которая не была бы связана с Б., поэтому современная Б. объединяет ряд смежных научных дисциплин, ставших с середины 20 в. самостоятельными.
2. Важнейшее условие существования клетки, и, следовательно, жизни - нормальное функционирование биологических мембран. Мембраны - неотъемлемый компонент всех клеток.Все биологические мембраны имеют толщину от 5 до 10 нм, содержат белки липиды, соотношение между которыми варьирует в зависимости от происхождения мембраны. Кроме того, в них присутствуют углеводы, неорганические соли, вода и ряд других соединений; в некоторых мембранах обнаружены следы РНК (до 0,1%). У млекопитающих мембраны содержат особенно большое количество фосфолипидов и холестерола. В настоящее время общепринятой моделью строения мембран является жидкостно-мозаичная, предложенная в 1972 году С.Синджером и Дж.Николсоном. Структурной единицей мембраны является фосфолипидный бислой. Фосфолипиды - амфипатичекие молекулы, т.е. в одной молекуле имеются как гидрофильные, так и гидрофобные участки. Фосфолипидный бислой образуется за счет гидрофобного воздействия между цепями остатков жирных кислот, входящих в состав липидов. Он представляет собой листок, состоящий из 2 слоев фосфолипидов, причём их полярные головки обращены к воде, а цепи остатков жирных кислот формируют внутреннюю гидрофобную среду. При встряхивании фосфолипидов с водой они образуют шарообразные мицеллы, где цепи остатков жирных кислот направлены в сторону, противоположную гидрофильной поверхности. Липидный бислой с обеих сторон покрыт белками. В соответствии с жидкой мозаичной моделью мембраны сами липиды и некоторые белки способны передвигаться в плоскости бислоя. У мембран различают наружную и внутреннюю стороны, которые в большинстве случаев имеют неодинаковый состав, то есть мембраны асимметричны. Липиды и белки, расположенные на наружной стороне плазматической мембраны, обычно имеют ковалентно связанные с ними углеводы. Внутренняя сторона мембраны и внутриклеточные мембраны, как правило, лишены углеводов. Углеводная часть представлена полисахаридами, включающими обычно не более 15. При оптимальных для жизнедеятельности живых организмов температурах мембрана, как правило, имеет жидкокристаллическое состояние (промежуточное между жидким и твердым). Это состояние обусловлено, прежде всего, наличием в мембранах системы липид - белок - вода, формирующей различного типа упорядоченные структуры, обладающие в то же время определенной подвижностью. Мембраны выполняют большое число различных функций: мембраны определяют форму органеллы или клетки; барьерная: контролируют обмен растворимых веществ (например, ионов Na+, K+, Cl-) между внутренним и наружным компартментом; энергетическая: синтез АТФ на внутренних мембранах митохондрий и фотосинтез в мембранах хлоропластов; формируют поверхность для протекания химических реакций (фосфорилирование на митохондриальных мембранах);являются структурой, обеспечивающей распознавание химических сигналов (на мембране расположены рецепторы гормонов и нейромедиаторов);играют роль в межклеточном взаимодействии и способствуют передвижению клеток.
3. Мембрана обладает избирательной проницаемостью для растворимых веществ, что необходимо для: отделения клетки от внеклеточной среды; обеспечения проникновения в клетку и удержания в ней необходимых молекул (таких, как липиды, глюкоза и аминокислоты), а также удаления из клетки продуктов метаболизма (в том числе ненужных); поддержания трансмембранного градиента ионов. Внутриклеточные органеллы также могут обладать избирательно проницаемой мембраной. Транспорт через мембрану может быть пассивным, облегченным или активным.1. Пассивный транспорт - это движение молекул или ионов по концентрационному либо электрохимическому градиенту. Это может быть простая диффузия, как в случае проникновения через плазматическую мембрану газов (например О2 и СО2) или простых молекул (этанола). При простой диффузии растворенные во внеклеточной жидкости небольшие молекулы последовательно растворяются в мембране и затем во внутриклеточной жидкости. Указанный процесс неспецифичен, при этом скорость проникновения через мембрану определяется степенью гидрофобности молекулы, то есть ее жирорастворимостью. Скорость диффузии через липидный бислой прямо пропорциональна гидрофобности, а также трансмембранному градиенту концентрации или электрохимическому градиенту.2. Облегченная диффузия - это быстрое движение молекул через мембрану с помощью специфических мембранных белков, называемых пермеазами. Этот процесс специфичен, он протекает быстрее простой диффузии, но имеет ограничение скорости транспорта. Облегченная диффузия обычно характерна для водорастворимых веществ. Большинство (если не все) мембранных переносчиков являются белками. Облегченная диффузия отличается от обычной не только скоростью, но и способностью к насыщению. Увеличение скорости переноса веществ происходит пропорционально росту градиента концентрации только до определенных пределов. Последний определяется «мощностью» переносчика. 3. Активный транспорт - это движение ионов или молекул через мембрану против градиента концентрации за счет энергии гидролиза АТФ. Имеются три основных типа активного транспорта ионов: натрий-калиевый насос - Na+ /K+-аденозинтрифосфатаза (АТФаза), переносящая Na+ наружу, а K+ внутрь; кальциевый (Са2+) насос - Са2+-АТФаза, которая транспортирует Са2+ из клетки или цитозоля в саркоплазматический ретикулум; протонный насос - Н+-АТФаза. Созданные активным транспортом градиенты ионов могут быть использованы для активного транспорта других молекул - таких, как некоторые аминокислоты и сахара (вторичный активный транспорт). Активный транспорт ионов против градиента концентрации требует энергии, выделяемой при гидролизе АТФ до АДФ: АТФ АДФ + Ф (неорганический фосфат). Для активного транспорта, как и для облегченной диффузии, характерны: специфичность, ограничение максимальной скорости (то есть кинетическая кривая выходит на плато) и наличие ингибиторов. В качестве примера можно привести первичный активный транспорт, осуществляемый Na+ /K+ - АТФазой. Для функционирования этой фрментной системы антипорта необходимо наличие Na+, K+ и ионов магния. Она присутствует практически во всех клетках животных, причем ее концентрация особенно высока в возбудимых тканях (например, в нервах и мышцах) и в клетках, принимающих активное участие в движении осуществляемый Na+ через плазматическую мембрану (например, в корковом слое почек и слюнных железах).
4. Аминокислоты – это органические соединения, в молекуле которых одновременно присутствуют основная аминогруппа (-NH2) и кислая карбоксильная группа (-СООН). К настоящему времени описано около 200 природных аминокислот, выделенных из животного и растительного материала. Все природные аминокислоты делят на две группы: п р о т е и н о г е н н ы е, или белковые (обнаружены только в белках) и н е п р о т е и н о г е н н ы е, или небелковые (в белках не обнаружены). 1. Протеиногенные аминокислоты. Аминокислоты, обнаруженные в белках, можно классифицировать по разным признакам. По строению боковой цепи (R-группы) различают алифатические, ароматические и гетероциклические аминокислоты, по числу аминных и карбоксильных групп - моноаминомонокарбоновые (одна NH2-группа и одна СООН-группа), диаминомонокарбоновые (две NH2 -группы и одна СООН-группа), моноаминодикарбоновые (одна NH2 -группа и две СООН-группы), по положению изоэлектрической точки - нейтральные, основные и кислые. Аминокислоты, содержащие в радикалах ОН - группы, называют гидроксиаминокислотами, а содержащие серу - серосодержащими кислотами. По способности к синтезу в животном организме биохимики делят аминокислоты на заменимые и незаменимые. Аминокислоты, содержащие NH-группы вместо NH2 - групп, называют иминокислотами.
По полярности R-групп, т.е. способности R-групп к взаимодействию с водой при соответствующих внутриклеточных условиях рН (рН вблизи 7,0), аминокислоты делят на четыре группы: с неполярными или гидрофобными R-группами, полярными, но не заряженными R-группами, отрицательно заряженными R-группами и положительно заряженными R-группами. Рассмотрим строение аминокислот этих групп. Растения и некоторые микроорганизмы могут синтезировать все аминокислоты, нужные им для построения клеточных белков. Животный организм способен синтезировать только около половины аминокислот, необходимых ему для построения белков своего тела. Эти аминокислоты получили название з а м е н и м ы е. Остальные десять протеиногенных аминокислот животные организмы синтезировать не могут и должны получать их с пищей. Эти аминокислоты называют н е з а м е н и м ы м и или о б я з а т е л ь н ы м и. К ним принадлежат: валин, изолейцин, метионин, лейцин, лизин, треонин, триптофан, фенилаланин, аргинин и гистидин. Отсутствие или недостаток в пище каких-либо незаменимых аминокислот приводит к угрожающим жизни явлениям (задержка роста, расстройство биосинтеза белков, возникновение заболеваний и т.п.).
5. Строение молекулы белка. макромолекулы белка имеют вид шариков (глобул). каждому белку присущ определенный, всегда постоянный характер укладки. В сложной структуре белковой макромолекулы различают несколько уровней организации. Первым, наиболее простым из них является сама полипептидная цепь, т. е. цепь аминокислотных звеньев, связанных между собой пептидными связями. Эта структура называется первичной структурой белка; в ней все связи ковалентные, т. е. самые прочные химические связи. Следующим, более высоким уровнем организации является вторичная структура, где белковая нить закручивается в виде спирали. Витки спирали располагаются тесно, и между атомами и аминокислотными радикалами, находящимися на соседних витках, возникает притяжение. В частности, между пептидными связями, расположенными на соседних витках, образуются водородные связи (между NH- и СО- группами). Водородные связи значительно слабее ковалентных, но, повторенные многократно, они дают прочное сцепление. Полипептидная спираль, «прошитая» многочисленными водородными связями, представляет достаточно устойчивую структуру. Вторичная структура белка подвергается дальнейшей укладке. Она сворачивается причудливо, но вполне определенно и у каждого белка строго специфично. В результате возникает уникальная конфигурация, называемая третичной структурой белка. Связи, поддерживающие третичную структуру, еще слабее водородных. Они называются гидрофобными. Это -- силы сцепления между неполярными молекулами или неполярными радикалами. Такие радикалы встречаются у ряда аминокислот. У некоторых белков в поддержании белковой макромолекулы существенную роль играют так называемые S--S (эс--эс связи) -- прочные ковалентные связи, возникающие между отдаленными участками полипептидной цепи. В молекуле белка аминокислотные остатки соединены так называемой пептидной связью. Полная последовательность аминокислотных остатков в такой цепи называется первичной структурой белка. В составе белка обычно имеются как кислые, так и щелочные аминокислоты, так что белковая молекула имеет и положительные, и отрицательные заряды. Значение рН, при котором количество отрицательных зарядов равно количеству положительных, называется изоэлектрической точкой белка. Обычно белковая цепочка складывается в более сложные структуры. Кислород группы C=O может образовывать водородную связь с водородом группы N-H, расположенной в другой аминокислоте. За счет таких водородных связей формируется вторичная структура белка. Одна из разновидностей вторичной структуры - б-спираль. В ней каждый кислород С=О-группы связан с водородом 4-й по ходу спирали NH-группы. На один виток спирали приходится 3,6 аминокислотных остатка, шаг спирали составляет 0,54 нм.Во многих белках имеется т. н. в-структура, или в-слой, в ней полипептидные цепочки почти полностью развернуты, их отдельные участки своими группами -СО- и -NH- образуют водородные связи с другими участками той же цепочки или соседней полипептидной цепи.
П е п т и д н а я с в я з ь. Взаимодействие аминогруппы одной аминокислоты с карбоксильной группой другой сопровождается выделе-нием молекулы воды. Реакция, идущая с выделением воды, называется реакцией к о н д е н с а ц и и, а возникающая ковалентная азот-углеродная (-СО - NH-) связь - п е п т и д н о й (амидной) связью:
NH2-CH-COOH + NH2-CH-COOH ® NH2 -CH-CO-NH-CH-COOH + H2 O
½ ½ ½ ½
R R R1 R 1
Образование пептидной связи в белках происходит только за счет взаимодействия a-аминогруппы и a-карбоксильной группы аминокислот. Соединение, образованное в результате конденсации двух аминокислот, называют дипептидом. На одном конце его молекулы находится свободная a-аминогруппа, а на другом - свободная a-карбоксильная группа. Благодаря этому к дипептиду можно присоединить еще одну аминокислоту и получить трипептид и т.д.Аминокислотные звенья, входящие в состав пептида называют а м и н о к и с л о т н ы м и остатками.
Д и с у л ь ф и д н а я с в я з ь. Эта прочная ковалентная связь образуется в результате окисления SH-групп двух, рядом расположенных радикалов цистеина:…………..
Дисульфидные связи могут возникать как между разными полипептидными цепями, так и между различными участками одной и той же полипептидной цепи.
6. Белками называются высокомолекулярные коллоидные соединения, состоящие из α-аминокислот. Вторичная структура белка – это ориентация в пространстве аминокислотных остатков, соединенных в полипептидную цепь. В формировании вторичной структуры участвуют водородные связи. Различают три основных типа вторичной структуры полипептидных цепей: α-спираль, β-структура (складчатый слой) и беспорядочный клубок.
При образовании α-спирали полипептидная цепь закручивается вокруг оси. Наиболее устойчива правая α-спираль.
В β-структуре (складчатом слое) пептидные цепи располагаются параллельно друг другу, образуя пространственную фигуру, подобную складчатому листу, сложенному гармошкой. Как правило, такую структуру образуют вытянутые полипептидные цепи.
Стабилизация β-структуры достигается за счет образования межцепочечных водородных связей, в которых принимают участие все пептидные связи.
Вторичная структура белковой молекулы определяется ее первичной структурой. Третичная структура белка определяет пространственную организацию белковой молекулы. Образуется самопроизвольно и зависит от размера, формы и полярности аминокислотных остатков, их последовательности расположения в полипептидной цепи, т.е. от первичной структуры белка, а также от типа ее вторичной структуры, определяя пространственную организацию белковой молекулы. Она возникает в результате взаимодействия между цепочками полипептидов и поддерживается дисульфидными и ионными связями, гидрофобными и электростатическими взаимодействиями.
Третичная структура, так же как и вторичная, обусловлена аминокислотной последовательностью в полипептидной цепи, третичная структура зависит от аминокислотной последовательности далеко расположенных друг от друга участков цепи. В результате множества сравнительно слабых связей все части пептидной цепи белка оказываются фиксированными относительно друг друга, образуя компактную структуру. Четвертичная структура – это ассоциация нескольких полипептидных цепей, которая образуется посредством нековалентных связей (водородных, ионных, гидрофобных взаимодействий, электростатического притяжения). Каждая полипептидная цепь, участвующая в образовании четвертичной структуры, называется субъединицей, или протомером. Молекулы белков, обладающие четвертичной структурой, при определенных условиях могут диссоциировать на субъединицы – протомеры, а при других условиях вновь ассоциировать, образуя димеры, а затем первоначальную олигомерную молекулу. Т.о. белки состоят из аминокислотных остатков, связанных между собой пептидными связями и образующих полипептидные цепи, которые за счет дисульфидных, водородных, ионных связей, а также гидрофобных взаимодействий располагаются в пространстве определенным образом, т.е. имеют при данных условиях определенную конформацию. Нативная конформация возникает при нормальных физиологических условиях.
Классификация белков
Все природные белки (протеины) подразделяют на два больших класса:1 Простые белки гидролизуются кислотами или щелочами до аминокислот и не дают при гидролизе других органических и неорганических соединений. Они состоят только из остатков α-аминокислот.Классификация простых белков основана на растворимости.1 Альбумины – белки, которые растворяются в воде. К этим белкам относятся белок куриного яйца, белки зародыша семян злаковых (однодольных) растений, белки семян двудольных растений. 2 Глобулины – белки, растворимые в солях. Глобулины составляют большую часть белков семян масличных культур.3 Проламины – белки, которые растворяются в 60-80%-ном растворе этилового спирта. Название «проламины» они получили вследствие того, что в их состав входит большое количество аминокислоты пролина. Проламины синтезируются только в семенах злаковых растений 4 Глютелины – белки, которые извлекаются из растительных тканей разбавленными растворами щелочей (0,2%-ный NаОН). Кроме этих четырех групп белков к простым относят также следующие белки со специфическими свойствами:5 Протамины – это белки небольшой молекулярной массы, состоящие на 80% из щелочных аминокислот и не содержащие серу. 6 Гистоны – низкомолекулярные белки также основного характера, содержатся в хромосомах клеточных ядер и играют важную роль в образовании структуры хроматина. Гистоны – настоящие белки, в их состав входят почти все белковые аминокислоты. 2. Сложные белки кроме аминокислотных остатков белковой части молекулы содержат также небелковую, или простетическую группу. Простетическая группа может быть представлена химическими веществами различной природы (табл. 1). Сложные белки подразделяются по небелковому компоненту. Полноценными называют белки, содержащие все незаменимые аминокислоты. Белки, не содержащие хотя бы одну незаменимую аминокислоту, называют н е п о л н о ц е н н ы м и. Функции белков
1 Каталитическая. Наиболее многочисленная группа белков – это белки-ферменты, катализирующие биохимические реакции. С помощью белков-ферментов в живой клетке достигается закономерная последовательность химических превращений веществ, обеспечивающая жизнедеятельность организмов. 2 Запасная. Запасные белки в больших количествах накапливаются в клетках зерна и семян при созревании на растении, а затем при прорастании зерна и семян гидролизуются до аминокислот или молекулярных пептидов, используемых затем клеткой для формирования нового растения на ранних стадиях развития. В животном организме белки в запас не откладываются поэтому должны поступать вместе с пищей ежедневно в необходимых количествах.3 Защитная. Защитные белки предохраняют живой организм от разрушения или способствуют его выживанию при повреждении. Защитная функция белков – токсинов, вырабатываемых растениями, заключается в том, что они защищают растения от поедания их животными, а также ингибируют протеолитические ферменты насекомых-вредителей, повреждающих семена многих растений.4 Структурная. Структурные белки входят в состав покровных тка тканей растений,Они составляют также структурную основу биомембран клеток, обеспечивая сохранение органеллами клетки необходимой последовательности биохимических реакций.5 Сократительная и двигательная. К этим белкам относится миозин мышц.6 Регуляторная. Эти белки участвуют в регуляции обменных реакций. К ним относятся многие гормоны, например инсулин, регулирующий обмен глюкозы.7 Транспортная. Транспортные белки переносят специфические молекулы или ионы. Например, гемоглобин. Связывают кислород и переносят его к периферическим тканям.
8. Физические свойства белков
1. В живых организмах белки находятся в твердом и ра
створенном состоянии. Многие белки являются кристаллами, однако, они не дают истинных растворов, т.к. молекула их имеет очень большую величину. Водные растворы белков – это гидрофильные коллоиды, находящиеся в протоплазме клеток, и это активные белки. Кристаллические твердые белки – это запасные соединения. Денатурированные белки (кератин волос, миозин мускулов) являются опорными белками. 2. Все белки имеют, как правило, большую молекулярную массу. Она зависит от условий среды (t°, рН) и методов выделения и колеблется от десятков тысяч до миллионов. 3. Оптические свойства. Растворы белка преломляют световой поток, и чем больше концентрация белка, тем сильнее преломление. Пользуясь этим свойством, можно определить содержание белка в растворе. В виде сухих пленок белки поглощают инфракрасные лучи. Они поглощаются пептидными группами. Денатурация белка – это внутримолекулярная перегруппировка его молекулы, нарушение нативной конформации, не сопровождающиеся расщеплением пептидной связи. Аминокислотная последовательность белка не изменяется. В результате денатурации происходит нарушение вторичной, третичной и четвертичной структур белка, образованных нековалентными связями, и биологическая активность белка утрачивается полностью или частично, обратимо или необратимо в зависимости от денатурирующих агентов, интенсивности и продолжительности их действия. Изоэлектрическая точка Белки, как и аминокислоты, - амфотерные электролиты, которые мигрируют в электрическом поле со скоростью, зависящей от их суммарного заряда и рН среды. При определенном для каждого белка значении рН его молекулы электронейтральны. Это значение рН называется изоэлектрической точкой белка. Изоэлектрическая точка белка зависит от числа и природы заряженных групп в молекуле. Белковая молекула заряжена положительно, если рН среды ниже величины ее изоэлектрической точки, и отрицательно, если рН среды выше значения изоэлектрической точки данного белка. В изоэлектрической точке белок обладает наименьшей растворимостью и наибольшей вязкостью, в результате чего происходит наиболее легкое осаждение белка из раствора – коагуляция белка. Изоэлектрическая точка – одна из характерных констант белков. Однако если довести раствор белка до изоэлектрической точки, то сам по себе белок все же не выпадает в осадок. Это объясняется гидрофильностью белковой молекулы.
9. Физическо-химические свойства белков определяются их высокомолекулярной природой, компактность укладки полипептидных цепей и взаимным расположением остатков аминокислот. Молекулярная масса варьируется от 5 до 1 млн., а константы седиментации - от 1 до 20 (и выше). Средний удельный объем белковых молекул -0,70-0,75 см3/г, а константы диффузии - 106-108 см2/с. Максимум поглощения белков, в УФ-области спектра, обусловленный наличием ароматических аминокислот, находится вблизи 280 нм. Белки дают ряд цветных реакций, обусловленных наличием определенных аминокислотных остатков или химических группировок. К важнейшим из них относятся: биуретовая реакция (пептидные связи), ксантопротеиновая реакция (ароматические ядра остатков тирозина, триптофана, фенилаланина), Адамкевича реакция (индольное кольцо триптофана), Миллона реакция (фенольный радикал тирозина), Паули реакция (имидазольное кольцо гистидина), Сакагучи реакция (гуанидиновая группа аргинина) и нингидриновая реакция (аминограппа).
10.Все белки принято делить на простые белки,или протеины, и сложные белки, или протеиды (комплексы белков с небелковыми соединениями).Простые белки являются полимерами только аминокислот; сложные, помимо остатков аминокислот, содержат также небелковые, так называемые простетические группы.Сложные белки делят на ряд классов в зависимости от характера простетической группы.ФосфопротеиныИмеют в качестве небелкового компонента фосфорную кислоту. Представителями данных белков являются казеиноген молока, вителлин (белок желтков яиц). ЛипопротеиныСложные белки, простетическая группа которых образована липидами. Основная функция липопротеинов -- транспорт по крови липидов. МеталлопротеиныСодержат катионы одного или нескольких металлов. Наиболее часто это -- железо, медь, цинк, молибден, реже марганец, никель. ГликопротеиныПростетическая группа представлена углеводами и их производными. Исходя из химического строения углеводного компонента, выделяют 2 группы:Истинные -- в качестве углеводного компонента наиболее часто встречаются моносахариды. Протеогликаны -- построены из очень большого числа повторяющихся единиц, имеющих дисахаридный характер (гиалуроновая кислота, гипарин, хондроитин, каротинсульфаты). Функции: структурно-механическую (имеются в коже, хряще, сухожилиях); каталитическую (ферменты); защитную; участие в регуляции клеточного деления. Нуклеопротеины. Роль протеистической группы выполняет ДНК или РНК. Белковая часть представлена в основном гистонами и протаминами. Такие комплексы ДНК с протаминами обнаружены в сперматозоидах, а с гистонами -- в соматических клетках, где молекула ДНК “намотана” вокруг молекул белка-гистона. Нуклепротеинами по своей природе являются вне клетки вирусы -- это комплексы вирусной нуклеиновой кислоты и белковой оболочки – капсида. Нуклеопротеины состоят из белков и нуклеиновых кислот. Последние рассматриваются как простетические группы. В природе обнаружено 2 типа нуклеопротеинов, отличающихся друг от друга по составу, размерам и физико-химическим свойствам,– дезоксирибонуклеопротеины (ДНП) и рибонуклеопротеины (РНП). Названия нуклеопротеинов отражают только природу углеводного компонента (пентозы), входящего в состав нуклеиновых кислот. У РНП углевод представлен рибозой, у ДНП – дезоксирибозой. Термин «нуклеопротеины» связан с названием ядра клетки, однако ДНП и РНП содержатся и в других субклеточных структурах. Следовательно, речь идет о химически индивидуальном классе органических веществ, имеющих своеобразные состав, структуру и функции независимо от локализации в клетке. Доказано, что ДНП преимущественно локализованы в ядре, а РНП – в цитоплазме. В то же время ДНП открыты в митохондриях, а в ядрах и ядрышках обнаружены также высокомолекулярные РНП.
11. Все белки принято делить на простые белки,или протеины, и сложные белки, или протеиды (комплексы белков с небелковыми соединениями).Простые белки являются полимерами только аминокислот; сложные, помимо остатков аминокислот, содержат также небелковые, так называемые простетические группы.Сложные белки делят на ряд классов в зависимости от характера простетической группы.ФосфопротеиныИмеют в качестве небелкового компонента фосфорную кислоту. Представителями данных белков являются казеиноген молока, вителлин (белок желтков яиц). МеталлопротеиныСодержат катионы одного или нескольких металлов. Наиболее часто это -- железо, медь, цинк, молибден, реже марганец, никель. ГликопротеиныПростетическая группа представлена углеводами и их производными. Нуклеопротеины. Роль протеистической группы выполняет ДНК или РНК. Белковая часть представлена в основном гистонами и протаминами. ЛипопротеиныСложные белки, простетическая группа которых образована липидами. Основная функция липопротеинов -- транспорт по крови липидов.К белкам этого класса относятся казеиноген молока, в котором содержание фосфорной кислоты достигает 1%; и др. Большое количество фосфопротеинов содержится в клетках ЦНС. Характерной особенностью структуры фосфопротеинов является то, что фосфорная кислота оказывается связанной сложноэфирной связью с белковой молекулой через гидроксильные группы β-оксиаминокислот, главным образом серина и в меньшей степени треонина. На одну молекулу белка обычно приходится 2–4 остатка фосфата. Фосфопротеины содержат органически связанный, лабильный фосфат, абсолютно необходимый для выполнения клеткой ряда биологических функций. Кроме того, они являются ценным источником энергетического и пластического материала в процессе эмбриогенеза и дальнейшего постна-тального роста и развития организма.


12. Хромопротеины (от греч. chroma – краска) состоят из простого белка и связанного с ним окрашенного небелкового компонента. Различают гемопротеины (содержат в качестве простетической группы железо), маг-нийпорфирины и флавопротеины (содержат производные изоаллоксазина). Хромопротеины наделены рядом уникальных биологических функций: они участвуют в таких фундаментальных процессах жизнедеятельности, как фотосинтез, дыхание клеток и целостного организма, транспорт кислорода и диоксида углерода, окислительно-восстановительные реакции, свето-и цветовосприятие и др. Таким образом, хромопротеины играют исключительно важную роль в процессах жизнедеятельности. Например, подавление дыхательной функции гемоглобина путем введения оксида углерода (СО) либо утилизации (потребление) кислорода в тканях путем введения синильной кислоты или ее солей (цианидов), ингибирующих ферментные системы клеточного дыхания, моментально приводит к смерти организма. Хромопротеины являются непременными и активными участниками аккумулирования энергии, начиная от фиксации солнечной энергии в зеленых растениях и утилизации ее до превращений в организме животных и человека. Хлорофилл (магнийпорфирин) вместе с белком обеспечивает фотосинтетическую активность растений, катализируя расщепление молекулы воды на водород и кислород (поглощением солнечной энергии). ГЕМОГЛОБИН осн. белок дыхат. цикла, участвующий в переносе О2 от органов дыхания к тканям, а в обратном направлении - СО2. Содержится в эритроцитах крови почти всех позвоночных и гемолимфе большинства беспозвоночных животных. Гемоглобин взрослого человека (НbА) имеет мол. м. 6,49*104 и принадлежит к числу наиб. изученных белков. Его форма в р-ре близка к эллипсоиду с осями 6,4, 5,5 и 5,0 нм; изоэлектрич. точка 6,9. Тетрамер НЬА состоит из двух и двухсубъединиц, их полипептидные цепи содержат соотв. 141 и 146 аминокислотных остатков. Известны первичная структура обеих цепей, а также пространств. структура оксигенированной, дезоксигенированной, ряда лигандированных, а также окисленной формы (содержит Fe3 +) НbА. Пространств. структура субъединиц (рис. 1) характеризуется наличием восьмиспиральных участков, включающих около 80% аминокислотных остатков, и внутр. полости -гемового кармана. Фиксирование тема в субъединице осуществляется в результате гидрофобных взаимод. пиррольных и винильных групп тема с алифатич. и ароматич. боковыми радикалами аминокислот, выстилающими полость кармана, а также благодаря координационной связи (направлена перпендикулярно к плоскости кольца тема) Fe2+ с аксиальным лигандом-имидазольной группой гистидина 
МИОГЛОБИН белок мышц позвоночных животных и человека, связывающий переносимый гемоглобином О2 и передающий его окислит. системам клетки. Состоит из одной полипептидной цепи, содержащей 153 аминокислотных остатка (мол. м. 17800), к-рая уложена в плотную глобулу размером 4,5 х 2,5 нм. В спец. полости миоглобина ("кармане") помещается гем, к-рый связан с остальной частью молекулы (глобином), как в гемоглобине. Ок. 75% полипептидной цепи находится в конформации a-спирали (все a-спирали правозакрученные). Между областями спи-рализации находятся 5 неспирализованных участков; такие же участки находятся на концах цепи. Внутр. область молекулы состоит гл. обр. из неполярных остатков лейцина, валина, метионина, фенилаланина и не содержит боковых полярных цепей глутаминовой и аспарагиновой к-т, глута-мина, аспарагина, лизина и аргинина. На наружной стороне молекулы расположены как полярные, так и неполярные аминокислотные остатки. Связывание лигандов сопровождается конформац. изменениями белка, и, наоборот, конформац. изменения вблизи тема изменяют его электронное состояние и реакц. способность (т.наз. электронно-конформац. взаимод.). Ф-ция миоглобина запасать О2 в мышцах при его избытке и освобождать при недостатке основана на способности иона Fe2+ обратимо связывать молекулу О2 с образованием оксимио-глобина. Особенно значительным отличием гемоглобина от миоглобина является кривая насыщения кислородом, которая имеет сигмоидную форму. Мутантные гемоглобины человека. Гемоглобин С или ΗbC — один из мутантных гемоглобинов.Мутация — в этом виде гемоглобина в 6-м положении β-полипептидной цепи глутаминовая кислота замещена на лизин Hemoglobin C Эта мутантная форма снижает пластичность эритроцитов организма.
Гипотеза, объясняющая сохранение аллелей аномальных гемоглобинов: мутации в гене, контролирующем образование гемоглобина, в гетерозиготном состоянии вызывают повышенную, по сравнению с нормальным организмом, выживаемость при заражении малярией. Таким образом, существует положительный естественный отбор на сохранение данных вариантов гемоглобина в популяции.
13. Гемоглобин -- сложный белок, хромопротеид, дыхательный пигмент крови человека, позвоночных и некоторых беспозвоночных животных. Основная функция гемоглобина -- перенос кислорода от органов дыхания к тканям. Альфа-полипептидная цепь заканчивается комбинацией аминокислот валина-лейцина, а бета- полипептидная цепь -- комбинацией валина-гистидина-лейцина. Альфа- и бета-полипептидные цепи в гемоглобиновой молекуле не размещены линейно, это первичная структура. По причине существования интрамолекулярных сил полипептидные цепи скручиваются в форме типичной для белков альфа-геликсовой спирали (вторичная структура). Сама альфа-геликсовая спираль на каждую альфа- и бета-полипептидную цепь огибается пространственно, образуя сплетения овоидной формы (третичная структура). Отдельные части альфа-геликсовых спиралей полипептидных цепей отмечают латинскими буквами от А до Н. Все четыре третично изогнутые альфа- и бета-полипептидные цепи располагаются пространственно в определенном соотношении -- кватернерная структура. Они связаны между собой не настоящими химическими связями, а межмолекулярными силами. Кроме координационной связи, существующей между полипептидными цепями глобина, Fe++ атом гема располагает еще тремя координационными связями, две из которых соединены двумя азотными атомами порфиринового кольца, а третья, в среде с низким парциальным давлением кислорода, связана с одной молекулой воды. В среде с высоким парциальным давлением кислорода (артериальная кровь), третья координационная связь соединена с одной молекулой кислорода, причем получается соединение -- оксигемоглобин. Путем непрерывного превращения оксигемоглобина в редуцированный гемоглобин и обратно осуществляется перенос кислорода из легких к тканям. Значит, возможность гемоглобина связывать кислород зависит от того, заключаются ли в данном тетрамере другие молекулы кислорода. Если содержатся, то последующие молекулы кислорода присоединяются легче. Таким образом, для гемоглобина свойственна кинетика кооперативного связывания, благодаря которой он объединяет максимальное количество кислорода в легких и отдает максимальное количество кислорода при тех парциальных давлениях кислорода, которые имеют место в периферических тканях. Как нормальные, так и патологические типы гемоглобина различаются не по структуре протопорфиринового кольца, а по построению глобина. Разница может заключаться в изменении целых пар полипептидных цепей в гемоглобиновой молекуле. Такая возможность встречается у гемоглобинов H, F, Бартс, А2 и U. Вместо нормальной структуры гемоглобина А -- альфа-альфа/бета-бета (альфа 2/бета 2), гемоглобин Н имеет структуру бета-бета-бета-бета (бета 4), что значит, что обе альфа-полипептидные цепи замещены новыми -- бета-полипептидными цепями. У гемоглобинов F, Бартс и А2 появляются две новые цепи, обозначаемые гамма и дельта, а у гемоглобина U -- новая цепь, обозначаемая ипсилон. Структура HbF -- альфа-альфа/гамма-гамма (альфа 2/гамма 2), структура гемоглобина Бартс -- гамма-гамма-гамма-гамма (гамма 4), структура HbА2 -- альфа-альфа/дельта-дельта (альфа 2/гамма 2), структура гемоглобина U -- альфа-альфа/ипсилон-ипсилон (альфа 2/ипсилон 2). Патологические гемоглобины, которые состоят из четырех одинаковых полипептидных цепей, обозначают тетрамерами. Тетрамеры альфа и дельта до сих пор in vivo не наблюдались. Существует и другая возможность, которая встречается у большинства типов гемоглобина. Так, например, единственная разница между HbS и HbA состоит в том, что на 6-ом месте в бета полипептидной цепи вместо глутамина находится валин, единственная разница между HbI и HbA в том, что на 16-ом месте в альфа-полипептидной цепи лизин замещен аспарагиновой кислотой. Когда аномалия состоит в замещении аминокислоты в альфа-полипептидной цепи, то говорят об альфа-аномалии, когда состоит в бета-полипептидной цепи -- о бета-цепной аномалии, когда в гамма-полипептидной цепи -- о гамма-цепной аномалии (патологические варианты HbF), когда в дельта-цепи -- о дельта-цепной аномалии (патологические варианты HbA2).
14. Ферменты, или энзимы - это биологические катализаторы, образующиеся и функционирующие во всех живых организмах. Вещество, превращение которого катализирует фермент, получило название с у б с т р а т. Ферменты являются важнейшими компонентами клетки, они тесным образом связаны с разнообразными процессами жизнедеятельности, их роль как биокатализаторов биохимических превращений подобна роли катализаторов в других химических реакциях. Ферменты идеально приспособлены для работы в живой клетке, но после выделения из клетки они не теряют свои каталитические свойства. На этом основано практическое применение ферментов в химической, пищевой, легкой и фармацевтической промышленности. Принцип связывания ферментов с различными структурами клетки в настоящее время используют в биотехнологии. При этом ферменты прикрепляют (иммобилизуют) к поверхности какого-либо твердого носителя (целлюлоза и ее производные, полиакриламид, пористое стекло, нейлон, алюмосиликаты и др.), что позволяет не только сохранить их каталитические свойства, но и повысить стабильность. Такие ферменты получили название и м м о б и л и з о в а н н ы х. Химическая природа и строение ферментов. Активный центр ферментов
Установлено, что все известные в настоящее время ферменты представляют собой белки.
Ферменты обладают теми же физико-химическими свойствами, что и белки. Их молекулярная масса колеблется от десятков тысяч до нескольких миллионов. По форме молекул ферменты относятся к глобулярным белкам. Единицы активности ферментов
С т а н д а р т н а я е д и н и ц а - это такое количество фермента, которое при заданных условиях катализирует превращение одного микромоля субстрата за одну минуту. Катал (символ - кат - это такое количество фермента, которое способно превращать один моль субстрата за одну секунду (при оптимальных условиях).
К производным величинам, характеризующим активность ферментов, относят удельную каталитическую активность ферментов, концентрацию фермента в растворе и другие. Удельную каталитическую активность фермента или ферментативного препарата выражают в каталах на 1 кг белка (кат·кг-1) или чаще в мккат на 1мг белка. Концентрацию фермента в растворе выражают в каталах на 1 литр (кат·л-1) или в других, кратных этому значению величинах.
15. Номенклатура и классификаия ферментов,В настоящее время известно более 2400 ферментов. Каждый фермент, как правило, имеет две номенклатуры; одна из них рабочая (тривиальная), а другая - систематическая.
Рабочее наименоваие фермента составляют путем прибавления к корню слова латинского, греческого или химического названия субстрата, на который действует фермент, или к названию процесса, катализируемого данным ферментоа окончания “-аза”. Вещество, имеющее это окончание, принимают за фермент. Ферменты, действующие на крахмал (amylum), сахарозу, мочевину (urea), пептиды получили соответственно названия: амилаза, сахараза, уреаза,пептидаза; ферменты, катализирующие процессы гидролиза называют гидролазами, процессы окисления - оксидазами, перенос групп - трнсферазами и т.д. Для некоторых ферментов сохранены названия, неподчиняющиеся этому правилу: пепсин, трипсин, химотрипсин папин и др.
В принятой классификации все ферменты на основании катализируемых реакций разделены на шесть классов, расположенных в следующем порядке: 1) оксидоредуктазы, 2) трансферазы, 3) гидролазы, 4) лиазы, 5) изомеразы, 6) лигазы (синтетазы). Каждый класс подразделяется на подклассы, а каждый подкласс - на подподклассы. Индивидуальный фермент имеет кодовое число (шифр) со стоящими перед ним буквами КФ (англ. ЕС). Шифр каждого фермента содержит четыре числа, разделенных точками. Первое число указывает к какому из шести классов принадлежит данный фермент. Второе число обозначает подкласс. Третье число обозначает подподкласс, а четвертое - порядковый номер фермента в данном подподклассе. Например, фермент КФ.1.1.1.1 имеет рекомендуемое (рабочее) название алкогольдегидрогеназа, систематическое название алкоголь:НАД оксидоредуктаза. Этот фермент относится к классу оксидоредуктаз (1), действует на СН-ОН группу доноров (1.1), акцептором водорода служит НАД (1.1.1); четвертая цифра шифра - порядковый номер фермента в пределах подподкласса.
16. А к т и в н ы й ц е н т р. Известно, что размеры ферментов намного превышают размеры субстратов или функциональных групп, на которые они действуют. Это дало основание предполагать, что субстрат соединяется не со всей молекулой фермента, а с отдельным его участком, получившим название “а к т и в н ы й ц е н т р”, т.е. та область фермента, в которой происходит связывание и превращение субстрата. В молекуле фермента может присутствовать а л л о с т е р и ч е с к и й центр, представляющий собой участок молекулы, присоединение к которому определенных веществ приводит к изменению третичной структуры молекулы фермента. В результате этого происходит изменение конфигурации активного центра, сопровождающееся либо увеличением, либо снижением каталитической активности фермента. Это явление лежит в основе так называемой аллостерической регуляции активности ферментов. Ферменты, активность которых регулируется веществами, присоединяющимися к аллостерическому центру, получили название а л л о с т е р и ч е с к и х ферментов. Вещество, превращение которого катализирует фермент, получило название с у б с т р а т. Ферменты, или энзимы - это биологические катализаторы, образующиеся и функционирующие во всех живых организмах.
17. Важным фактором, от которого зависит скорость ферментативной реакции (равно каталитическая активность фермента) является температура, влияние которой показано на рис 4.5. Из рисунка видно, что с повышением температуры до определенной величины скорость реакции увеличивается. Это можно объяснить тем, что с повышением температуры движение молекул ускоряется и у молекул реагирующих веществ оказывается больше возможности столкнуться друг с другом. Это увеличивает вероятность того, что реакция между ними произойдет. Температура, обеспечивающая наибольшую скорость реакции, называется о п т и м а л ь н о й температурой. Каждый фермент имеет свою оптимальную температуру. В общем для ферментов животного происхождения она лежит между 37 и 40ОС, а растительного - между 40 и 50ОС. Однако есть и исключения: a-амилаза из проросшего зерна имеет оптимальную температуру при 60ОС, а каталаза - в пределах 0 - 10ОС. При повышении температуры сверх оптимальной скорость ферментативной реакции снижается, хотя частота столкновений молекул увеличивается. Происходит это вследствие денатурации, т.е. потери ферментом нативного состояния. При температуре выше 80ОС большинство ферментов полностью теряют свою каталитическую активность.
Снижение скорости ферментативной реакции при температурах, превышающих оптимальную, зависит от денатурации фермента. Поэтому важным показателем, характеризующим отношение фермента к температуре, является его термолабильность, т.е. скорость инактивации самого фермента при повышении температуры.
При низких температурах (0 ОС и ниже) каталитическая активность ферментов падает почти до нуля, но денатурация при этом не происходит. С повышением температуры их каталитическая активность вновь восстанавливается. Важным фактором, оказывающим большое влияние на скорость ферментативной реакции, является рН среды. Для каждого фермента существует оптимальное значение рН, т.е. такая величина рН, или зона рН, при которой катализируемая ферментом реакция протекает с наибольшей скоростью.
18. При низких концентрациях субстрата скорость реакции пропорциональна концентрации субстрата и по отношению к нему - это реакция первого порядка. С увеличением концентрации субстрата приращение скорости с каждым разом уменьшается и, наконец, она становится практически независимой от концентрации субстрата. В этих условиях реакция по отношению к субстрату - нулевого порядка, а весь фермент полностью насыщен субстратом и не может функционировать быстрее. Скорость ферментативной реакции при полном насыщении фермента субстратом называется м а к с и м а л ь н о й с к о р о с т ь ю.
Vmax · [S ]
V =
Кm + [S ]
Это окончательное уравнение, выведенное для односубстратной реакции, называют у р а в н е н и е м М и х а э л и с а - М е н т е н. Данное уравнение позволяет легко измерять максимальную скорость из экспериментальных данных, полученных при любой фиксированной концентрации фермента. График зависимости скорости ферментативной реакции от концентрации субстрата представляет собой гиперболу скорости реакции катализируемой ферментом, от 1/2 Vmax концентрации
субстрата………………………..
Влияние концентрации фермента на скорость ферментативной реакции
При высокой концентрации субстрата и при постоянстве других факторов скорость ферментативной реакции зависит от концентрации фермента.
19. И н г и б и т о р а м и называют вещества, вызывающие частичное или полное торможение химических реакций, включая и ферментативные. Различают о б р а т и м о е и н е о б р а т и м о е ингибирование фермента. При обратимом ингибировании активность фермента восстанавливается по мере удаления свободного ингибитора диализом или иным способом, т.е. при обратимом ингибировании существует равновесие между свободным ингибитором и ферментом. При необратимом ингибировании равновесие между свободным ингибитором и ферментом не устанавливается и активность фермента не удается восстановить диализом. Напротив, если ингибитор присутствует в избытке по сравнению с ферментом, то со временем наступает полное торможение активности фермента. Обратимое ингибирование ферментативных реакций бывает к о н к у р е н т н ы м и н е к о н к у р е н т н ы м.
Конкурентное ингибирование может быть вызвано веществами, похожими по своей структуре на субстрат. Эти вещества, конкурируя с субстратом, соединяются с активным центром фермента, но не подвергаются ферментативному превращению и новые продукты из них не образуются.
Неконкурентное ингибирование вызывают вещества, не имеющие структурного сходства с субстратом. Причем эти вещества обратимо присоединяются к ферменту не в активном центре, где обычно связывается субстрат, а совсем в другом месте и, следовательно, конкуренция между субстратом и ингибитором отсутствует. Связываясь с ферментом, неконкурентные ингибиторы вызывают изменение пространственной структуры активного центра, и, хотя присоединение субстрата к такому активному центру происходит, тем не менее катализ становится невозможным. Неконкурентные ингибиторы связываются обратимо как со свободным ферментом, так и с фермент-субстратным комплексом, образуя неактивные фермент-ингибитор (ЕJ) и (или) фермент-субстрат-ингибитор (ESJ).
20. А к т и в а т о р а м и называют вещества, увеличивающие каталитическую активность ферментов. Среди активаторов встречаются самые разнообразные вещества. Особенно часто роль активаторов ферментов выполняют ионы металлов: калия, кальция, магния, цинка, меди, железа, марганца, кобальта, а из анионов - хлора. Для проявления максимальной активности ферментов требуется определнная концентрация ионов-активаторов в среде.
Усиление активности ферментов под действием ионов металлов объясняется тем, что в одних случаях ионы металлов выполняют роль кофактора, в других - облегчают образование фермент-субстратного комплекса, в третьих - способствуют прсоединеию кофермента к апоферменту, в четвертых обеспечивают становление четвертичной структуры фермента или же действуют иными путями. Мощное действие на ферменты оказывают вещества, присоединяющиеся к ним в особых участках, удаленных от активного центра, называемых а л л о с т е р и ч е с к и м ц е н т р о м. Эти вещества влияют на активность фермента, вызывая обратимое изменение в структуре его активного центра. Называют такие вещества а л л о с т е р и ч е с к и м и э ф ф е к т о р а м и. Если эти эффекторы увеличивают сродство фермента к субстрату, то их называют а л л о с т е р и ч е с к и м и активаторами, если уменьшают - а л л о с т е р и ч е с к и м и ингибиторами. Ферменты, активность которых регулируется аллостерическими активаторами или ингибиторами называют а л л о с т е р и ч е с к и м и. Большинство аллостерических ферментов представляют собой белки-олигомеры.
Аллостерические ферменты имеют важное значение в регуляции ферментативных процессов в клетке. Это связано с тем, что эффекторами могут быть различные промежуточные продукты обмена веществ, называемые м е т а б о л и т а м и. В частности, установлено, что конечный, а иногда и промежуточный продукт многостадийного процесса распада или биосинтеза может служить аллостерическим ингибитором одной из первых его реакций.
21. Специфическую область применения ферментов в медицине составляет энзимодиагностика. Некоторые ферменты, проферменты и их субстраты в норме циркулируют в крови. В крови присутствуют также нефункциональные ферменты, концентрация которых в плазме на несколько порядков ниже, чем в тканях и органах. Появление этих ферментов в плазме в повышенных концентрациях, как правило, связано с патологией. Обычно заболевание того или иного органа, сопровождающееся разрушением его клеток, приводит к выходу из них ферментов в плазму крови, в которой и тестируется увеличение ферментативной активности. Так, повышение активности фруктозо-1,6-дифосфатальдолазы в сыворотке крови наблюдается при инфекционном гепатите, раке печени и инфаркте миокарда. Симптомом мышечной дистрофии является повышение в плазме крови активности креатинкиназы-важнейшего фермента, обеспечивающего образование необходимого для поддержания мышечной деятельности.Известно,что активность аспартатаминотрансферазы (АСТ) возрастает в сыворотке крови при болезнях сердца, а аланинаминотрансферазы (АЛТ)-при болезнях печени. Нередко в энзимодиагностике используют анализ соотношения активности нескольких ферментов. Так, при остром гепатите наблюдается повышенное соотношение активности амилаза/липаза; при злоупотреблении алкоголем и связанным с этим риском возникновения заболеваний сердца и печен наблюдается соотношение активности АСТ/АЛТ, превышающее.Широко используется в энзимодиагностике анализ множественных форм (изозимов) ферментов. Например, при инфаркте миокарда в крови резко возрастает активность быстромигрируюших при электрофорезе (анодных) форм лактатдегидрогеназы, а при инфекционном гепатите, напротив, возрастает активность катодных изозимов этого фермента. Кроме лактатдегидрогеназы, на практике используется анализ изоферментов кислой фосфатазы (при раке предстательной железы), щелочной фосфатазы (болезни костей, рахит и др.), креатинкиназы (болезни сердца). В тестировании раковых заболеваний используются изоферменты гексокиназы (по их соотношению удается даже определить стадию развития ракового поражения при гепатомах Морриса), пируваткиназы (опухоли печени, мозга и рабдосаркома), альдолазы (опухоли мозга и печени), фосфофруктокиназы (гепатомы), енолазы (рак мозга), лактатдегидрогеназы (опухоли желудка, щитовидной железы, почек, яичников, матки, молочной железы).Таким образом, области применения ферментов в медицине действительно безграничны. Рассмотренные примеры ясно показывают, какие замечательные и многообещающие перспективы уже сегодня открывает перед будущими врачами медицинская энзимология.
 |
22. Поиск высокоэффективных и нетоксичных методов лечения различных патологических состояний привел к изучению возможностей использования в биологии и медицине сильноточных электрических разрядов. Высокоэнергетические физико-химические факторы на основе наносекундных электрических разрядов (НСЭР), успешно применяемые в новейших технологиях, проявляют уникальные физико-химические свойства. Накопленные теоретические данные дают основания считать возможным применение этих факторов и для деструкции клеток, что обусловило изучение влияния их на системы организма. Во время генерации высоких импульсных напряжений и в сильноточных электрических разрядах наносекундных длительностей за счет высокой напряженности электрического поля в межэлектродном промежутке нарабатывается большое количество электронов, имеющих сравнительно высокую энергию. Эти электроны являются основными участниками плазмохимических реакций. Взаимодействие их с молекулами газов и биологических субстратов приводит к образованию химически активных частиц, таких как (О, О3, ОН–, Н2О2 и т. д., которые являются активными формами кислорода. Они первыми появляются в цепи реакций клеточного метаболизма и участвуют в процессах организма и клетки. Синтез АТФ. Анаэробный (без участия кислорода). Главная роль углеводов и липидов в клеточном метаболизме состоит в том, что их расщепление на более простые соединения обеспечивает синтез АТФ. Несомненно, что те же процессы протекали и в первых, самых примитивных клетках. Однако в атмосфере, лишенной кислорода, полное окисление углеводов и жиров до CO2 было невозможно. У этих примитивных клеток имелись все же механизмы, с помощью которых перестройка структуры молекулы глюкозы обеспечивала синтез небольших количеств АТФ. Речь идет о процессах, которые у микроорганизмов называют брожением. Лучше всего изучено сбраживание глюкозы до этилового спирта и CO2 у дрожжей.
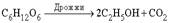
В ходе 11 последовательных реакций, необходимых для того, чтобы завершилось это превращение, образуется ряд промежуточных продуктов, представляющих собой эфиры фосфорной кислоты (фосфаты). Их фосфатная группа переносится на аденозиндифосфат (АДФ) с образованием АТФ. Чистый выход АТФ составляет 2 молекулы АТФ на каждую молекулу глюкозы, расщепленную в процессе брожения. Аналогичные процессы происходят во всех живых клетках; поскольку они поставляют необходимую для жизнедеятельности энергию, их иногда (не вполне корректно) называют анаэробным дыханием клеток. Аэробный (с использованием кислорода). С появлением в атмосфере кислорода, источником которого послужил, очевидно, фотосинтез растений, в ходе эволюции развился механизм, обеспечивающий полное окисление глюкозы до CO2 и воды, – аэробный процесс, в котором чистый выход АТФ составляет 38 молекул АТФ на каждую окисленную молекулу глюкозы. Этот процесс потребления клетками кислорода для образования богатых энергией соединений известен как клеточное дыхание (аэробное). В отличие от анаэробного процесса, осуществляемого ферментами цитоплазмы, окислительные процессы протекают в митохондриях. В митохондриях пировиноградная кислота – промежуточный продукт, образовавшийся в анаэробной фазе – окисляется до СО2 в шести последовательных реакциях, в каждой из которых пара электронов переносится на общий акцептор – кофермент никотинамидадениндинуклеотид (НАД). Эту последовательность реакций называют циклом трикарбоновых кислот, циклом лимонной кислоты или циклом Кребса. Из каждой молекулы глюкозы образуется 2 молекулы пировиноградной кислоты; 12 пар электронов отщепляется от молекулы глюкозы в ходе ее окисления, описываемого уравнением:

23. Обмен веществ (или метаболизм) состоит из двух процессов: ассимиляции (или анаболизма) - синтеза характерных для организма соединений и диссимиляции (или катаболизма) - распада веществ и выведения продуктов этого распада из организма. Совокупность процессов ассимиляции (синтеза) и диссимиляции (распада) составляет основу жизни. Различают общий (внешний) обмен веществ, учитывающий поступления в организм веществ и их выделение, и промежуточный обмен веществ, который охватывает превращения этих веществ в организме.
Первым этапом обмена веществ является превращение поступивших веществ пищи в желудочно-кишечном тракте. Превращение начинается в ротовой полости, однако основные пищеварительные процессы протекают в тонком кишечнике.
24. Окисление биологическое,совокупность реакций окисления, протекающих во всех живых клетках. Основная функция О. б. — обеспечение организма энергией в доступной для использования форме. Реакции О. б. в клетках катализируют ферменты, объединяемые в класс оксидоредуктаз. О. б. в клетках связано с передачей т. н. восстанавливающих эквивалентов (ВЭ) — атомов водорода или электронов — от одного соединения — донора, к другому — акцептору. У аэробов — большинства животных, растений и многих микроорганизмов — конечным акцептором ВЭ служит кислород. Поставщиками ВЭ могут быть как органические, так и неорганические вещества (см. таблицу). Основной путь использования энергии, освобождающейся при О. б., — накопление её в молекулах аденозинтрифосфорной кислоты (АТФ) и др. макроэргических соединений.О. б., сопровождающееся синтезом АТФ из аденозиндифосфорной кислоты (АДФ) и неорганического фосфата, происходит при гликолизе, окислении a-кетоглутаровой кислоты и при переносе ВЭ в цепи окислительных (дыхательных) ферментов, обычно называют окислительным фосфорилированием (см. схему). В процессе дыхания углеводы, жиры и белки подвергаются многоступенчатому окислению, которое приводит к восстановлению основных поставщиков ВЭ для дыхательных флавинов, никотинамидадениндинуклеотида (НАД), никотинамидадениндинуклеотидфосфата (НАДФ) и липоевой кислоты. Восстановление этих соединений в значительной мере осуществляется в трикарбоновых кислот цикле, которым завершаются основные пути окислительного расщепления углеводов (оно начинается с гликолиза), жиров и аминокислот. Помимо цикла трикарбоновых кислот, некоторое количество восстановленных коферментов — ФАД (флавинадениндинуклеотида) и НАД — образуется при окислении жирных кислот, а также при окислительном дезаминировании глутаминовой кислоты (НАД) и в пентозофосфатном цикле (восстановленный НАДФ). Одновременно развивалось направление, где в основу классификации ферментов был положен тип реакции, подвергающейся каталитическому воздейсвию. Наряду с ферментами, ускоряющими реакции гидролиза (гидролазы), были изучены ферменты, участвующие в реакциях переноса атомов и атомных групп (феразы), в изомеризации (изомеразы), расщеплении (лиазы), различных синтезах (синтетазы) и т. д. Это направление в классификации ферментов оказалось наибо-лее плодотворным, так как объединяло ферменты в группы не по надуманным, формальным признакам, а по типу важнейших биохимических процессов, лежащих в основе жизнедеятельности любого организма. По этому принципу все ферменты делят на 6 классов.1. Оксидоредуктазы — ускоряют реакции окисления — восстановления. 2. Трансферазы — ускоряют реакции переноса функциональных групп и молекулярных остатков. 3. Гидролазы — ускоряют реакции гидролитического распада. 4. Лиазы — ускоряют негидролитическое отщепление от субстратов определенных групп атомов с образованием двойной связи (или присоединяют группы атомов по двойной связи). 5. Изомеразы — ускоряют пространственные или структурные перестройки в пределах одной молекулы. 6. Лигазы — ускоряют реакции синтеза, сопряженные с распадом богатых энергией связей.
25. В переносе электронов от субстратов к молекулярному кислороду принимают участие: пиридинзависимые дегидрогеназы, коферментами для которых служат либо НАД либо НАДФ. флавинзависимые дегидрогеназы, роль простетической группы играют флавинадениндинуклеотид и флавинаденинмононуклеотид (ФАД, ФМН) и др. К числу пиридинзависимых дегидрогеназ относятся свыше 150 ферментов, которые катализируют восстановление НАД и НАДФ различными органическими субстратами. Эти реакции можно изобразить так: субстрат-Н2+НАД(НАДФ)субстрат (окисл.)+НАДН2(НАДФН2). Кофермент НАД находится в митохондриях, НАДФ - в цитоплазме. Восстановленные пиридиннуклеотиды НАДН и НАДФН не могут реагировать с кислородом, их электроны должны пройти через промежуточные акцепторы системы переноса электронов (цитохромы) прежде чем они смогут быть переданы на кислород. Фермент, непосредственно переносящий электрон на кислород - оксидаза, а участвующий в отнятии электрона от субстрата и переносе на акцептор -дегидрогеназа. Следующим акцептором атомов водорода является группа флавиновых ферментов, которые осуществляют перенос водородов (протонов и электронов) от восстановленных НАД и НАДФ. НАДН2+флавиновый фермент (ФАД)НАД+ФАДН2. Все дегидрогеназы нуждаются в коферменте для переноса восстановительных эквивалентов. Наиболее широко распространены коферменты динуклеотидного типа, в котором два нуклеозид-5'-монофосфата соединены фосфоангидридной связью. ЛДГ и многие другие дегидрогеназы нуждаются в никотинамидадениндинуклеотиде, сокращенно НАД+ (NAD+) (1). Обе нуклеотидных группы НАД+ построены из 5'-АМФ и нуклеотида, содержащего в качестве основания амид никотиновой кислоты (см. с. 354). Структурно (но не функционально) похожим коферментом является НАДФ+ (NADP+), в котором 2'-ОН-группы рибозы аденина дополнительно связаны с фосфатом. Несмотря на близкое структурное родство НАД+ и НАДФ+ осуществляют различные функции в обмене веществ. В окислительно-восстановительных реакциях пиридиннуклеотидного кофермента участвует только никотинамидное кольцо. Никотинамид является амидом пиридин-3-карбоновой (никотиновой) кислоты. В окисленной форме кольцо имеет ароматический характер и несет






