26. Ала-Гис-Про-Сер-Цис ∑q=+ ИЭТ >7 при pH=3(+) при pH=10(-)
0 + 0 0 0 0+000 к катоду 00000 к аноду
27. Нуклеопротеины – сложные белки, которые в качестве простетической группы содержат нуклеиновые кислоты: а) ДНК и б) РНК.
Простетическая группа ДНК – белок дезоксирибонуклеопротиен. Структурная единица хроматина – нуклеосома – обеспечивает ультракомпактность упаковки ДНК. Белковая часть представлена гистонами-это небольшие белки с высоким содержанием лизина и аргинина,их делят на пять типов: Н1, Н2А, Н2В, Н3 и Н4. Нуклеосома состоит из четырех пар молекул гистонов – 2 Н2А, 2 Н2В, 2Н3, 2Н4, обвитые снаружи суперспиралью ДНК. Между нуклеосомами находиться участок ДНК – линкерный участок, которая связана лишь с одной молекулой белка Н1.
28. Гемоглобин А состоит из двух одинаковых субъединиц a (по 141 аминокислотному остатку) и двух идентичных единиц b (по 146 остатков). Четыре протомера располагаются в виде тетраэдра.Молекула гемоглобина, таким образом содержит 4 гема. Каждый гемм содержит атом Fe+2 , к которому присоединяется одна молекула кислорода. Молекула гемоглобина существует в двух формах: «напряженной» (Т) и «релаксированной» (R). Первая характерна для дезоксигемоглобина, вторая - для оксигемоглобина.Т- форма более жесткая, в отличие от R-формы она имеет 8 связей:1)Четыре солевых мостика между a-протомерами. 2)Два солевых мостика между разными протомерами: между a и b¢ и между a¢ и b. 3)По одному солевому мостику внутри каждого b-протомера.При присоединении кислорода солевые мостики разрушаются, и Т-форма переходит в более компактную форму.
29.Гемоглобинопатии. Это состояния, связанные с изменением одного из трех свойств нормального гемоглобина- растворимость, сродство к кислороду или устойчивость к денатурации.
Гемоглобины с измененной растворимостью.
Наиболее часто встречающийся аномальный гемоглобин - серповидно-клеточный HbS, т.к. в b-цепях гемоглобина остаток глу- в положении 6 заменен на остаток валина,наблюдается серповидно-клеточная анемия, а гетерозиготы имеют только некоторые признаки заболевания, но обычно без клинических проявлений. У больных форма эритроцитов изменяется на форму серпа при превращении окси-HbS в дезокси-HbS в условиях низкого pО2.. Серповидные эритроциты обладают повышенной механической ломкостью и имеют более короткую по сравнению с нормой продолжительность жизни.
Дефекты, обусловленные нарушением синтеза цепей гемоглобина.
Нарушение синтеза какой либо цепи гемоглобина приводит к возникновению талассемий. При a-талассемии нарушается синтез a - цепи. Это приводит к уменьшению образования всех физиологических видов гемоглобина. b-талассемия вызвана нарушением синтеза b-цепей. При всех видах талассемииизменяется продукция эритроидных клеток в костном мозге и насыщение эритроцитов гемоглобином.
Гемоглобины с измененным сродством к кислороду.
Метгемоглобин отличается от гемоглобина наличием трехвалентного железа. Метгемоглобин составляет 0,1-0,3% от общего гемоглобина. Восстановление метгемоглобина в гемоглобин происходит при участии НАДФ. Метгемоглобинемия развивается при:
-отравлении нитратами,-нитрозосоединениями,-анилином,-бромидами.
30. Ферменты- биологически активные в-ва белковой природы,которые ускоряют биохим.реакции.
Все ферменты - глобулярные белки, состоящие из одной или нескольких ППЦ в третичной структуре. Имеют активный центр (АЦ) - это участок фермента,который находится в гидрофобном углублении,образован боковыми радикалами аминокислотных остатков, которые на уровне третичной структуры формируют центр взаимодействующий с S(в-во,с которым взаимодействует фермент).
Боковые радикалы А.К формирующие АЦ могут находиться в ППЦ на удаленном расстоянии. На уровне 3 структуры они сближаются.
АЦ состоит из 2-х участков:1)для прикрепления S в АЦ- Якорный
2)для химического превращения S- каталитическая
АЦ фермента и S должны друг другу подходить:-по форме(геометрически)
- по заряду(электростатически)
Некоторые Е имеют аллостерический центр, они катализируют необратимые реакции.
AЛЦ и АЦ должны быть удалены др. от др. т. е. Е должен состоять более чем из 1 субъединицы. 1)АЦ в одной субъед. к нему S присоед-ся- каталитическая
2)АЛЦ в др.субъед. К нему присоединяются ингибиторы и активаторы-регуляторная
Некоторые Е могут иметь ко-факторы-в-ва небелковой природы с мал. молекуллярной массой,которые необходимы для проведения ферментативной активности.
Ко-фактороми могут быть ионны Ме. Если Ме прочно связывается с Е,участвует в хим. реакции- Метаферменты. Если непрочно связан с Е,не участвует в реакции-Активируемый Ме.
31.Классификация. Номенклатура.
Название: 1. субстрат 2. тип катализируемой реакции 3.окончание «аза»
Классы ферментов:
- оксидоредуктазы (ОВР)(-2Н,+2Н,е,О2,НАД+,Фад)
пример:
- трансферазы (перенос отдельных групп атомов кроме Н от одной молекулы к другой)
Пример:
-гидролазы (Межмолекулярный перенос, гидролиз пептидных, эфирных связей с участием воды - ферменты ЖКТ)
Пример:
-лиазы (отщепление групп от субстрата без воды с образованием двойных связей, или присоединение групп по = связи)
Пример:
5. изомеразы (Внутримолекулярный перенос)
пример:
-лигазы или синтетазы (образование сложных в-в из простых с использованием энергии АТФ или витамина Н.
Пример:
32. Изоферменты-это различные по аминокислотной последовательности изоформы или изотипы одного и того же фермента, существующие в одном организме, но, как правило, в разных его клетках, тканях или органах.
Лактатдегидрогеназа (ЛДГ) – фермент, обратимо катализирующий окисление лактата в пируват. Известны 5 изоформ ЛДГ. Каждый из изоферментов ЛДГ является тетрамером, образованным субъединицами двух типов - Н и М.
Из них большее диагностическое значение имеют ЛДГ1и ЛДГ5. ЛДГ1участвует в окислении лактата в пируват. ЛДГ5напротив, способствует превращению пирувата в лактат. Основная роль общей ЛДГ заключается в выявлении тканевого повреждения.
В норме основным источником изоферментов ЛДГ в сыворотке являются разрушающиеся клетки крови. При повреждении тканей ЛДГ поступает из клеток тканей в кровь. Определение изоферментов имеет важное диагностическое значение, так как повышение концентрации отдельных изоферментов характеризует повреждение конкретных органов.
33. Ферменты- биологически активные в-ва белковой природы,которые ускоряют биохим.реакции.
Все ферменты - глобулярные белки, состоящие из одной или нескольких ППЦ в третичной структуре. Имеют активный центр (АЦ) - это участок фермента,который находится в гидрофобном углублении,образован боковыми радикалами аминокислотных остатков, которые на уровне третичной структуры формируют центр взаимодействующий с S(в-во,с которым взаимодействует фермент).
Боковые радикалы А.К формирующие АЦ могут находиться в ППЦ на удаленном расстоянии. На уровне 3 структуры они сближаются.
АЦ состоит из 2-х участков:1)для прикрепления S в АЦ- Якорный
2)для химического превращения S- каталитическая
АЦ фермента и S должны друг другу подходить:-по форме(геометрически)
- по заряду(электростатически)
Некоторые Е имеют аллостерический центр, они катализируют необратимые реакции.
AЛЦ и АЦ должны быть удалены др. от др. т. е. Е должен состоять более чем из 1 субъединицы. 1)АЦ в одной субъед. к нему S присоед-ся- каталитическая
2)АЛЦ в др.субъед. К нему присоединяются ингибиторы и активаторы-регуляторная
Некоторые Е могут иметь ко-факторы-в-ва небелковой природы с мал. молекуллярной массой,которые необходимы для проведения ферментативной активности.
Ко-фактороми могут быть ионны Ме. Если Ме прочно связывается с Е,участвует в хим. реакции- Метаферменты. Если непрочно связан с Е,не участвует в реакции-Активируемый Ме.
Для проявления каталитической активности большинству ферментов необходимо наличие кофермента. Исключение составляют гидролитические ферменты выполняющие свою функцию в отсутствие кофермента. Кофермент, локализуясь в каталитическом участке активного центра, принимает непосредственное участие в химической реакции.
Кофермент может быть связан с белковой частью молекулы ковалентными и нековалентными связями настолько прочно, что не диссоциирует от белковой молекулы.
К коферментам относят производные витаминов.
Ферменты содержащие коферменты- холоферменты,а белковая часть- апофермент.
Реакции катализируемые дегидрогиназой в качестве фермента используют НАД+.
Две половина молекулы НАД объединены между собой остатками фосфорной кислоты.
Рабочей частью кофермента является никотинамид.

никотинамид
=============>
34.Зависимость скорости ферментативной реакции от концентрации S.
В т. А-скорость прямолинейна (S),т.к. АЦ Е на заняты S. В т.В- ½ мол.Е насыщена S и U=1/2 max.
(S),при которой Uф.р=1/2 max -Константа Михаэлиса(показывает срадство Е к S). Чем ↓срадство,тем больше срадство. В т.С все молекулы Е связаны с S и дальнейшее увеличение (S) не приведет у увеличению U.

Уравнение Михаэлиса-Ментен:

35.
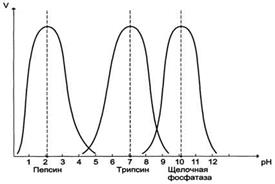 Для каждого фермента существует оптимум pH
Для каждого фермента существует оптимум pH
Отклонение pH от оптимума влияет на ионное состояние Е или S,что ведет к изменению конформации и снижению сродства Е к S.
При очень высоких или низких значениях pH происходит денатурация Е.(пепсин-трипсин-щелочная фосфотаза).
36.Единица фермента- такое количество фермента, которое катализирует превращение 1 ммоль вещества за 1 мин.[1 Ед]. У дельная активность фермента — число единиц фермента на массу белка в мг.
Задача: рассчитайте единицы ферментативной активности фермента, если за 20 сек 5 мг фермента катализирует 100 мкмоль субстрата.
Ед=100/1/3=300 Уд= 300/5=60
37.
Е +S<======>ЕS-------> E S* ---->EP---->E+P
Фкрмент подходит ↑Образуется фермент-субстра- В результате Т.к продукт некомпле- Фермент и продукт
к своему S,который ↑тный комплекс,он нестабиль- взаимодействия ментарен АЦ S,то он
строго располагается↑ный,т.е.может распадаться на АЦ и S происходит выходит из него. Кол-во
по отношению к АЦ ↑ Е и S. Перераспределение и св-ва Е не меняется.
В результате-----------↑ связей,они стано-
вятся строго компле-
ментарны,комплекс
стал стабильным,
образуется продукт.
1.Теория Фишера подразумевает жёсткое соответствие между активным центром и субстратом («ключ» - «замок»), т.е. каталитический центр заранее подготовлен к форме субстрата.

2. Теория Кошланда (теория индуцированного соответствия «Рука-перчатка»). Подразумевает гибкость каталитического центра, т.е. каталитически активная конформация фермента и субстрата может возникать в момент присоединения субстрата, до него геометрическое соответствие АЦ и субстрата приблизительное.

38. Рассчитайте ед. ферментативной активности, если за 10 сек 1 мг фермента катализирует 50 мкМоль субстрата.
Ед=50/1/6=300 Уд=300/1=300
39. АЦ- это участок фермента,который находится в гидрофобном углублении,образован боковыми радикалами аминокислотных остатков, которые на уровне третичной структуры формируют центр взаимодействующий с S(в-во,с которым взаимодействует фермент).
Боковые радикалы А.К формирующие АЦ могут находиться в ППЦ на удаленном расстоянии. На уровне 3 структуры они сближаются.
АЦ состоит из 2-х участков:1)для прикрепления S в АЦ- Якорный
2)для химического превращения S- каталитическая
АЦ фермента и S должны друг другу подходить:-по форме(геометрически)
- по заряду(электростатически)
40. Рассчитайте ед. ферментативной активности, если за 20 сек 2 мг фермента катализирует 50 мкМоль субстрата.
Уд=50:1/3/2=75
41. Ко-факторы- в-ва небелковой природы с мал. молекуллярной массой,которые необходимы для проведения ферментативной активности.
Ко-фактороми могут быть ионны Ме. Если Ме прочно связывается с Е,участвует в хим. реакции- Метаферменты. Если непрочно связан с Е,не участвует в реакции-Активируемый Ме.
Для проявления каталитической активности большинству ферментов необходимо наличие кофермента. Исключение составляют гидролитические ферменты выполняющие свою функцию в отсутствие кофермента. Кофермент, локализуясь в каталитическом участке активного центра, принимает непосредственное участие в химической реакции.
Кофермент может быть связан с белковой частью молекулы ковалентными и нековалентными связями настолько прочно, что не диссоциирует от белковой молекулы.
К коферментам относят производные витаминов.
42. Регуляция активности ферментов. Выделяют 4 типа регуляции:
1)Частичный протеолиз (необратимое)- Отщепление части ППЦ.В результате чего меняется конформация фермента и он становится активный.
2)Ассоциация.Диссоциация протомеров.
Ассоциация-есть ферменты в невктивной форме находятся в виде комплексов(состояние из нескольких протомеров).При увеличении в клетки регулирующих мол.они присоединяются к протомерам.
Изменяется конформация фермента и он становится АКТИВНЫМ.
Диссоциация-класс ферментов,которые образуют эффирные связи между фосфорной группой и гидрокси группой а.к.остатка серина и треонина.
В неактивной форме состоит их 4-х субъединиц:2регул и 2 катал.
Присоединение АМФ к регулирующей субъединицам ведет к изменению конформации и высвобождению 2 катал.,разрушается связь между субъединицами,они становятся активные.
3)Фосфолирирование и Дефосфолирорование
Фосфол-е осуществляется-протеинкиназой
Дефосфол-е-протеинфосфотазой

4)Аллостерическая регул-я.(обратимая)
Во многих строго биосинтетических реакциях основным типом регуляции скорости многоступенчатого ферментативного процесса является ингибирование по принципу обратной связи. Это означает, что конечный продукт биосинтетической цепи подавляет активность фермента, катализирующего первую стадию синтеза, которая является ключевой для данной цепи реакции. Поскольку конечный продукт структурно отличается от субстрата, он связывается с аллостери-ческим (некаталитическим) центром молекулы фермента, вызывая ингиби-рование всей цепи синтетической реакции.
 а- активный комплекс; б - неактивный комплекс; 1 - активный центр; 2 - аллостерический центр; 3 - субстрат; 4 - положительный эффектор; 5 - отрицательный эффектор.
а- активный комплекс; б - неактивный комплекс; 1 - активный центр; 2 - аллостерический центр; 3 - субстрат; 4 - положительный эффектор; 5 - отрицательный эффектор.
43.Ингибирование.
Обратимое-образует слабые нековалентные связи с Е.
Конкурентное:
-ингибитор-аналог S,т.е. Связывается с АЦ и препятствует образованиюфермент-субстратного комплекса и не превращается в прдукт.
-при увеличении (S) S вытесняет I из АЦ.
-конкур.I повышает константу Михаэлися и снижает срадство Е к S,не влияет на Umax.
Конкурентное и неконкурентное ингибирование легко различить по графикам
Лайнуивера-Берка.
Графики представляют собой зависимость обратной скорости (1/Vo) от обратной
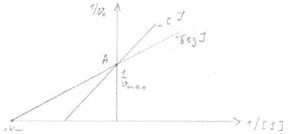 |
концентрации субстрата (1/[S]).

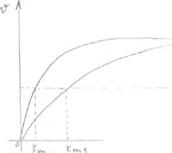 При бесконечно большой [S] скорость ферментативной реакции не меняется (т.А), т.к. при этом происходит полное вытеснение ингибитора из АЦ большими концентрациями субстрата, Km при этом увеличивается (т.к. она зависит от [S], а она здесь увеличивается).
При бесконечно большой [S] скорость ферментативной реакции не меняется (т.А), т.к. при этом происходит полное вытеснение ингибитора из АЦ большими концентрациями субстрата, Km при этом увеличивается (т.к. она зависит от [S], а она здесь увеличивается).






