Билет№2
1) Энзимопатология – это изучение различных нарушений активности ферментов при развитии тех или иных заболеваний с целью наиболее глубокого понимания сущности соответствующего заболевание то-есть изучает каковы ферментативные основы того или иного заболевания. Почти все заболевания имеют в своей основе нарушение активности ферментов, то-есть это энзимопатии. В зависимости от причины различают основные виды энзимопатий:
а) врожденные (отсутствие или малая активность фермента);
б) токсические (снижение активности ферментов под действием каких-то ядов);
в) алиментарные (следствие нарушения питания);
г) регуляторные (в следствии нарушения регуляции) и т.д. Например при фенилкетонурии, сопровождающийся расстройством психической деятельности, клетки печени способны синтезировать фенилаланингидроксилазу – фермент, катализирующий переход фенилаланина в тирозин. Развитие алкаптонурии сопровождается повышением экскреции с мочой, до 0,5 г. в сутки гомогентизиновой кислоты, отложением пигмента в тканях, потемнением носа, ушей, склер. Это связывают с врожденным отсутствием в почках и печени оксидазы гомогентизиновой кислоты. При гипераммониемии (накопление ионов аммония в крови) отмечается недостаточность любого из ферментов цикла образования мочевины. При развитии г алактоземии отмечается отсутствие уредилтрансферазы (происходит накопление галактозы-1-фосфата).
2) Энзимодиагностика – изучение активности ферментов для диагностики заболеваний. В ряде случаев в крови, моче, других биологических жидкостях и тканях отмечают наличие органоспецифических ферментов, хотя, правильнее сказать, что абсолютной органоспецифичности нет, есть большее количество фермента. Например, для печени органоспецифичен фермент глюкоза – 6 – фосфатаза, для поджелудочной железы – трипсин, химотрипсин и т.д., для костной ткани – щелочная фосфатаза. Часто для диагностики важны не только органоспецифические ферменты, но и те, количество которых при определенных заболеваниях значительно возрастает (например, аминотрансферазы переносят аминогруппы, при ИБС поражениях печени их активность резко возрастает). Определение активности этих ферментов используют и для дифференциальной диагностики. Например, при инфаркте миокарда их активность увеличивается, а при стенокардии не увеличивается.
Некоторые заболевания характеризуются изменением изоферментного спектра. Используют метод электрофореза. Различные ткани содержат различные изоферменты. Например креатинкиназа – катализирует реакцию между креатином и АТФ – имеет две пептидных цепи (В и М). Могут быть три комбинации (ВВ, ВМ, ММ). ВВ встречаются в мозге, ММ – в скелетных мышцах, ВМ – только в сердечной мышце - миокарде). Допустим ВМ обнаружили в крови (в норме - нет), ясно что имеет место поражение миокарда.
Вообще же энзимодиагностика позволяет:
а) Проводить диагностику какой-либо патологии.
б) Проводить дифференциальную диагностику.
в) Уточнять место локализации патологического процесса.
г) Определять степень тяжести патологического процесса.
д) Строить прогноз развития заболевания.
е) Способствует правильному и адекватному назначению лекарственных веществ.
3) Энзимотерапия – использование ферментов в лечебной практике. Особенно часто используют литические ферменты, которые наносят на рану, ожоговую поверхность, вводят в плевральную полость и т.д. Заместительная терапия (например, при недостатке вводят пепсин, противовоспалительная терапия и т.д.
2. Синтез пуриновых нуклеотидов. Для синтеза пуриновых нуклеотидов могут использоваться готовые пуриновые азотистые основания, либо пуриновые нуклеозиды, либо идет синтез из предшественников. В первом случае используются два фермента: а) аденинфосфорибозилтрансфераза (переносит фосфорибозу с ФРПФ на аденин с образованием АМФ). б) гипоксантин-гуанинфосфорибозилтрансфераза (переносит фосфорибозил с ФРПФ на гипоксантин и гуанин с образованием инозинмонофосфата и ГМФ соответственно).
Причем второй фермент работает более активно. А при генетическом дефекте (его отсутствии) развивается синдром Леш-Нихана, возможно развитие мочекаменной болезни, подагры. Если же для синтеза пуриновых нуклеотидов используется готовый нуклеозид, то, как и в случае пиримидиновых нуклеотидов работают киназы (например, аденозинкиназа), катализирующие присоединение к нуклеозиду остатка фосфорной кислоты. Процесс биосинтеза пуриновых оснований из предшественников несколько отличается от синтеза примидиновых оснований. Если, в случае синтеза пиримидиновых нуклеотидов, 5-фосфорибозил – 1- пирофосфат присоединялся на одной из последних стадий образования уридин – 5`-монофосфата – первого продукта нуклеотидной природы, образующегося в ходе пиримидинового пути, то при синтезе первого продукта нуклеотидной природы пуринового пути – инозин - 5`-монофосфата (УМФ) – 5 – фосфорибозил – 1 – пирофосфат принимает участие уже в первой реакции:





 Н2О3РОСН2 О
Н2О3РОСН2 О 


 Н2О3РОСН2 NH2
Н2О3РОСН2 NH2

 О О О О
О О О О


 Н Н || || (1) Н Н
Н Н || || (1) Н Н
 Н Н Р – О – Р – ОН (2) H H
Н Н Р – О – Р – ОН (2) H H
| |
ОН ОН OH OH OH OH
5 – фосфорибозил – 1 – пирофосфат 5-фосфорибозил – 1 – амин
(1) – +глютамин; -глютамат; - ПФ
(2) – амидофосфорибозилтрансфераза.
+Затем 5-фосфорибозил – 1 – амин вступает в реакцию с глицином.




 Н2О3РОСН2 NH3
Н2О3РОСН2 NH3 

 (+) Н2О3РОСН2 NH–C–CH2
(+) Н2О3РОСН2 NH–C–CH2


 О АТФ АДФ+Фк || |
О АТФ АДФ+Фк || |



 Н Н +глицин –Н2О Н Н O NH2
Н Н +глицин –Н2О Н Н O NH2
 Н Н H H
Н Н H H
ОН ОН OH OH
5-фосфорибозил – 1 – амин рибонуклеотид
глицинамида
(глицинамидрибозилфосфат)
 … УМФ
… УМФ
Далее идет еще 7 реакций до образования инозин – 5 – монофосфата:
СО2, аспартат, глицин, 2 глютамина, 2 тетрогидрофолата
5 – фосфорибозил –1 – пирофосфат
 |
4 АТФ
 |
10 ферментов
4 АДФ
+ Из СО2
 4 Н3РО4
4 Н3РО4
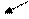 О Из глицина
О Из глицина




 Из аспартата ||
Из аспартата ||
 HN N
HN N










 Из FH4 Из FH4
Из FH4 Из FH4



 N N
N N
 |
|
 Рибоза - ФК
Рибоза - ФК
Из глютамина Из 5 – фосфорибозил – 1 – пирофосфата
Далее, из инозин –5 – фосфата возможен синтез АМФ и ГМФ:
O O NH



 || +НАД НАДН2 || - H2O |
|| +НАД НАДН2 || - H2O |





 HN N +НО2 HN N +ионMg HN N
HN N +НО2 HN N +ионMg HN N




 ГТФ ГДФ + Н3РО4
ГТФ ГДФ + Н3РО4

 ДГ Аспартат
ДГ Аспартат

 || (УМФ - ДГ)
|| (УМФ - ДГ)


 O NH N N N Фумарат N N
O NH N N N Фумарат N N
Рибоза Рибоза Рибоза
| | |
ФК ФК ФК
(Ксантозин-5-монофосфат) (Инозин-5-монофосфат) (АМФ)

 2АТФ Глютамин АТФ Нуклеотид-
2АТФ Глютамин АТФ Нуклеотид-


 киназа
киназа
2АДФ
+ Глютамат АДФ
 2Н3РО3 (АДФ)
2Н3РО3 (АДФ)
О АТФ Нуклеотид-

 || Киназа
|| Киназа
HN N


 АДФ
АДФ
 (АТФ)
(АТФ)
H2N
 N N
N N
Рибоза
|

 ФК АТФ АДФ АТФ АДФ
ФК АТФ АДФ АТФ АДФ

 (ГМФ) Нуклеотидкиназа (ГДФ) Нуклеотидкиназа (ГТФ)
(ГМФ) Нуклеотидкиназа (ГДФ) Нуклеотидкиназа (ГТФ)
Образование дезокси – пуриновых нуклеотидов идет так же, как и образование дезокси – пиримидиновых нуклеотидов: на уровне дифосфатов участвуют 3 белковых фактора (рибонуклеотидредуктаза – активируется восстановленной формой тиоредоксина, который в свою очередь восстанавливается с помощью тиоредоксинредуктазы). Биосинтез пуриновых нуклеотидов тоже регулируется по типу обратной связи (как и биосинтез пиримидиновых нуклеотидов). Так, накопление АМФ и ГМФ, действует ингибирующе на амидофосфорибозилтрансферазу, фермент, который катализирует первую реакцию синтеза пуриновых оснований (реакцию переноса аминогруппы с глютамина на 5-фосфорибозил – 1- пирофосфат). Второй регуляторный механизм действует на одной из более поздних стадий синтеза пуриновых нуклеотидов. Так, избыток ГМФ в клетке вызывает аллостерическое ингибирование процесса образования ГМФ из инозиновой кислоты, но при этом не влияет на синтез АМФ из инозин – 5 – монофосфата. Избыток же АМФ ингибирует синтез АМФ из инозин – 5 – монофосфата, но не влияет на синтез ГМФ.
3.Небелковые азотистые вещества Их иногда называют остаточный азот (в норме его содержится 15-25 ммоль/л). Величина остаточного азота говорит об общем уровне обмена, а, главное, о функции почек. Мочевина составляет ≈ 50% остаточного азота. Кроме мочевины входит АК, билирубин, креатин, мочевая кислота, соли аммония, нуклеотиды, низкомолекулярные пептиды.
Низкомолекулярные пептиды крови- кинины. Основные кинины – брадикинин, лизилбрадикинин, метиониллизилбрадикинин, лейкокинины, Т-кинины и др.
Биологическая роль кининов.
1)Расширяет просвет сосудов, понижая АД.
2)Резко увеличивает проницаемость капилляров.
3)Регулируют тонус гладкой мускулатуры ЖКТ и бронхов (вызывают бронхоконстрикцию, являясь одним из факторов развития бронхиальной астмы).
4)Стимулируют миграцию лейкоцитов и увеличивают их фагоцитирующии свойства.
5)Участвуют в передаче нервных импульсов.
6)Стимулируют синтез простогландинов.
7)Обладают инсулиноподобным действием.
Кинины образуются из кининогенов под действием фермента каллекреина путём частичного протеолиза. Кроме этого каллекреин активирует плазминоген, стимулирует образование агиотензина II и системы комплемента, участвует в обмене ЛПНП. Каллекреин может синтезироваться и в тканях (кишечнике, половых железах, почках, слюнных железах и т.д.). Говорят о каллекреин-кининовой системе.






