Полимерлердің еріткіштерде ісінуі мен еруі функционал топтар мен атомдардың әрекеттесуіне байланысты. Еру (ісіну) процесі компоненттер бір бірімен араласқанда ғана жүреді, яғни олардың арасында термодинамикалық ынтықтың болуына байланысты. Еріткіштердің полимерлерге деген термодинамикалық ынтықтық дәрежесіне қарай олар полимерлермен термодинамикалық үйлесетіндер және үйлеспейтіндер болып бөлінеді. Термодинамикалық ынтықтықтың шамасына қарай еріткіштерді жақсы және нашар деп бөледі, яғни еріткіштің термодинамикалық сапасын бағалайды.
Осмос қысымы. Вант Гофф заңы бойынша ерітінділердің осмос қысымы π концентрацияға (с) тура пропорционал:
π= cRT (1)
Тұрақты температурада, ерітіндінің парциалдық мольдік көлемі тұрақты болса (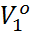 =const), еріткіштің химиялық потенциалының сыртқы қысымға байланысты өзгерісі былай өрнектеледі:
=const), еріткіштің химиялық потенциалының сыртқы қысымға байланысты өзгерісі былай өрнектеледі:
 =-
=- 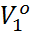 π (2) немесе π=
π (2) немесе π=  \
\ 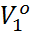 (3)
(3)
Іс жүзінде ерітінділер қысым түсіргенде сығыларды. Еріткіштің парциал көлемінің қысымға тәуелділігін ескеріп, (2) теңдеуге кейбір өзгерістер енгізу арқылы осмос қысымы π мен  , арасындағы байланысты былай келтіруге болады:
, арасындағы байланысты былай келтіруге болады:
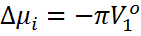 (1+
(1+ 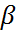 т
т  )
)
Мұндағы 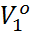 -еріткіштің парциалдық мольдік көлемі;
-еріткіштің парциалдық мольдік көлемі;  -еріткіштің ерітіндідегі изотермиялық сығылғыштық коэффициенті.
-еріткіштің ерітіндідегі изотермиялық сығылғыштық коэффициенті.
Демек, осмос қысымы дегеніміз-еріткіштің көлем бірлігіне келетін, компоненттер арасындағы термодинамикалық ынтықтық. Осмос қысымы неғұрлым көп болса,  абсолют мәні де соғұрылм көп болады, яғни еріткіштің полимерге деген термодинамикалық ынтықтығы да артады. Кез келген төмен молекулалық қосылыс және өте сұйытылған жоғары молекулалық қосылыс және өте сұйыиылған жоғары молекулалық қосылыстардың осмос қысымы Вант –Гофф заңымен сипатталады. Бірақ тәжірибе жүзінде көпшілік полимер ерітінділерінің осмос қысымы Вант Гофф заңдылығынан алынатын осмос қысымынан біршама жоғары екені дәлелденген және график түрінде келтіруге болады (1-сурет).
абсолют мәні де соғұрылм көп болады, яғни еріткіштің полимерге деген термодинамикалық ынтықтығы да артады. Кез келген төмен молекулалық қосылыс және өте сұйытылған жоғары молекулалық қосылыс және өте сұйыиылған жоғары молекулалық қосылыстардың осмос қысымы Вант –Гофф заңымен сипатталады. Бірақ тәжірибе жүзінде көпшілік полимер ерітінділерінің осмос қысымы Вант Гофф заңдылығынан алынатын осмос қысымынан біршама жоғары екені дәлелденген және график түрінде келтіруге болады (1-сурет).

1-сурет. Осмос қысымының төмен молекулалық заттар және полимер ерітіндісінің конц.тәуелділігі
төмен молекулалық қосылыстардың осмос қысымы концентрацияға тура пропорционал артса, жоғары молекулалық қосылыстардың осмос қысымының өсімі концентрациядан кем болады. Демек, полимер ерітінділеріне Вант Гофф заңын қолдануға болмайды. Аталған өзгешелік макромолекулалардың тізбекті құрылысының салдарынан туады. Ұзын да иілгіш макромолекулалардың кинетикалық элементі тұтас макромолекула емес, оның фрагменттері сегменттер. Сондықтан макромолекула ерітіндіде бірнеше қысқа молекулалардың қасиетін көрсетеді. Макромолекула неғұрлым иілгіш болса, ерітіндінің осмос қысымы соғұрлым жоғары болады да, Вант Гофф заңы бойынша алынатын осмос қысымынан көбірек ауытқиды. Флори Хаггинс теориясы бойынша, осмос қысымының полимердің концентрациясына тәуелділігі Вант Гофф теңдеуімен емес, Ван дер Ваальстің концентрация бойынша дәрежелі жіктелу теңдеуімен сипатталады:
π=RT( c+
c+  +
+  +…)
+…)
немесе π\с= RT( c+
c+  +
+  +…)
+…)
мұндағы с-ерітіндідегі полимердің концентрациясы, г\мл; 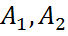 -осмос қысымының бірінші, екінші вириальді коэф.
-осмос қысымының бірінші, екінші вириальді коэф.
Бірінші вириальді коэф. полимердің молекулалық массасына тікелей байланысты шама  =1\М, ал
=1\М, ал  коэффициенті макромолекуланың құрылысы мен молекулалық массасына, еріткіштің сапасына, температураға және т.б. байланысты болып келеді де, негізінен полимер ерітіндісінің идеал ерітіндіден қаншалықты ауытқитынын көрсетеді. Сұйытылған ерітінділер үшін үшінші және одан кейінгі вириальді коэф. шамасы өте аз, оларды ескермеуге де болады. Сонда вириальді теңдеу қолдануға ыңғайлы қарапайым түзу сызықтық теңдеуге айналады:
коэффициенті макромолекуланың құрылысы мен молекулалық массасына, еріткіштің сапасына, температураға және т.б. байланысты болып келеді де, негізінен полимер ерітіндісінің идеал ерітіндіден қаншалықты ауытқитынын көрсетеді. Сұйытылған ерітінділер үшін үшінші және одан кейінгі вириальді коэф. шамасы өте аз, оларды ескермеуге де болады. Сонда вириальді теңдеу қолдануға ыңғайлы қарапайым түзу сызықтық теңдеуге айналады:
π\с=RT(1\M+  )
)
Флори Хаггинс анықтамасы бойынша Ө температурада ∆G=0.Демек, Ө температурада π= сRT, яғни Ө жағдайдағы ерітіндулерге осмос қысымының теңдеуін қолдануға болады.
Сурет кок 138 бет абд






