Лекция 6.
Дисперсия оптического вращения и круговой дихроизм.
ЯМР-спектроскопия, ЭПР-спектроскопия.
В основе этих методов лежит одно и то же физическое явление: взаимодействие поляризованного света с оптически активными молекулами. Как известно, все биологические молекулы являются оптически активными, т.е. способными вращать плоскость поляризации при прохождении через них поляризованного света. Все молекулы, содержащие ассиметричный атом углерода являются оптически активными. Как отмечалось выше, свет – электромагнитная волна, состоящая из осциллирующих электрического и магнитного полей. Вектор колебания электрического Е и вектор магнитного Н поля взаимно перпендикулярны. Плоскость поляризации определяется как плоскость колебания вектора Е. Обычный, неполяризованный свет представляет собой набор волн со всеми возможными ориентациями векторов Е и Н. Плоскополяризованный свет можно получить, пропуская свет через поляризатор, например через поляроид или призму Николя (см. 1 лек 5 Фрайфельдер, с.451). Плоскополяризованный свет обладает такими же свойствами, как и обычный свет. При прохождении через вещество он преломляется (изменяется скорость распространения) и поглощается (уменьшается амплитуда вектора Е). Преломление света характеризуется показателем преломления n, а поглощение молярным коэффициентом экстинкции e. При взаимодействии поляризованного света с оптически активными молекулами, наряду с вращением плоскости поляризации, будет обнаруживаться и преломление, и поглощение света. Причем, коэффициенты преломления и поглощения, будут различаться в зависимости от направления вращения плоскости поляризации. Плоскополяризованный свет обладает соответствующими коэффициентами n и e для правовращающей (nR и eR) и левовращающей (nL и eL) компонентов света. Любое оптически активное соединение будет характеризоваться соответствующими коэффициентами nL и eL, eL, eR при пропускании поляризованного света определенной длины волны. Величина вращения плоскости поляризации (угол поворота al, выраженное в градусах) при этом будет зависит от соотношения коэффициентов nL и eL, от концентрации молекул с, от длины оптического пути d (толщины раствора) и от длины волны l падающего света:
al = 180° d(nL - eL)/l
В практической работе используются показатель удельного вращения [a]l
[a]l = al/ d с
и показатель молярного вращения М ]l
[ М ]l = al М/100 d с
где al -угол поворота (град); d – длина оптического пути (дм); с – концентрация(г\мл); М – молекулярная масса (г/моль).
Зависимость оптического вращения выраженного в виде al, [ М ]l или [a]l, от длины волны поляризованного света называется спектром дисперсии оптического вращения (спектр ДОВ). Приборы, которые регистрируют спектры ДОВ, называются спектрополяриметрами (Рис.1).
Поглощение поляризованного света оптически активным веществом характеризуется молярным коэффициентом экстинкции eL, eR. В результате неодинакового поглощения право и левовращающей компоненты света линейно поляризованный свет превращается в эллиптически поляризованный свет (Рис. 9). Это означает, что амплитуды колебания L, и R – волнбудут изменяться в зависимости от угла поворота. В этом случае для характеристики взаимодействия света с веществом вводится показатель эллиптичность ql вещества
ql = 180° d(eL - eR)/l
Молярная эллиптичность , [q]l выражается следующей формулой:
[q]l = М ql/10 d с,
где ql -измеренная эллиптичность в граду; М -молекулярная масса;
Часто молярную эллиптичность вычисляют по следующей формуле:
[q]l = 3300 (eL - eR)
Кривая описывающая зависимость эллиптичности или молярной эллиптичности от длины волны, называется спектром кругового дихроизма(спектр КД). Приборы, регистрирующие такой спектр, называются КД-дихрографами. Схематичное изображение устройства этого прибора представлено на рисунке 8.
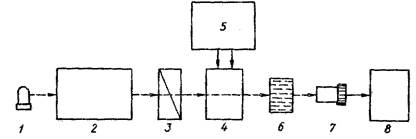
Рис. 1. Схема спектрополяриметра и КД-дихрографа (Фрайфельдер,464 с; Костюк,68 с)
1- источник свет; 2- монохроматор; 3 – поляризатор; 4,5 – кювета с оптически активным веществом; 6- анализатор; 7 – фотоэлектронный умножитель; 8- электронная система регистрации спектров.
ДОВ-спектрометрию и КД- дихрографию используют для определения высших структур макромолекул. Наибольшее применение эти методы нашли при установлении вторичной структуры белков. Точность этого метода можно сравнить с рентгеноструктурным анализом, а трудоемкость значительно меньше (табл. 1). Для получения спектров ДОВ и КД требуется несколько часов, а на проведение рентгеноструктурного анализа требуются недели. Для определения вторичной структуры белковой молекулы, измеренные спектры ДОВ и КД, сравнивают со спектрами стандартных (маркерных) полипептидов с известной структурой, заложенных в память компьютера. В частности, основными стандартами для белков являются три формы поли- L- лизина: a-спираль, b-форма и беспорядочный клубок. Кроме определения вторичной структуры белковых молекул, измерение ДОВ - и КД –спектров позволяют определить в динамике:
1. Изменения структуры белка при связывании с другими молекулами (фермент-субстрат, фермент-ингибитор, антиген-антитело и другие).
2. Денатурацию и ренатурацию молекул белков и НК.
3. Образование пространственной структуры макромолекул, т.е. образование вторичной, третичной и четвертичной структур.
4. Переход одноцепочечных полинуклеотидов в двухцепочечные и наоборот.
5. Связывание т-РНК с аминокислотами.
Таблица 1
Содержание спиральных структур (%) в молекулах белков по результатам рентгеноструктурного анализа и измерения КД-спектра
| Белок | КД-дихрография | Рентгеноструктурный анализ |
| Миоглобин | ||
| Лизоцим | ||
| РНК-аза | ||
| Папаин | ||
| Лактатдегидрогеназа | ||
| a-химотрипсин | ||
| Химотрисиноген |






