Тема 1. Методологічні, методичні основи вивчення й оцінка потенційного ризику впливу чинників довкілля на здоров’я населення. Профілактична токсикологія. Принципи та методи гігієнічного нормування шкідливих хімічних речовин у різних об’єктах довкілля.
Методологічні та методичні основи гігієни
Гігієна – це наука, яка вивчає закономірності впливу навколишнього середовища на індивідуальне та популяційне здоров’я з метою обгрунтування гігієнічних нормативів, санітарних правил і профілактичних заходів, спрямованих на забезпечення оптимальних умов життєдіяльності, зміцнення здоров’я та попередження захворювань [1, С.19; 2, С.10-11].
Мета гігієни – збереження та зміцнення здоров’я людей; “зробити розвиток людського організму найбільш досконалим, життя найбільш сильним, згасання найбільш уповільненим, а смерть найбільш віддаленою” (Е.Паркс) [1, С.19; 2, С.11].
Шляхи досягнення мети:
- охорона й оздоровлення довкілля (збереження рівнів і концентрацій позитивних природних чинників, зниження рівнів і концентрацій шкідливих природних і антропогенних чинників);
- збереження та підвищення опірності організму до несприятливих чинників довкілля (підвищення імунорезистентності організму, посилення механізмів адаптації та компенсації, індивідуальний захист організму) [1, С.21].
О сновні завдання гігієни:
- вивчення природних і антропогенних чинників довкілля та соціальних умов, що можуть впливати на здоров’я людини;
- вивчення закономірностей впливу чинників і умов довкілля на організм людини або популяції;
- наукове обгрунтування гігієнічних нормативів, правил і заходів, їх застосування в практиці охорони здоров’я та всіх сферах життя людини, перевірка їх ефективності та удосконалення;
- прогнозування санітарної ситуації на найближчу та віддалену перспективу, визначення актуальних гігієнічних проблем, їх наукова розробка [1, С.19; 2, С.11-14].
Санітарія – це практичне застосування розроблених гігієнічною наукою нормативів, санітарних правил і рекомендацій [1, С.19-20; 2, С.17-19].
Загальнофілософська методологія гігієни базується на основних законах (взаємопереходу кількісних і якісних змін, єдності та боротьби протилежностей, заперечування заперечення) і категоріях матеріалістичної діалектики (причини і наслідків, необхідності та випадковості, змісту та форми, частки та цілого, можливості та дійсності). Предметна методологія гігієни – сукупність науково обгрунтованих методів і методик, які використовуються при вивченні впливу чинників довкілля, соціально-економічних умов на організм людини, а також впливу побутової та виробничої діяльності людей на довкілля [1, С.227-229; 2, С.48-52, 88-117].
Специфічні методи гігієни:
- епідеміологічний (вивчення здоров’я населення);
- санітарного обстеження (санітарно-топографічного, санітарно-технічного, санітарно-епідеміологічного);
- гігієнічного натурного та лабораторного експерименту;
- санітарної експертизи;
- санітарної освіти, гігієнічного виховання та навчання [1, С.20; 2, С.16-17].
Класифікація методів гігієнічних досліджень:
- методи вивчення довкілля (санітарне обстеження й опис об’єкта, санітарно-статистичні, математичні, інструментально-лабораторні фізичні, хімічні, біологічні, органолептичні методи);
- методи вивчення впливу довкілля на здоров’я (експериментальні дослідження, натурні спостереження та дослідження із застосуванням клінічних, фізіологічних,
токсикологічних, статистичних і медико-географічних методів) [1, С.22; 2, С.52-87].
Здоров’я за статутом ВООЗ– стан повного фізичного, психічного та соціального благополуччя, а не лише відсутність хвороб і фізичних дефектів. Загальнопатологічне поняття здоров’я – інтервал, в межах якого кількісні коливання психофізіологічних процесів здатні утримувати живу систему на рівні функціонального оптимуму. Популяційне здоров’я – умовне статистичне поняття, яке характеризується комплексом демографічних показників, рівнем фізичного розвитку, захворюваністю, частотою преморбідних станів та інвалідністю населення. Індивідуальне теоретичне здоров’я – стан повного соціального, біологічного та психічного благополуччя, коли функції всіх органів і систем організму людини врівноважені з навколишнім середовищем, відсутні будь-які захворювання, хворобливі стани та фізичні дефекти. Індивідуальне фактичне здоров’я – стан організму, при якому він здатний повноцінно виконувати свої соціальні та біологічні функції [1, С.229-231; 2, С.458-465].
Показники здоров’я:
- медичні показники (захворюваність, смертність, фізичний розвиток, інвалідність);
- показники соціального благополуччя (демографічна ситуація, стан довкілля, спосіб життя, рівень медичної допомоги, соціально-гігієнічні показники);
- показники психічного благополуччя (захворюваність на психічні хвороби, частота неврозів і психопатій, психологічний мікроклімат) [1, С.231; 2, С.464].
Профілактика – один з основних принципів охорони здоров’я, система державних, суспільних і медичних заходів, спрямованих на збереження та зміцнення здоров’я, виховання здорового потомства, підвищення працездатності, продовження активного життя. Розрізняють профілактику суспільну та особисту, первинну, вторинну та третинну [1, С.18-19; 2, С.19-20]. Первинна (радикальна) профілактика спрямована на причину захворювання і попередження його винекнення. Більшість гігієнічних заходів, зокрема гігієнічне нормування, належить до заходів первинної профілактики і передбачає повне усунення або зменшення впливу шкідливого чинника до безпечних рівнів. Метою вторинної профілактики є рання дігностика донозологічних станів в осіб, які зазнали впливу несприятливих чинників довкілля або мають підвищений ризик розвитку певних захворювань. Вторинна профілактика включає аліментарні, фармакологічні заходи, заходи гігієнічного виховання, навчання тощо, спрямовані на попередження маніфестації захворювання. Т ретинна профілактика – комплекс лікувальних і реабілітаційних заходів щодо запобігання ускладнень, які можуть виникнути під час прогресування захворювання. Це найменш ефективний, але найбільш поширений у традиційній медицині засіб профілактики. Якщо оздоровлення способу життя та довкілля знижує захворюваність і смертність на 20-50%, то лікарське втручання – лише на 10% [5, С.30-31].
Знання гігієни для лікарів лікувального профілю необхідні для:
- аналізу стану здоров’я населення чи окремих його контингентів у зв’язку з умовами життя та праці;
- встановлення правильного діагнозу захворювання, оскільки понад 80% хвороб прямо чи опосередковано пов’язані з несприятливим впливом чинників довкілля;
- організації первинної, вторинної та третинної профілактики захворювань;
- участі у роботі МСЕК, ЛКК, ЛТЕК тощо;
- оцінки середовища життєдіяльності організованих колективів (виробничих, дитячих, військових, лікарняних тощо) й окремих осіб з метою їх диспансерного обслуговування, призначення відповідного харчування, санаторно-курортного лікування, надання лікарських рекомендацій з працевлаштування, організації здорового способу життя, загартовування, занять фізкультурою і спортом, профілактики інфекцій та інвазій, проведення санітарно-освітньої роботи [1, С.11-12].
У діяльності лікаря-лікувальника профілактична робота на сімейній, територіальній або цеховій дільниці посідає вагоме місце поряд з лікувально-діагностичною роботою. Профілактична діяльність лікаря повинна базуватися на методологічних і методичних принципах гігієнічної діагностики – системі мислення та дій, метою якої є дослідження стану природного і соціального середовища життєдіяльності, здоров’я людини (популяції) та з’ясування на цій основі причинно-наслідкових зв’язків між впливом чинників середовища і можливими змінами стану здоров’я населення. Гігієнічна діагностика характеризується низкою особливостей, які відрізняють її від традиційної клінічної діагностики.
Сучасна гігієнічна діагностика поєднує:
- гігієнічну діагностику стану довкілля, оцінку рівнів експозиції (частоти, інтенсивності та тривалості) впливу чинників довкілля на окрему людину або досліджувану популяцію;
- діагностику стану здоров’я популяції, її окремих підгруп, зокрема надчутливих, і індивідуумів;
- комплексну гігієнічну діагностику об’єктивного, переконливого зв’язку між рівнями впливу різноманітних чинників і станом здоров’я людини, визначення внеску чинників середовища в етіологію порушень стану здоров’я популяції, окремих її підгруп та осіб.
Розрізняють популяційну й індивідуальну гігієнічну діагностику. Популяційна гігієнічна діагностика використовується для оцінки екологічної ситуації на різних територіях і виявлення ризику для здоров’я певних шкідливих підприємств або інших джерел забруднення довкілля. Під сприятливою екологічною ситуацією розуміють відсутність аномальних для певного регіону кліматичних, біогеохімічних та інших природноих явищ, а також антропогенних джерел несприятливого впливу на природне середовище та здоров’я. Залежно від інтенсивності впливу чинників довкілля на здоров’я виділяють зони надзвичайної екологічної ситуації та зони екологічного лиха. Екологічний стан території оцінюють за комплексом демографічних і медичних показників (перинатальноюсмертністю, дитячою смертністю у віці до 1-го року й 1-4 роки, частотою вроджених вад розвитку, спонтанних викиднів, структурою захворюваності дітей і дорослих, середньою тривалість життя, частотою генетичних зрушень, змін в імунограмі, вмістом у біосубстратах людини токсичних хімічних речовин.
Індивідуальна гігієнічна діагностика ставить за мету виявлення причинно-наслідкових зв’язків між станом здоров’я індивідуума й існуючим або існувавшим у минулому потенційно шкідливим впливом чинників довкілля. Цей вид гігієнічної діагностики важливий для правильної діагностики, лікування та профілактики захворювань, а також для визначення матеріальних компенсацій шкоди здоров’ю людини внаслідок впливу екологічних, зокрема виробничих, чинників.
З метою попередження еколого-залежних захворювань останнім часом поширююється донозологічна гігієнічна діагностика – раннє виявлення прихованих, передпатологічних змін в організмі “асимптомного” пацієнта, які в подальшому можуть призвести до хвороби. До методів донозологічної діагностики належать дослідження імунного та ферментного статусу, процесів перекисного та вільнорадикального окиснення, регуляторних механізмів серцево-судинної системи й адаптації, психологічне тестування, застосування біомаркерів [5, С.34].
Чинники довкілля за їх значенням в етіології захворювань поділяються на етіологічні чинники та чинники ризику. Етіологічний (причинний) чинник призводить до виникнення детермінованого ефекту в організмі та розвитку специфічного, зокрема еколого-залежного, захворювання (наприклад, хвороби Мінімата, пов’язаної із забрудненням ртуттю водної фауни; хвороби ітай-ітай, зумовленої забрудненням води та грунту кадмієм; хвороби Юшо або Ю-Ченг, спричиненої забрудненням рису поліхлорованими біфенілами; хвороби Кешана, викликаної дефіцитиом селену у довкіллі тощо). Чинник ризику – чинник будь-якої природи, який лише за певних умов (спадкових, екологічних, виробничих, способу життя тощо) здатний провокувати або збільшувати ризик розвитку захворювання, але сам по собі, за відсутності таких умов не призводить до хвороби. Більшість соматичних поліетіологічних ефектів (уроджені вади, спадкова патологія, атеросклероз, гіпертонічна хвороба тощо), які виникають внаслідок одночасного впливу різних чинників, належать до стохастичних (імовірносних) або сомато-стохастичних. Під впливом канцерогенних і мутагенних чинників, що не мають порогу шкідливої дії, виникають специфічні стохастичні ефекти [5, С.31-32,58-70].
Ознаки еколого-залежних захворювань:
- раптовий спалах нового захворювання;
- наявність певного поєднання патогномонічних (специфічних) ознак, симптомів, результатів лабораторних досліджень, невластивих відомим хворобам;
- відсутність контактних шляхів передачі, властивих інфекційним захворюванням;
- спільне джерело впливу на всіх потерпілих (зв’язок захворювань з присутністю хімічних речовин в одному з об’єктів довкілля);
- наявність залежності доза-відповідь;
- утворення кластерів (згущень) числа випадків захворювань, які зазвичай відносно рідко зустрічаються в популяції;
- характерний географічний розподіл випадків захворювань;
- характерний розподіл потерпілих за віком, статтю, соціальним статусом, професією й іншими ознаками (найчастіше діти, люди похилого віку, хворі на хронічну патологію);
- наявність підгруп з підвищеним ризиком захворювання;
- наявність зв’язку у часі між захворюванням і впливом факторів (наявність латентного періоду від декількох тижнів до декількох десятків років);
- зв’язок захворювань з певними подіями (відкриттям нового виробництва або початком випуску, застосування нових речовин, захованням промислових відходів, змінами раціону харчування тощо);
- біологічна правдоподібність (симптоми підтверджуються відомостями про патогенез захворювання, результатами досліджень на лабораторних тваринах);
- виявлення у крові потерпілих досліджуваної хімічної речовини або її метаболіту;
- ефективність заходів втручання (специфічних профілактичних, лікувальних) [5, С.34].
Епідеміологічний метод як специфічний метод гігієни, спрямований на виявлення й оцінку взаємозв’язків між чинниками довкілля та здоров’ям населення, реалізується за алгоритмом [1, С.238], який передбачає наступні етапи:
- визначення мети, завдань і програми дослідження;
- вибір зон спостереження – досліджуваної та контрольної територій, ідентичних за умовами проживання та діяльності населення, із необхідною чисельністю контингентів спостереження, але різних за спрямованістю, поширенням та інтенсивністю впливу досліджуваних чинників довкілля;
- інтегральна оцінка стану довкілля в зонах спостереження;
- вибір способу реалізації епідеміологічного дослідження (санітарно-статистичне дослідження, медичне обстеження, клінічне спостереження за спеціально відібраними особами, натурний епідеміологічний експеримент);
- вибір форми проведення дослідження: а) поперечні або одномоментні дослідження, які полягають у спостереженні за впливом чинників довкілля на здоров’я у даний момент, без динамічного спостереження і поділяються на проспективні, коли порівнюють два контингенти, що зазнають і не зазнають впливу досліджуваного чинника, тобто шкідливий чинник заздалегідь відомий і науковий пошук спрямований від чинника до здоров’я, та ретроспективні, коли хворих порівнюють зі здоровими, а діючий чинник невідомий і рух наукового пошуку зворотний – від здоров’я (хвороби) до можливого чинника; б) поздовжні дослідження, які полягають у проведенні тривалого динамічного спостереження за певним контингентом і поділяються на паралельні, коли тривалість проведення дослідження та період, упродовж якого збирають необхідну інформацію, співпадають, і непаралельні, коли досліджуваний період належить до минулого, що потребує звертання до архівних матеріалів;
- визначення мінімального обсягу вибірки;
- збирання даних про здоров’я населення;
- розрахунок показників здоров’я;
- оцінка зв’язку між чинниками довкілля та здоров’ям населення;
- розроблення і впровадження профілактичних заходів, оцінка їх ефективності [1, С.234-235,242-245].
Інтегральна оцінка стану довкілля в зонах спостереження передбачає проведення якісного та кількісного аналізу. Якісний аналіз стану довкілля полягає у порівнянні результатів лабораторно-інструментальних досліджень з гігієнічними нормативами, подальшій оцінці одержаних результатів (в межах або на рівні норми, перевищення норми та кратність цього перевищення) і прогнозуванні на цій основі змін рівнів здоров’я населення (табл. 1-3). Кількісний аналіз стану довкілля передбачає розрахунок інтегральних показників забруднення або оцінку в балах за спеціальними формулами [1, С.233-234,245-247; 2, С.74,136-137].
Таблиця 1
Прогностичні оцінки рівня здоров’я залежно від стану забруднення атмосфери
| Кратність перевищення ГДК, рази | Ефекти |
| Зміни в стані здоров’я відсутні | |
| 2-3 | Зміни деяких функціональних показників |
| 4-7 | Виражені фізіологічні зміни |
| 8-10 | Зростання специфічної та неспецифічної захворюваності |
| Гострі отруєння | |
| Летальні отруєння |
Таблиця 2
Прогностичні оцінки рівня здоров’я залежно від стану хімічного забруднення питної води
| Кратність перевищення ГДКтокс, рази | Ефекти |
| 3-5 | Початкові симптоми інтоксикації через 1-2 місяці |
| Виникнення симптомів інтоксикації через 2-4 тижні | |
| Виникнення симптомів інтоксикації через декілька діб |
Таблиця 3
Прогностичні оцінки рівня здоров’я залежно від стану мікробного забруднення питної води
| Індекс БГКП | Ефекти |
| Не перевищує 3 | Невисокий ступінь епідеміологічної небезпеки |
| 3-9 | Підвищений ступінь епідеміологічної небезпеки |
| Більше 9 | Високий ступінь епідеміологічної небезпеки |
Інтегральна оцінка стану здоров’я населення в зонах спостереження передбачає проведення концептуального (якісного) та математико-статистичного (кількісного) аналізу і здійснюється в декілька етапів:
- отримання інформації про показники здоров’я з наступних джерел (звіти закладів і органів охорони здоров’я, соціального забезпечення, державної статистики, бюро РАГСів; результати ретроспективних і проспективних, клінічних і лабораторно-інструментальних досліджень, лікарських оглядів лікувально-профілактичних закладів, медико-соціологічних досліджень, результати математичного моделювання та прогнозування);
- інтегральна концептуальна (якісна) оцінка рівня здоров’я, результатом якої є розподіл населення на 5 груп здоров’я (І – здорові, без морфофункціональних відхилень і частотою гострих захворювань не більше 3-х разів за період спостереження (3 роки); ІІ – здорові, з деякими морфофункціональними відхиленнями та частотою гострих захворювань 4 рази і більше за період спостереження; ІІІ – хворі на хронічні захворювання на стадії компенсації; ІV – хворі на хронічні захворювання на стадії субкомпенсації; V – хворі на хронічні захворювання на стадії декомпенсації), та математико-статистична (кількісна) оцінка рівня здоров’я на основі розрахунку за спеціальною методикою інтегрального індексу здоров’я;
- встановлення кількісних залежностей між чинниками довкілля та групами або індексами здоров’я на підставі аналізу даних літератури, експертних оцінок, статистичного аналізу, експериментальних досліджень, математичного моделювання та системного аналізу із застосуванням методології теорії ймовірності та математичної статистики (кореляційного, регресійного, факторного, дисперсійного, дискримінантного, кластерного аналізу, коефіцієнта детермінації [1, С.232-233,235-236,250-253; 2, С.465-479]) або методології оцінки ризику несприятливого впливу чинників довкілля на здоров’я.
Ризик шкідливого впливу на здоров’я – імовірність розвитку небажаного ефекту у населення за певних рівнів і тривалості впливу чинника довкілля. Оцінка ризику для здоров’я людини – визначення цієї імовірності за специфічних умов впливу чинника. Виявлення та кількісна оцінка ризику розвитку у відносно великих групах населення хронічних неінфекційних захворювань поліетіологічної природи шляхом проведення правильно спланованих епідеміологічних і гігієнічних досліджень дозволяє довести їх зв’язок з якістю довкілля та розробити адекватні профілактичні заходи.
Узагальнена класифікація ризиків в системі охорони здоров’я поділяє їх за родом (природні, техногенні, змішані), видом (фізичні, хімічні, біологічні, психологічні), походженням (космічні, біосферні, атмосферні, водні, літосферні тощо), об’єктом (індивідуальний, груповий, популяційний), впливом на людину (летальний, екстремальний, лімітувальний, канцерогенний, мутагенний, тератогенний тощо), рівнем прийнятності (безумовно прийнятний, прийнятний, неприйнятний) та ін. При вивченні здоров’я розрізняють індивідуальний, соціальний, відносний і привнесений, кумулятивний і додатковий ризики, при оцінці здоров’я – відносний, атрибутивний, популяційний [5, С.31-34; 1, С.695-699].
Оцінка ризику здійснюється у відповідності до міжнародно визнаної методології [5, С.34-37,40-43,50-57; 1, С.699-718], яка передбачає наступні етапи дослідження:
1. Ідентифікування небезпеки (шкідливості, загрози). Мета етапу – визначення конкретних проблем і пріоритетних задач, окреслення шляхів їх розв’язання. Завдання – визначення чинників, які можуть викликати несприятливі наслідки для здоров’я людини, рівнів і шляхів надходження чинників в організм, теоретичної правдоподібності та підтвердженості асоціації між чинником і захворюванням.
2. Оцінка експозиції (контакту організму людини з хімічним, фізичним або біологічним агентом). Мета етапу – визначення доз і експозицій, які впливали у минулому, впливають в даний час або, можливо, будуть впливати в подальшому, встановлення рівнів експозиції для популяції в цілому та її окремих субпопуляцій і надчутливих груп. Завдання – характеристика джерел забруднення, маршрутів поширення речовин-забруднювачів від джерела до людини, шляхів і місць впливу, рівнів експозиції, розмірів і характеру експонованих популяцій. Оцінка експозиції здійснюється у дві стадії:
а)характеристика оточуючої обстановки (клімат, гідрологічні умови, рослинність, тип грунту тощо) і характеристика популяцій, які потенційно зазнають впливу (місця проживання, види діяльності, демографічний склад, зонування території тощо);
б)ідентифікування маршрутів впливу і потенційних шляхів поширення досліджуваного чинника у довкіллі. Маршрут впливу – шлях хімічної речовини або іншого чинника від джерела його утворення і виділення у довкілля до експонованого організму. Повний маршрут впливу включає джерело; сприймаюче середовище, в яке первинно надходить хімічна речовина; транспортуючі й акумулюючі середовища, за участю яких речовина переноситься в інші об’єкти, трансформується в інші сполуки, накопичується чи руйнується; місце впливу, в якому відбувається контакт людини з досліджуваним чинником; середовища, що впливають, зокрема повітря, питна вода, харчові продукти тощо), шляхи надходження або впливу (інгаляційний, пероральний, перкутанний).
Оцінка експозиції базується на прямих і непрямих методах дослідження. До прямих методів належать індивідуальний моніторинг експозиції, який передбачає безпосереднє вимірювання рівнів впливу досліджуваного чинника на конкретну особу, і застосування біологічних маркерів (біомаркерів експозиції, ефекту, сприйнятливості). Біомаркери експозиції – вміст екзогенної хімічної речовини, її метаболіту або продукту взаємодії між речовиною та будь-якою молекулою чи клітиною, який свідчить про наявний вплив і його рівень (наприклад, вміст карбоксигемоглобіну в крові під впливом СО, свинцю у крові, пентахлорфенолу в сечі при дії відповідних речовин, етанолу у видихуваному повітрі при вживанні алкоголю, нікотину в сечі при палінні, аддуктів деяких хімічних речовин з ДНК, білком сироватки, еритроцитами, зокрема аддуктів бенз(а)пірену при вивченні впливу викидів коксових печей або вживання смаженого м’яса). Біомаркер ефекту – показник, що кількісно характеризує біохімічні, фізіологічні, поведінкові чи інші зміни в організмі, ступінь яких визначає фактичне або потенційне порушення здоров’я та ризик розвитку хвороби. Біомаркер сприйнятливості – показник уродженої або набутої здатності організму реагувати на вплив певного чинника, який застосовується при виявленні потенційно надчутливих до дії чинника людей і підгруп.
Непрямі (опосередковані) методи оцінки експозиції грунтуються на використанні даних моніторингу якості об’єктів довкілля, а також даних, одержаних шляхом математичного моделювання поширення забруднювачів від джерела утворення до місця впливу. Для характеристики рівнів експозиції в окремих групах населення можна застосовувати анкетування й аналіз добових щоденників, які дозволяють одержати інформацію про тривалість перебування у приміщенні, на вулиці, у транспорті, на роботі, добове споживання питної води і харчових продуктів, і на цій основі орієнтовано визначити фактичне сумарне навантаження на організм.
3. Встановлення залежності “доза-відповідь”. Мета етапу – виявлення зв’язку між станом здоров’я та рівнями експозиції. Завдання – визначення у спеціально організованих епідеміологічних дослідженнях або лабораторних експериментах для неканцерогенних речовин на основі концепції пороговості їх дії референтної дози або концентрації (у документах ВООЗ – толерантної дози або концентрації), вплив якої на людську популяцію, у т.ч. її чутливі підгрупи, не створює ризику розвитку будь-яких шкідливих ефектів протягом усього життя людини; для канцерогенів з урахуванням безпороговості їх дії ймовірності розвитку додаткових випадків раку при екстраполяції найменшої ефективної дози на нульову дозу.
4. Характеристика ризику. Мета етапу – визначення пріоритетних ризиків, які необхідно попередити або знизити до прийнятного на даний час рівня.Завдання – аналіз всіх одержаних розрахунків ризику для популяції й її окремих підгруп, порівняння ризиків з допустимими (прийнятними) рівнями, порівняльна оцінка і ранжування різних ризиків за їх статистичною, медико-біологічною та соціальною значущістю, формулювання рекомендацій.
5. Керування ризиком. Мета – надання одержаних рекомендацій органам, які розробляють заходи попередження чи зниження ризику з урахуванням економічних, політичних, соціальних та інших умов і встановлюють динамічний контроль за рівнями ризиків, експозицій і станом здоров’я населення.
6. Повідомлення про ризик. Мета – широке повідомлення населення про існуючі ризики, їх джерела та запобіжні заходи на індивідуальному, регіональному та державному рівнях.
Схеми епідеміологічних досліджень, прийнятних для вивчення причинно-наслідкових зв’язків у системі довкілля-здоров’я за методологією оцінки ризику [5, С.45-50].
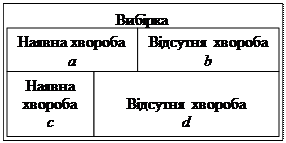
1. Дослідження за схемою “випадок-контроль” як варіант поздовжних досліджень передбачають формування двох груп досліджуваних: осіб з наявним захворюванням, що вивчається (випадок), і осіб, у яких це захворювання відсутнє (контроль) (рис. 1). У кожній з
Фактор ризику Хвороба
захворюванням
Популяція без
(контроль) |
Рис. 1. Схема дослідження “випадок-контроль”.
груп визначають число осіб, які зазнають та не зазнають впливу оцінюваного чинника ризику. Очевидно, що чим більшою в дослідній групі (випадок) частка осіб, які зазнають впливу досліджуваного чинника, тим з більшою впевненістю можна судити про причинну зумовленість певного захворювання.
Кількісним показником ризику виникнення захворювань в дослідженнях “випадок-контроль” є відношення шансів (OR) – відношення кількості осіб, які зазнають та не зазнають досліджуваной експозиції в групах “випадок” і “контроль”:

2. Когортні (поздовжні динамічні) дослідження проводяться систематично, безперервно або через короткі проміжки часу і поділяються на проспективні та ретроспективні. Проспективні дослідження спрямовані на пошук ефекту (від наявного впливу дослідник переходить до аналізу захворювань, що виникають). При проведенні проспективного дослідження формують групи (когорти) людей, які зазнають і не зазнають аналізованого впливу. За цими двома групами встановлюється динамічний медичний контроль і аналізується число осіб у групах з експозицією (а) і без експозиції (с), у яких виник досліджуваний ефект, а також число осіб у цих групах, у яких ефект не виявлено (відповідно в і d) (рис. 2).
Ретроспективні дослідження спрямовані на пошук причини виникнення захворювання (від захворювання, яке спостерігається, дослідник переходить до аналізу впливів, які мали місце в минулому). При ретроспективному дослідженні порівнюють між собою групу (когорту) з наявним захворюванням і групу, у якої захворювання на момент дослідження відсутнє. У кожній з досліджуваних груп оцінюють попередні експозиції аналізованих факторів. В результаті ретроспективного дослідження визначають число осіб із захворюванням, у яких у минулому спостерігалась аналізована експозиція (а) або такого впливу не було (с). У групі без захворювання також підраховують число осіб, котрі зазнали (в) та не зазнали (d) досліджуваного впливу (рис. 3).
На основі результатів проспективного і ретроспективного дослідження розраховують:
1) абсолютний ризик R виникнення захворювання (смерті) – імовірність появи в індивідуума захворювання або настання смерті упродовж заданого проміжку часу, який
Сучасне Майбутнє
 Популяція
Популяція
|
Рис. 2. Проспективне когортне дослідження.
Сучасне Майбутнє
Популяція |
Рис. 3. Ретроспективне когортне дослідження
вираховується окремо для експонованих і неекспонованих осіб за формулами Rекс = а/(a+b) і Rнеекс = c/(c+d);
2) відносний ризик r – відношення частоти захворювань серед експонованих і неекспонованих осіб, який є основним кількісним показником ризику і вираховується за формулою r = Rекс / Rнеекс = a/(a+b): c/(c+d);
3) атрибутивний ризик AR – частка абсолютного ризику, яку можна пов’язати з впливом досліджуваної експозиції та вирахувати за формулою AR = [Rекс – Rнеекс]•100% = [a/(a+b) – c/(c+d)]•100%;
4) атрибутивний популяційний ризик APR – частка абсолютного ризику, яку можна пов’язати з впливом досліджуваної експозиції на популяцію вцілому та вирахувати за формулою APR = [Rекс – Rнеекс]•P, де Р – кількість осіб у популяції з конкретним чинником ризику;
5) вірогідність зв’язку “чинник ризику-захворювання” визначається за допомогою критерію відповідності χ2, який розраховують за формулою
 ,
,
де  – загальне число обстежених в обох когортах.
– загальне число обстежених в обох когортах.
Оцінку вірогідності критерію χ2 проводять за таблицею імовірності підтвердження нульової гіпотези (табл. 4):
Таблиця 4
Значення критерію χ2
| Число ступенів свободи n | Р | Число ступенів свободи n | Р | ||||
| 0,05= 5% | 0,01= 1% | 0,002= 0,2% | 0,05= 5% | 0,01= 1% | 0,002= 0,2% | ||
| 3,8 | 6,6 | 9,5 | 26,3 | 32,0 | 37,0 | ||
| 6,0 | 9,2 | 12,4 | 27,6 | 33,4 | 38,5 | ||
| 7,8 | 11,3 | 14,8 | 28,9 | 34,8 | 40,0 | ||
| 9,5 | 13,3 | 16,9 | 30,1 | 36,2 | 41,5 | ||
| 11,1 | 15,1 | 18,9 | 31,4 | 37,6 | 43,0 | ||
| 12,6 | 16,8 | 20,7 | 32,7 | 38,9 | 44,5 | ||
| 14,1 | 18,5 | 22,6 | 33,9 | 40,3 | 46,0 | ||
| 15,5 | 20,1 | 24,3 | 35,2 | 41,6 | 47,5 | ||
| 16,9 | 21,7 | 26,1 | 36,4 | 43,0 | 48,5 | ||
| 18,3 | 23,2 | 27,7 | 37,7 | 44,3 | 50,0 | ||
| 19,7 | 24,7 | 29,4 | 38,9 | 45,6 | 51,5 | ||
| 21,0 | 26,2 | 31,0 | 40,1 | 47,0 | 53,0 | ||
| 22,4 | 27,7 | 32,5 | 41,3 | 48,3 | 54,5 | ||
| 23,7 | 29,1 | 34,0 | 42,6 | 49,6 | 56,0 | ||
| 25,0 | 30,6 | 35,5 | 43,8 | 50,9 | 57,5 |
Відмінності між показниками досліджуваних груп вважаються вірогідними (наявний зв’язок між досліджуваним фактором і захворюваністю), якщо нульова гіпотеза підтверджується з імовірністю, меншою ніж 5%. Якщо нульова гіпотеза підтверджується з імовірністю більшою ніж 5%, то відмінності вважаються невірогідними і зв’язок відсутнім.
Профілактична токсикологія
Токсикологія – наука про шкідливий вплив на людину хімічних речовин, які надходять з різних об’єктів довкілля. Розрізняють клінічну та профілактичну токсикологію. Мета клінічної токсикології полягає у розпізнаванні та лікуванні захворювань хімічної етіології, профілактичної (гігієнічної) токсикології – у запобіганні найближчих і віддалених наслідків впливу хімічних речовин на людину шляхом їх гігієнічного нормування в об’єктах довкілля як головної ланки в системі профілактичних заходів.
Завдання профілактичної токсикології:
- вивчення залежності біологічної активності речовин від хімічної структури та фізико-хімічних властивостей;
- дослідження токсикокінетики (часових закономірностей надходження, розподілу,
матаболізму та виведення шляхом визначення концентрацій самих речовин або їх метаболітів у біологічних середовищах організму в різні періоди інтоксикації) та токсикодинаміки (характеру впливу речовин на організм), виявлення найбільш чутливих тестів для встановлення порогових доз і концентрацій;
- встановлення в експерименті на тваринах параметрів токсичності та небезпеки хімічних речовин, їх здатності спричинювати можливі віддалені ефекти (канцерогенний, ембріотоксичний, тератогенний, мутагенний, атерогенний, нейротоксичний тощо), розроблення на цій підставі гігієнічних нормативів вмісту речовин в об’єктах довкілля;
- розроблення гігієнічних нормативів речовин з урахуванням їх комбінованої, комплексної та поєднаної дії [2, С.357-358].
Принципи гігієнічного нормування:
- принцип пороговості, який базується на визнанні можливості пристосування організму до змін середовища в певних кількісних межах і зриву пристосування після перевищення допустимого кількісного рівня інтенсивності зовнішніх впливів;
- принцип залежності ефекту від дози (концентрації) та часу: гострі ефекти залежать від дози (концентрації) речовини і характеризуються залежністю доза-ефект; хронічні ефекти, пов’язані з матеріальною або функціональною кумуляцією речовини, залежать від її дози (концентрації) та тривалості впливу і характеризуються залежністю доза-час;
- принцип диференціації біологічних відповідей спирається на положення про те, що частота біологічних відповідей на хімічний вплив (смертність, захворюваність, фізіологічні ознаки хвороби, зрушення в організмі невідомої природи, накопичення речовини в органах і тканинах) серед населення, яка залежить від сили впливу, розподіляється у вигляді піраміди – найбільшій силі впливу відповідає найменша частота смертності (вершина піраміди); найменшій силі впливу, яка вважається допустимою та не призводить до напруження адаптаційно-пристосувальних механізмів, – найбільша частота накопичення речовини в органах і тканинах (підніжжя піраміди);
- принцип розподілу об’єктів санітарної безпеки, який з урахуванням специфічності та мінливості фізико-хімічних властивостей повітря, води, грунту, харчових продуктів, особливостей їх впливу на організм і тривалості контакту передбачає встановлення гігієнічних нормативів – гранично допустимих концентрацій ГДК певної речовини для окремих середовищ (повітря робочої зони, атмосферного повітря населених пунктів, питної води та води водойм, грунту) і допустимої добової дози ДДД для харчових раціонів (незалежне гігієнічне нормування);
- принцип комплексного гігієнічного нормування (застосовується виключно при нормуванні пестицидів і нітратів для населення, яке не має професійного контакту з ними) полягає в тому, що сумарна кількість певного препарату (разом з продуктами його трансформації), яка може надійти в організм людини з харчовими продуктами, водою й атмосферним повітрям, не повинна перевищувати допустиму добову дозу ДДД, при цьому гігієнічна норма препарату у харчовому раціоні не повинна перевищувати 70%, воді – 25%, атмосферному повітрі – 5% ДДД з урахуванням питомої ваги шляхів надходження пестициду в організм;
- принцип урахування всіх можливих несприятливих впливів, кожному з яких відповідає певний показник шкідливості речовини:
а) для повітря робочої зони, атмосферного повітря – рефлекторний (подразнювальний вплив на слизову верхніх дихальних шляхів, кон’юнктиву ока), санітарно-токсикологічний;
б) для води водойм – органолептичний (вплив на запах, присмак, колір і забарвлення), загальносанітарний (зміна чисельності, видового складу й активності сапрофітної мікрофлори), санітарно-токсикологічний (резорбтивний вплив на організм);
в) для грунту – органолептичний, загальносанітарний, міграційно-водний і міграційно-повітряний (зростання рівня міграції у суміжні середовища до небезпечних меж), фітоакумуляційний (накопичення шкідливої речовини у харчових продуктах рослинного
походження), санітарно-токсикологічний;
г) для харчових продуктів – органолептичний, загальногігієнічний (вплив на біологічну
цінність продукту, терміни його зберігання та технологічні властивості в процесі обробки), санітарно-токсикологічний.
Для кожного показника шкідливості встановлюють мінімально діючу концентрацію (дозу), з них обирають найменшу, яка буде лімітувальним показником шкідливості, тобто тим показником, за яким нормується дана речовина.
- принцип відносності гігієнічного нормативу, який передбачає його зменшення (в окремих випадках – збільшення) в разі одержання нових даних про токсичні властивості речовини при застосуванні більш досконалих методів дослідження [2, С.138-142,324-346].
Етапи гігієнічної оцінки хімічних речовин:
- попередня токсикологічна оцінка передбачає одержання відомостей про клінічну картину гострого смертельного отруєння, загальний характер впливу отрути на організм (подразнювальний, наркотичний, гемолітичний тощо), шкірно-резорбтивні та сенсибілізуючі властивості речовини, порогові дози (концентрації) за умов гострого досліду та обгрунтування математичними методами орієнтовного гігієнічного нормативу речовини – її орієнтовного безпечного рівня діі ОБРД;
- повна токсикологічна оцінка передбачає проведення токсикологічного експерименту (гострих, підгострих і хронічних дослідів) на 4-х видах лабораторних тварин (щурах, мишах, мурчаках, кролях) з метою визначення всіх параметрів токсикометрії й обгрунтування на цій основі гігієнічного нормативу – гранично допустимої концентрації ГДК;
- клініко-гігієнічне коригування гігієнічного нормативу передбачає перевірку його надійності в епідеміологічних дослідженнях і в разі виявлення змін у стані здоров’я певного контингенту порівняно з контрольною групою перегляд нормативу в бік його зниження [2, С.378-385].
Токсикометрія – сукупність методів і засобів досліджень для кількісної оцінки токсичності та небезпечності шкідливих хімічних речовин. Токсичність – міра несумісності хімічної речовини з життям; токсикометричний показник, що розраховується як величина, обернена середній смертельній дозі (концентрації). Небезпечність – властивість речовини при надходженні в організм людини спричиняти шкідливі для здоров’я ефекти в реальних умовах її виробництва чи застосування. Кумуляція – підсумовування дії повторних доз отрут, коли наступна доза надходить до організму раніше, ніж закінчується дія попередньої дози [2, С.358-378]; зміна токсичності речовини в часі, максимально досяжне підсилення дії ксенобіотиків за час гострої, підгострої та хронічної інтоксикації [Б.М.Штабський]. Розрізняють три типи кумуляції: матеріальну, функціональну та змішану [2, С.367-368; 6, С.5-43].
Основні параметри токсикометрії [2, С.369-378].
В гострих дослідах визначають:
1. Середню смертельну дозу (ЛД50, LD50) – кількість отрути в мг/кг маси тіла, що призводить до загибелі 50% піддослідних тварин при спостереженні за ними на протязі двох тижнів після одноразового ентерального надходження речовини або після 4-годинної аплікації речовини на 5% поверхні тіла.
2. Середню смертельну концентрацію (ЛК50, CL50) – концентрацію отрути у повітрі (мг/м  ), воді (мг/л), що призводить до загибелі 50% піддослідних тварин при спостереженні за ними на протязі двох тижнів після одноразового інгаляційного затруєння білих мишей упродовж 2 год і білих щурів упродовж 4 год або після надходження речовини з води через всю поверхню шкіри (занурення у воду) протягом 1 год. За величиною ЛД50 і ЛК50 ксенобіотики поділяють на 4 класи (І – надзвичайно небезпечні, ІІ – високонебезпечні, ІІІ – помірно небезпечні, ІV – малонебезпечні) (табл. 5,6). Чим менше значення ЛД50 і ЛК50, тим більш токсичною є речовина.
), воді (мг/л), що призводить до загибелі 50% піддослідних тварин при спостереженні за ними на протязі двох тижнів після одноразового інгаляційного затруєння білих мишей упродовж 2 год і білих щурів упродовж 4 год або після надходження речовини з води через всю поверхню шкіри (занурення у воду) протягом 1 год. За величиною ЛД50 і ЛК50 ксенобіотики поділяють на 4 класи (І – надзвичайно небезпечні, ІІ – високонебезпечні, ІІІ – помірно небезпечні, ІV – малонебезпечні) (табл. 5,6). Чим менше значення ЛД50 і ЛК50, тим більш токсичною є речовина.
3. Коефіцієнт міжвидових розбіжностей (КМР) – співвідношення ЛД50 (ЛК50) для найменш і найбільш чутливого виду тварин (ЛД50, ЛК50 визначають на 3-4 видах лабораторних тварин). Якщо КМР < 3, вважають, що міжвидова чутливість відсутня.
4. Середній час загибелі тварин (ЕТ50(1)) – час, за який гинуть тварини при дії смертельних доз ксенобіотика. Чим більше значення ЕТ50(1), тим вища здатність речовини до кумуляції.
5. Індекс кумуляції – Iк = 1 – Д2/Д1 (Iк = 1 – С2/С1), де Д2 (С2) = ЛД50 (ЛК50), а Д1 (С1) – доза (концентрація), що призводить до загибелі 50% тварин протягом першої доби після введення ксенобіотика.
6. Період Т півзніження ефекту або концентрації самої речовини в крові та тканинах – час, за який рівень градуйованого ефекту (концентрації речовини) знижується у 2 рази з моменту tmax.
7. Час tmax (в годинах) досягнення максимуму ефекта або максимальної концентрації речовини в біосередовищі.
8. Сумарний час (Тc) зниження ефекта (концентрації) у 2 рази: Тc = tmax + Т. Чим більше значення Тc , тим вищий ступінь кумуляції.
9. Поріг гострої дії (Limac) – порогова доза або концентрація (ПД, ПК) – мінімальна ефективна доза (концентрація), що встановлена в момент tmax за найбільш показовими тестами (біохімічними, фізіологічними тощо) за загальнотоксичною дією.
10. Зону гострої дії Zac = LD50/Limac; Zac = LC50/Limac. Чим вужча Zac, тим більшою є небезпека гострого отруєння і меншою – здатність речовини до кумуляції. Чим ширша Zac, тим меншою є загроза гострого отруєння, але більшою є здатність речовини до кумуляції.
11. Коефіцієнт можливості інгаляційного отруєння (КМІО) – це відношення насичувальної концентрації речовини при 20°С до LC50. Чим більше значення КМІО, тим небезпечнішою є речовина.
В підгострих дослідах визначають:
1. Середній час (добу) загибелі тварин ЕТ50(n) при щоденному введенні ½ першодобової ЛД50 або 1/10 ЛД50. Чим більше значення ЕТ50(n), тим менша здатність речовини до кумуляції.
2. Коефіцієнт кумуляції Кк = ЛД50(n)/ЛД50 або Кк = Дn/Д2, де Дn або ЛД50(n) – сумарна середня смертельна доза при щоденному пероральному введенні препарату за схемою Ю.С.Кагана (1/10 ЛД50 на протязі 2 місяців) або за схемою R.Lim et al. (регулярно збільшувані дози щочотири дні на протязі 24±4 дні). При щоденному введенні речовини однаковими разовими дозами Кк = ДР · ЕТ50(n)/ЛД50, де Др – доза, що вводиться щоденно.
3. Стандартизований коефіцієнт кумуляції Ккст = Кк · Д2/Д1. Чим більше значення Кк (Ккст), тим менший ступінь кумуляції речовини. Розрізняють слабкий (незначна кумуляція), середній (помірна кумуляція), сильний (значна кумуляція), надзвичайно сильний (надкумуляція) ступінь кумуляції (табл. 7).
4. Поріг кумулятивної дії (Limcum)– порогова або мінімально ефективна доза (концентрація), що встановлена за найбільш показовими тестами в 30-добовому підгострому досліді при щоденному надходженні в організм різних доз речовини.
5. Зону кумулятивної дії Zcum = LD50/Limcum. Чим ширша Zcum, тим вищий ступінь кумуляції речовини.
У хронічних дослідах (тривалість 6-12 міс.) визначають:
1. Поріг хронічної дії (Limch) – мінімально ефективна доза (концентрація) за найбільш показовими тестами. Для більшості речовин Limch = Limcum.
2. Зону хронічної дії Zch = Limac/Limch. Чим ширша Zch, тим вищий ступінь кумуляції речовини.
3. Зону біологічної дії Zbiol = LD50/Limch; Zbiol = LC50/Limch. Zbiol є остаточною характеристикою кумуляції, але для більшості речовин Zbiol = Zсum.
Параметри специфічної (ембріотоксичної, гепатотоксичної, мутагенної, тератогенної, канцерогенної, алергенної тощо) дії:
1. Поріг специфічної дії (Limsp) – мінімально ефективна доза (концентрація) при вивченні конкретного виду специфічної дії ксенобіотика у відповідних умовах досліду.
2. Зону специфічної дії Zsp = Limch(integ)/Limsp (Liminteg – це Limch, Limcum, Limac, встановлені за інтегральними тестами). Чим ширша Zsp, тим більш небезпечною є речовина за проявом специфічної дії.
Окрім перелічених параметрів, визначають максимальну неефективну або недіючу дозу МНД (концентрацію МНК) – максимальну неефективну дозу (концентрацію) хімічної речовини, яка не викликає ніяких змін в організмі експериментальних тварин в конкретних умовах досліду (гострих, підгострих, хронічних за загальнотоксичною або специфічною дією).
Таблиця 5
Класифікація шкідливих речовин за ступенем токсичності та небезпеки
(за ГОСТ 12.1.007-76)
| Показники | Норма за класами небезпеки | |||
| І | ІІ | ІІІ | IV | |
| ГДК шкідливої речовини у повітрі робочої зони, мг/м3 | <0,1 | 0,1-1,0 | 1,1-10 | >10 |
| Середня смертельна доза при введенні в шлунок, мг/кг | <15 | 15-150 | 151-5000 | >5000 |
| Середня смертельна доза при нанесенні на шкіру, мг/кг | <100 | 100-500 | 501-2500 | >2500 |
| Середня смертельна концентрація в повітрі, мг/м3 | <500 | 500-5000 | 5001-50000 | >50000 |
| КМІО | >300 | 300-30 | 29-3 | <3 |
| Зона гострої дії | <6 | 6-18 | 18,1-54 | >54 |
| Зона хронічної дії | >10 | 10-5 | 4,9-2,5 | <2,5 |
Таблиця 6







 Популяція із
Популяція із
 захворювання
захворювання

