Классификация реакций
Для выполнения заданий по этой теме необходимо четко представлять классификации реакций по различным признакам, положенных в основу классификации:
- по составу и числу реагентов и продуктов реакции (реакции разложения, соединения, замещения и обмена);
- по изменению степеней окисления в ходе реакции (окислительно-восстановительные и неокислительно-восстановительные);
- по тепловому эффекту реакции (экзо- и эндотермические, т.е. с выделением и поглощением тепла соответственно);
- по направлению протекающих процессов (обратимые и необратимые);
- по количеству фаз в протекающей реакции (гомогенные – протекающие между веществами, находящимися в одной фазе(агрегатном состоянии, но не твердое + твердое) и гетерогенные – протекающие между реагентами в разных фазах);
- по наличию катализатора в реакционной системе (каталитические и некаталитические).
Для реакций ионного обмена надо помнить условия необратимого протекания реакций (правило Бертолле) – образование слабодиссоциированного вещества или неэлектролита.
Правила написания уравнений реакций в ионном виде
 Записывают формулы веществ, вступивших в реакцию, ставят знак «равно» и записывают формулы образовавшихся веществ. Расставляют коэффициенты.
Записывают формулы веществ, вступивших в реакцию, ставят знак «равно» и записывают формулы образовавшихся веществ. Расставляют коэффициенты.
 Пользуясь таблицей растворимости, записывают в ионном виде формулы веществ, обозначенных в таблице растворимости буквой «Р» (хорошо растворимые в воде), исключение – гидроксид кальция, который, хотя и обозначен буквой «М», все же в водном растворе хорошо диссоциирует на ионы.
Пользуясь таблицей растворимости, записывают в ионном виде формулы веществ, обозначенных в таблице растворимости буквой «Р» (хорошо растворимые в воде), исключение – гидроксид кальция, который, хотя и обозначен буквой «М», все же в водном растворе хорошо диссоциирует на ионы.
 Нужно помнить, что на ионы не разлагаются металлы, оксиды металлов и неметаллов, вода, газообразные вещества, нерастворимые в воде соединения, обозначенные в таблице растворимости буквой «Н». Формулы этих веществ записывают в молекулярном виде. Получают полное ионное уравнение.
Нужно помнить, что на ионы не разлагаются металлы, оксиды металлов и неметаллов, вода, газообразные вещества, нерастворимые в воде соединения, обозначенные в таблице растворимости буквой «Н». Формулы этих веществ записывают в молекулярном виде. Получают полное ионное уравнение.
 Сокращают одинаковые ионы до знака «равно» и после него в уравнении. Получают сокращенное ионное уравнение.
Сокращают одинаковые ионы до знака «равно» и после него в уравнении. Получают сокращенное ионное уравнение.
Условия, при которых реакции ионного обмена
протекают до конца
1. Если в результате реакции выделяется малодиссоциирующее вещество – вода.
Молекулярное уравнение реакции щелочи с кислотой:

Неизменность степеней окисления элементов во всех веществах до и после реакции говорит о том, что реакции обмена не являются окислительно-восстановительными.
Полное ионное уравнение реакции:
K+ + OH– + H+ + Cl– = K+ + Cl– + H2O.
Cокращенное ионное уравнение реакции:
H+ + OH– = H2O.
Молекулярное уравнение реакции основного оксида с кислотой:
CaO + 2HNO3 = Ca(NO3)2 + H2O.
Полное ионное уравнение реакции:

Cокращенное ионное уравнение реакции:
CaO + 2H+ = Ca2+ + H2O.
Молекулярное уравнение реакции нерастворимого основания с кислотой:
3Mg(OH)2 + 2H3PO4 = Mg3(PO4)2  + 6H2O.
+ 6H2O.
Полное ионное уравнение реакции:

В данном случае полное ионное уравнение совпадает с сокращенным ионным уравнением.
Молекулярное уравнение реакции амфотерного оксида с кислотой:
Al2O3 + 6HCl = 2AlCl3 + 3H2O.
Полное ионное уравнение реакции:
Al2O3 + 6H+ + 6Cl– = 2Al3+ + 6Cl– + 3H2O.
Cокращенное ионное уравнение реакции:
Al2O3 + 6H+ = 2Al3+ + 3H2O.
2. Если в результате реакции выделяется нерастворимое в воде вещество.
Молекулярное уравнение реакции растворимой соли со щелочью:
CuCl2 + 2KOH = 2KCl + Cu(OH)2  .
.
Полное ионное уравнение реакции:
Cu2+ + 2Cl– + 2K+ + 2OH– = 2K+ + 2Cl– + Cu(OH)2  .
.
Cокращенное ионное уравнение реакции:
Cu2+ + 2OH– = Cu(OH)2  .
.
Молекулярное уравнение реакции двух растворимых солей:
Al2(SO4)3 + 3BaCl2 = 3BaSO4  + 2AlCl3.
+ 2AlCl3.
Полное ионное уравнение реакции: 2Al3+ + 3SO4 2- + 3Ba2++6Cl- = 3BaSO4  + 2Al3++6Cl-.
+ 2Al3++6Cl-.
Cокращенное ионное уравнение реакции: SO4 2- + Ba2+ = BaSO4 
Молекулярное уравнение реакции нерастворимого основания с кислотой:
Fe(OH)3 + H3PO4 = FePO4  + 3H2O.
+ 3H2O.
Полное ионное уравнение реакции:
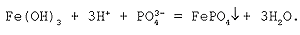
В данном случае полное ионное уравнение реакции совпадает с сокращенным. Эта реакция протекает до конца, о чем свидетельствуют сразу два факта: образование вещества, нерастворимого в воде, и выделение воды.
3. Если в результате реакции выделяется газообразное вещество.
Молекулярное уравнение реакции растворимой соли (сульфида) с кислотой:
K2S + 2HCl = 2KCl + H2S  .
.
Полное ионное уравнение реакции:
2K+ + S2– + 2H+ + 2Cl– = 2K+ + 2Cl– + H2S  .
.
Cокращенное ионное уравнение реакции:
S2– + 2H+ = H2S  .
.
Молекулярное уравнение реакции растворимой соли (карбоната) с кислотой:
Na2CO3 + 2HNO3 = 2NaNO3 + H2O + CO2 
Полное ионное уравнение реакции: 2Na++CO32- + 2H++2NO3 - = 2Na++ 2NO3- + H2O + CO2 
Сокращенное ионное уравнение реакции: CO32- + 2H+ = H2O + CO2 
О протекании данной реакции до конца свидетельствуют два признака: выделение воды и газа – оксида углерода(IV).
Молекулярное уравнение реакции нерастворимой соли (карбоната) с кислотой:
3СaCO3 + 2H3РO4 = Са3(PO4)2  + 3H2O + 3CO2
+ 3H2O + 3CO2 
Полное ионное уравнение реакции: 3СaCO3 + 6H++2РO43- = Са3(PO4)2  + 3H2O + 3CO2
+ 3H2O + 3CO2 
В данном случае полное ионное уравнение реакции совпадает с сокращенным уравнением. Эта реакция протекает до конца, о чем свидетельствуют сразу три признака: выделение газа, образование осадка и выделение воды.






