Важнейшей из реакций этерификации является обратимое взаимодействие органических или неорганических кислот со спиртами, идущее с образованием сложных эфиров и воды, а в случае двухосновных кислот получаются два ряда эфиров – кислотные и средние, выход которых зависит от соотношения исходных реагентов:
RCOOH+R’OH  RCOOR’+H2O
RCOOR’+H2O
HOOCR’COOH 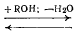 HOOCR’COOR
HOOCR’COOR  ROOCR’COOR.
ROOCR’COOR.
В свою очередь, для двух- и многоатомных спиртов возможно образование неполных и полных эфиров, что также определяется соотношением взятых веществ:

Когда и кислота и спирт является по меньшей мере бифункциональными, процесс протекает с образованием высокомолекулярных соединений, на чем основан синтез полиэфиров:
nHOOC-R’-COOH + nHOROH  [-OC-R’-COO-R-O-]n
[-OC-R’-COO-R-O-]n
Все упомянутые реакции равновесны, причем обратные процессы представляют собой гидролиз сложных эфиров, часто называемый омылением.
Этерификацию спиртов карбоновыми кислотами можно осуществить в отсутствие катализаторов, но в этом случае она протекает медленно, и для достижения достаточной скорости требуется высокая температура (200-300̊С). Все же, когда примесь катализатора трудно отмывается и ухудшает качество продукта, используют некаталитический процесс.
В присутствие кислотных катализаторов (H2SO4, HCl, арилсульфокислоты, ионообменнные смолы) этерификация и гидролиз сложных эфиров протекает при 70-150̊ С. Такой метод, осуществляемый в жидкой фазе, - обычный для синтеза большинства сложных эфиров. Катализаторами могут служить также гетерогенные контакты кислотного типа (Al2O3, алюмосиликаты, фосфаты). В этом случае этерификация проводится в газовой фазе, но такой способ применяют относительно редко.
В некоторых случаях, например для угольной и фосфорной кислот, реакция со спиртами не приводит к желаемому результату, и для получения сложных эфиров этих кислот пользуются их хлорангидридами:
COCl2 + 2CH3OH 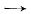 CO(OCH3)2 + 2HCl.
CO(OCH3)2 + 2HCl.
Хлорангидриды карбоновых кислот также пригодны для этерификации, но их применение ограничено ввиду большой стоимости хлорангидридов по сравнению с кислотами.
Вместо хлорангидридов можно применять ангидриды кислот. Их реакции со спиртами протекают в две стадии: вначале образуются сложный эфир и кислота, и в ряде случаев (например, получение ацетата целлюлозы) процесс на этом заканчивается. Однако в более жестких условиях выделившаяся кислота этерифицирует спирт по рассмотренной ранее обратимой реакции, причем используются обе ацильные группы ангидрида:
(CH3CO)2O + ROH  CH3COOR + CH3COOH
CH3COOR + CH3COOH  2CH3COOR+H2O.
2CH3COOR+H2O.
Первая стадия протекает при небольшом нагревании и ускоряется сильными минеральными кислотами. Очевидно, что вторая стадия аналогична этерификации свободными кислотами и тоже требует кислотных катализаторов. Этерификация ангидридами кислот, обычно более дорогими, чем сами кислоты, тоже имеет ограниченное применение, но она становится типичной при использование доступных циклических ангидридов двухосновных кислот (фталевого, малеинового и др.).
Из перечисленных этерифицирующих агентов наиболее активны хлорангидриды, меньше – ангидриды, еще меньше – сами карбоновые кислоты: RCOCl>(RCO)2O>RCOOH.
К рассматриваемому классу реакций относятся также алкоголиз (1) и ацидолиз (2) сложных эфиров и процессы переэтерификации (3). Они представляют собой реакции обменного разложения сложных эфиров со спиртами, кислотами или другим сложным эфиром:
RCOOR’ + R”OH  RCOOR” + R’OH, (1)
RCOOR” + R’OH, (1)
RCOOR’ + R”COOH  R”COOR’ + RCOOH, (2)
R”COOR’ + RCOOH, (2)
RCOOR’ + R”COOR”’  RCOOR”’ + R”COOR’. (3)
RCOOR”’ + R”COOR’. (3)
Наибольшее значение имеет алкоголиз сложных эфиров, нередко используемый для практических синтезов. Алкоголиз, ацидолиз и переэтерификация карбоновыми кислотами, катализируются сильными кислотами.
В последнее время приобретает значение прямая этерификация карбоновых кислотолефинами без стадии гидратации олефинов в спирты; реакция также ускоряется катализаторами кислотного типа:
CH3-CH=CH2 + RCOOH  RCO-O-CH(CH3)2.
RCO-O-CH(CH3)2.
Термодинамика реакций.
Взаимодействие спиртов с карбоновыми кислотами в жидкой фазе протекает практически без какого-либо поглощения или выделения тепла (∆H=0). Соответственно, алкоголиз, ацидолиз и переэтерификация также имеют тепловой эффект, близкий к нулю. Следовательно, константы равновесия этих реакций не зависят от температуры. В отличие от этого, этерификация спиртов хлорангидридами кислот, а также первая стадия этерификации спиртов ангидридами является экзотермическими процессами.
Реакции карбоновых кислот со спиртами обратимы, причем несмотря на неидеальность смеси, равновесие хорошо описывается концентрационной константой равновесия:
Kc=[RCOOR’][H2O]/([RCOOH][R’OH].
Константа равновесия зависит от строения кислоты и особенно от строения спирта. Для первичных насыщенных спиртов с прямой цепью константа равновесия при жидкофазной этерификации их уксусной кислотой равна 4,0-4,5 (при стехиометрическом количестве кислоты и спирта в исходной смеси это соответствует равновесной степени конверсии 66-68%). Удлинение углеродной цепи в молекуле спирта ведут к некоторому уменьшению константы равновесия. Вторичным насыщенным спиртам, а также аллиловому и бензиловому спиртам соответствует более низкая константа равновесия – от 2,0 до 2,5. Наименее благоприятно состояние равновесия при этерификации третичных спиртов и фенолов: константы равновесия для них очень малы – от 0,005 до 0,001, что при стехиометрическом соотношении исходных реагентов дает равновесную степень конверсии всего 6-10%. Вследствие этого третичные спирты и фенолы этерифицируют обычно не свободными кислотами, а более активными хлорангидридами и ангидридами.
Влияние строения карбоновой кислоты на равновесие этерефикации менее значительно и противоположно влиянию спирта. В этом случае с удлинением и разветвлением углеродной цепи в молекуле кислоты константа равновесия повышается. Так, для тризамещенных уксусных кислот при взаимодействии с первичными насыщенными спиртами в жидкой фазе она достигает 8-10, что наблюдается и для ароматических кислот.
В отличие от реакций в жидкой фазе, газофазная этерификация карбоновых кислот спиртами является экзотермической и имеет более высокую константу равновесия, зависящую от температуры. Так, при получении этилацетата в газовой фазе константа равновесия равна 30 при 150̊ С и 9 при 300̊ С.
Для повышения степени конверсии исходных реагентов в сложный эфир имеются различные методы. При жидкофазных реакциях наиболее эффективно отгонять из реакционной массы воду или эфир по мере их образования. Когда это невозможно, а также во всех процессах газофазной этерификации, чтобы повысить равновесную степень конверсии, берут избыток одного из реагентов, обычно наиболее дешевого. В обратном процессе при гидролизе сложных эфиров – для увеличения степени конверсии, очевидно, необходимы другие условия, а именно проведение реакций в избытке воды.
Положение равновесия при алкоголизе, ацидолизе и переэтерификации определяется равновесием соответствующих процессов этерификации. Например, при алкоголизе и получение же сложных эфиров этерификацией имеем:
RCOOR’ + R”OH  RCOOR” + R’OH,
RCOOR” + R’OH, 
RCOOH + R’OH 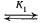 RCOOR’ + H2O,
RCOOR’ + H2O, 
RCOOH + R”OH  RCOOR" + H2O,
RCOOR" + H2O, 
Делим выражения K1 и K2 друг на друга, получаем:
K2/K1=[RCOOR”][R’OH]/([RCOOR’][R”OH])=Kалк
То есть константа равновесия при алкоголизе равна частному от деления констант равновесия соответствующих реакций этерификации.
При алкоголизе сложных эфиров применяют методы повышения степени конверсии, аналогичные используемым в случае этерификации. Наибольший эффект дает удаление образующегося спирта из сферы реакции, в связи с чем алкоголиз проводится в большинстве случаев с целью получения эфиров более высококипящих спиртов, например:
CO(OCH3)2 + 2C4H9OH  CO(OC4H9)2 + 2CH3OH
CO(OC4H9)2 + 2CH3OH






