ЛЕЧЕНИЕ НАРУШЕНИЙ РИТМА СЕРДЦА
Часть 2
Киров
2011 г.
УДК 616.12-008.318-07-08(075.8)
ББК 54.101я 73
Л 53
Печатается по решению центрального методического совета Кировской государственной медицинской академии от 2011 г. (протокол №)
Лечение нарушений ритма сердца. Часть 2. Учебное пособие для студентов медицинских вузов в 2-х частях / сост. д.м.н., профессор Е.И. Тарловская, к.м.н. М.В. Казаковцева. - Киров: ГОУ ВПО Кировская ГМА, 2011 г. - 64 с.
В учебном пособии рассмотрены базисные вопросы тактики ведения больных с нарушениями ритма сердца, как медикаментозными, так и немедикаментозными методами. Выделены основные группы антиаритмических препаратов, подробно изложены показания к назначению и побочные эффекты.
Пособие предназначено для студентов медицинских вузов, обучающихся по специальности «Лечебное дело».
Рецензент: заведующий кафедрой госпитальной терапии с курсом клиничес-кой фармакологии ГОУ ВПО Кировская ГМА, д.м.н., профессор Б.Ф.Немцов
ã Тарловская Е.И., Казаковцева М.В. - Киров, 2011
ã ГОУ ВПО Кировская ГМА Минздравсоцразвития РФ, 2011
ОГЛАВЛЕНИЕ
Список условных сокращений............................................................ 4
Предисловие................................................................................................... 6
Методические указания.................................................................................. 7
1. Определение понятия мерцательной аритмии.................................. 8
2. Распространенность и заболеваемость мерцательной аритмии... 9
2.1. Патогенез фибрилляции предсердий.............................................. 11
2.2 Факторы предрасполагающие к развитию фибрилляции предсердий 15
2.4. Классифиация фибрилляции предсердий....................................... 16
3. Гемодинамические последствия фибрилляции предсердий.............. 18
4. Тромбоэмболии: патофизиология клиническое значение................... 19
5. Клинические проявления фибрилляции предсердий...................... 21
6. Методические рекомендации по лечению мерцательной аритмии... 24
6.1. Фармакологическая кардиоверсия....................................................... 28
6.2. Электрическая кардиоверсия................................................................ 31
6.3. Осложнения электрической кардиоверсии 32
6.4. Показания для восстановления ритма.................................................. 33
6.5. Противопоказания для восстановления ритма.................................... 35
6.6. Профилактика рецидивов мерцательной аритмии........................... 36
7 Общие подходы к антиаритмической терапии................................... 38
7.1. Контроль за сердечным ритмом.......................................................... 39
7.2. Рекомендации АКК/ААС/ЕКО по профилактической фармакотера- 40
пии для поддержания синусового ритма………………………………………..
8. Антитромботическая терапия.......................................................... 41
9. Рекомендуемые стратегии лечения.................................................. 44
10. Непрямые антикоагулянты 47
11. Правила назначения непрямых антикоагулянтов.............................. 49
12. Немедикаментозные методы лечения……………………………………..
12.1. Радиочастотная абляция..................................................................... 51
12.2. Оперативное лечение мерцательной аритмии................................... 53
Ситуационные задачи.................................................................................. 56
Эталоны ответов к тестовым заданиям и решение ситуационных задач 59
Заключениение………….………………………………………………………63
Приложения............................................................................................. 65
Рекомендуемая литература.......................................................................... 66
| СПИСОК УСЛОВНЫХ СОКРАЩЕНИЙ |
| ААП | антиаритмические препараты |
| АВУ | атриовентрикулярный узел |
| АВБ | атриовентрикулярная блокада |
| АГ | артериальная гипертония |
| АПФ | ангиотензинпревращающий фермент |
| БАБ | бета-адреноблокаторы |
| БКК | блокаторы кальциевых каналов |
| в/в | внутривенно |
| ВВВСУ | время восстановления функции синусового узла |
| ВС | внезапная смерть |
| ДПП | дополнительные пути проведения |
| ИБС | ишемическая болезнь сердца |
| ИИ | ишемический инсульт |
| КВ-ДФ | кардиовертер-дефибриллятор |
| КМП | кардиомиопатии |
| ЛП | левое предсердие |
| НАК | непрямые антикоагулянты |
| НЖТ | наджелудочковая тахикардия |
| НЖЭ | наджелудочковая экстрасистолия |
| НРС | нарушения ритма сердца |
| ОИМ | острый инфаркт миокарда |
| ПИКС | постинфарктный кардиосклероз |
| ПНМК | преходящее нарушение мозгового кровообращения |
| РААС | ренин-ангиотензиновая система |
| СЭ | системные (артериальные) эмболии |
| СД | сахарный диабет |
| САУ | синоатриальный узел |
| СССУ | синдром слабости синусового узла |
| ТП | трепетание предсердий |
| ЧПЭхоКГ | чреспищеводная эхокардиоскопия |
| ЧСС | частота сердечных сокращений |
| ТЭ | тромбоэмболии |
| ФВ | фракция выброса левого желудочка |
| ФКВ | фармакологическая кардиоверсия |
| ФП | фибрилляция предсердий |
| ФР | факторы риска |
| ЭКГ-МТ | ЭКГ мониторирование |
| ЭКВ | электрическая кардиоверсия |
| ЭФИ | электрофизиологическое исследование |
| ЭХО-КС | эхокардиоскопия |
| per os | перорально |
ПРЕДИСЛОВИЕ
Нарушения ритма сердца являются частым проявлением заболеваний сердечнососудистой системы. За последние 20 лет частота госпитализаций по поводу фибрилляции предсердий возросла на 66% в результате старения населения, увеличения распространенности хронических заболеваний сердца. Смертность больных с эти видом аритмии почти в 2 раза выше, чем у боль-ных с синусовым ритмом и взаимосвязана со степенью тяжести основного заболевания. Фибрилляция предсердий ассоциируется с увеличением риска развития инсульта, хронической сердечной недостаточности и общей смертности. Увеличение продолжительности жизни в развитых странах привело к значительному росту мерцательной аритмии, что дало повод рас-сматривать ее как одну из эпидемий XXI века наряду с хронической сердеч-ной недостаточностью и сахарным диабетом.
Увеличивается число публикаций, посвященных немедикаментозным методам лечения различных видов аритмий. Разработаны хирургические про-цедуры для эффективного лечения мерцательной аритмии, хотя радиальное лечение данного вида аритмии находится в стадии разработки имеется доста-точное число сообщений об успешных результатах.
Риск развития инсульта у больных с фибрилляцией составляет 3-8% в год и зависит от наличия других факторов риска. Примерно у половины пожилых больных с мерцательной аритмией имеется артериальная гипер-тензия, а у 12% - стеноз каротидной артерии. Образование тромба, которое является следствием стаза крови в ушке левого предсердия, считают основ-ной причиной ишемического инсульта у пациентов с фибрилляцией пред-сердий.
Ввиду отсутствия в России полного спектра антиаритмических препа-ратов, и значительного проаритмогенного эффекта медикаментозной терапии выбор лечения может значительно ограничиваться, поэтому изучение немедикаментозных подходов становится в последнее время все более актуальным.
МЕТОДИЧЕСКИЕ УКАЗАНИЯ
В соответствии с требованиями специальности «Лечебное дело» 040100 врач-выпускник медицинского ВУЗа должен знать клинику, диагностику и лечение нарушений ритма сердца. Врач-выпускник должен уметь назначить необходимые лекарственные средства при выявлении заболеваний, протекающих с аритмическим синдромом (Рабочая программа по предмету «Внутренние болезни»). Клиника, диагностика и лечение заболеваний изучается на 4 курсе лечебного факультета на цикле внутренние болезни. Более углубленное изучение проблемы диагностики и лечения заболеваний проходит на 6 курсе. Продолжительность изучения непосредственных воп-росов этиологии, патогенеза, классификации, клиники, диагностики и лече-ния мерцательной аритмии на 6 курсе - 10 часов, из них: 1 практическое занятие по 6 часов и 4 часа лекций. Аудиторная самостоятельная работа студентов представляет собой решение карт-задач, решение тестовых зада-ний множественного расширенного выбора и тестов соответствия, осмотр бо-льных с выделением основных аритмических синдромов, формулировкой диагноза по современной классификации, составлением программы обследо-вания и лечения. Внеаудиторная самостоятельная работа студентов заключа-ется в изучении теоретического материала, решении карт-задач. Вопросы данной темы включены в государственный экзамен.
Целью создания данного методического пособия является углубление теоретических знаний и повышение практической подготовки выпускников медицинских ВУЗов по диагностике и лечению заболеваний, протекающих с нарушениями ритма сердца.
ГЛАВА 1. ОПРЕДЕЛЕНИЕ ПОНЯТИЯ МЕРЦАТЕЛЬНАЯ АРИТМИЯ
Термин "мерцательная аритмия" (МА) предложил в 1916г. Г.Ф. Ланг. В настоящее время под этим термином объединяются две формы аритмии: фибрилляция предсердий (ФП) и трепетание предсердий II типа.
ФП диагностируется на основании следующих критериев:
1. Абсолютно нерегулярные интервалы RR (интервалы RR не повторяются);
2. Отсутствие на ЭКГ з.P перед комплексом QRS;
3. Длительность предсердного цикла (т.е. интервал между двумя возбуж-дениями предсердий), если определяется, составляет < 200 мс (> 300 в мин).
Изолиния замещена кривой, представляющей волны f, амплитуда волн f, и расстояние между ними, постоянно изменяются.
Рисунок 1
Фибрилляция предсердий
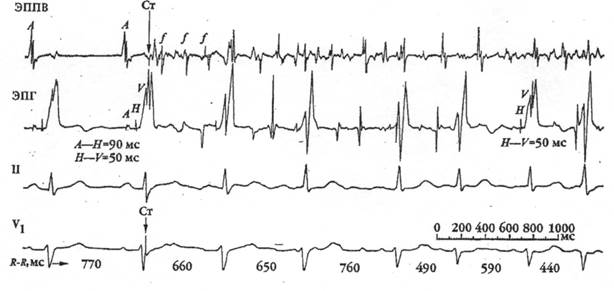
|
Синусовый ритм с частотой 78 в мин. После нанесения стимула - пароксизм крупноволновой фибрилляции предсердий с частотой 460 в мин. Частота желудочковых ответов 100 в мин.
При амплитуде волн f более 0.5 мм. и их частоте 350-450 в минуту говорят о крупноволновой ФП, при амплитуде волн f менее 0.5 мм и их частоте 600-700 в минуту — о мелковолновой форме ФП.
Проведение возбуждения на желудочки от предсердий крайне нерегу-лярно, поэтому интервал RR постоянно изменяется. При ЧСС от 60 до 90 ФП называется нормосистолической, при ЧСС менее 60 - брадисистолической, при ЧСС более 90 - тахисистолической.
Трепетание предсердий (ТП) — это быстрая и регулярная активность предсердий, которая характеризуется отсутствием (по крайней мере, в одном отведении ЭКГ) изоэлектрической линии между предсердными комплексами. Нормальные зубцы P на ЭКГ отсутствуют, вместо них регистрируются волны F. ТП 1 типа — частота F 240-340, имеет место постоянная амплитуда волн F и постоянная длина предсердного цикла, это ТП может быть купировано электрокардиостимуляцией с частотой не менее чем на 20% превышающей частоту. ТП II типа — частота F 340-440, характерна несколько непостоянная амплитуда F и изменяющаяся длина предсердного цикла, не купируется электрокардиостимуляцией, эффективна кардиоверсия.
 Рисунок 2
Рисунок 2
Трепетание предсердий
Трепетание предсердий I типа, координированная форма 2:1
ГЛАВА 2. РАСПРОСТРАНЕННОСТЬ И ЗАБОЛЕВАЕМОСТЬ МЕРЦАТЕЛЬНОЙ АРИТМИИ
ФП часто встречается в клинической практике. Доля ее среди причин
госпитализаций по поводу НРС составляет примерно 1/3. Распространен-ность ФП в общей популяции составляет 1-2%. С возрастом (старше 80 лет) частота встречаемости увеличивается до 8%. В проспективных исследова-ниях заболеваемость ФП увеличивалась с менее 0,5% в год у людей в воз-расте до 40 лет до более 5% - 15% в год в возрасте старше 80 лет. За пос-ледние 20 лет частота госпитализаций по поводу ФП возросла на 66% в результате старения населения, увеличения распространенности хронических заболеваний сердца. Проблему раннего распознавания ФП значительно осложняют бессимптомные формы, которые встречаются примерно у 1/3 пациентов. В Европе распространенность ФП за следующие 50 лет на фоне постарения населения удвоится.
У мужчин распространенность ФП, скорректированная по возрасту, значительно выше, чем у женщин. Медиана возраста больных ФП составляет около 75 лет. Примерно 60% больных в возрасте старше 75 лет женщины.
ФП ассоциируется с увеличением риска развития инсульта, хрони-ческой сердечной недостаточности (ХСН) и общей смертности, особенно у женщин. По данным Фремингемского исследования, МА повышает относи-тельный риск смерти от сердечнососудистых причин у мужчин в 2 раза, а у женщин - в 2,7 раза. ФП часто развивается на фоне органических заболе-ваний сердца, хотя у значительной части больных признаки поражения сердца выявить не удается. В эпидемиологических исследованиях доля паци-ентов без заболеваний сердца в анамнезе среди больных ФП не превышает 12%. Однако в некоторых исследованиях доля пациентов с изолированной ФП превышала 30%. ФП увеличивает риск инсульта в 5 раз, а каждый пятый инсульт развивается на ее фоне. У больных с ФП летальность примерно в 2 раза выше, чем у пациентов с синусовым ритмом, и зависит от тяжести заболевания сердца.
2.1 Патогенез фибрилляции предсердий
ФП - это наджелудочковая тахикардия (НЖТ), которая характеризуется нескоординированной активацией предсердий и в последующем нарушением их механической функции. У больных ФП чаще всего обнаруживают фиброз и уменьшение мышечной массы предсердий. Однако фиброз может предшествовать аритмии и развиться в результате апоптоза (структурное ре-моделирование предсердий на фоне органических заболеваний), который приводит к замещению миоцитов предсердий. Это приводит к электрической диссоциации мышечных пучков и неоднородности проведения, которые спо-собствуют развитию и сохранению ФП. Дилатация предсердий активирует различные сигнальные пути, включая РААС. Активация ангиотензина II происходит в ответ на растяжение, и в ткани предсердий больных с персистирующей ФП отмечается повышенная экспрессия АПФ. Подавление ангиотензина II может препятствовать развитию ФП за счет уменьшения фиброза. Полагают, что фиброз способствует развитию персистирующей ФП. Накапливаются данные, подтверждающие важность РААС в патогенезе ФП и лечение антагонистами ангиотензина II снижает частоту ФП после кате-терной абляции в клинических исследованиях.
Механизмы развития фибрилляции предсердий.
Имеющиеся данные свидетельствуют о наличии очаговых триггеров ФП (повышенный автоматизм или множественные очаги циркуляции возбуждения re-entry), которые не исключают друг друга и могут сочетаться.
Электро-анатомические изменения обуславливают появление множест-венных очагов циркуляции возбуждения, которые стабилизируют аритмию. Идентификация и аблация эктопических очагов позволяют ликви-дировать ФП, что подтверждает их роль в развитии аритмии. Источником ФП чаще всего являются изменения легочных вен, хотя очаговые изменения находили также в верхней полой вене, связке Маршалла, задней стенке левого предсердия, пограничном гребне (crista terminalis) и коронарном синусе. При гистологических исследованиях ткань мышцы сердца с неизмененной электрической активностью обнаруживали в легочных венах. Роль легочных вен как триггера ФП послужила основанием для изучения их анатомических и электрофизиологических свойств. Ткань предсердий в легочных венах у больных с ФП характеризуется более коротким рефрактерным периодом по сравнению с таковым у пациентов контрольной группы и по сравнению с тканью в других участках предсердий у больных с ФП. Неоднородность проведения может способствовать возникновению циркуляции возбуждения и является субстратом для развития постоянной ФП. В случае циркуляции возбуждения мелкие волны беспорядочно повторно входят в миокард, в кото-ром ранее уже вызвали возбуждение эти и другие мелкие волны. Число волн в определенный момент времени зависит от рефрактерного периода, массы и скорости проведения в различных частях предсердий.
Большая масса предсердия в сочетании с коротким рефрактерным периодом и замедленным проведением приводит к увеличению числа мелких волн и способствует развитию стойкой ФП. Существование этого механизма подтверждается результатами одновременной регистрации электрической активности с помощью нескольких электродов. Хотя циркуляцию возбуж-дения долгое время считали основным механизмом развития ФП, результаты экспериментальных и клинических исследований позволили подвергнуть сомнению эту точку зрения. У больных с идиопатической пароксизмальной ФП распространенные изменения электрокардиограмм правого предсердия предшествуют развитию ФП, что указывает на роль патологического субстрата в сохранении аритмии. Более того, у больных персистирующей ФП, у которых восстанавливается синусовый ритм, внутрипредсердное проведение замедлено по сравнению с контролем, особенно у пациентов с персистирующей ФП. Многие из этих изменений обнаруживали до появ-ления ФП, поэтому их нельзя связать с ремоделированием предсердий, происходящим вследствие ФП. Вопрос о том, какой вклад вносят изменения архитектуры предсердий в развитие и сохранение ФП, остается нерешенным.
Частота желудочкового ритма зависит от электрофизиологических свойств атриоветрикулярного узла (АВУ) и других проводящих тканей, то-нуса симпатической и парасимпатической систем, наличия дополнительных путей проведения (ДПП) и действия лекарственных средств. При наличии атриовентрикулчрной блокады (АВБ) желудочковые комплексы могут возникать регулярно (одинаковые интервалы RR). Стойкая тахикардия с не-регулярно возникающими широкими комплексами QRS характерна для ФП, возникающей на фоне наличия ДПП или блокады ножек пучка Гиса. Проведение возбуждения по ДПП может вызвать опасное увеличение часто--ты желудочкового ритма у больных с ФП и привести к выраженной тахика-рдии, переходящей в фибрилляцию желудочков (ФЖ). Очень высокая ЧСС (200 в мин и более) свидетельствует о наличии ДПП. Препараты, увеличи-вающие рефрактерный период и замедляющие проведение через АВУ (сердечные гликозиды, верапамил, дилтиазем) не влияют на проведение по ДПП и могут вызвать увеличение частоты желудочкового ритма, со-ответственно в данной ситуации эти препараты противопоказаны.
ФП может сочетаться с ТП или предсердной тахикардией. При ТП наЭКГ определяются пилообразные регулярные зубцы F, которые лучше видны в отведениях II, III, aVF и VI. Частота предсердных зубцов составляет 240-320 в мин. В отведениях II, III, aVF зубцы F являются инвертированными, а вVI - положительными. ТП может перейти в ФП и наоборот. Очаговые предсердные тахикардии и узловые тахикардии по типу re-entry могут индуцировать развитие ФП. В этих случаях обычно опреде-ляются зубцы Р, морфология которых позволяет определить происхождение аритмии.
Патофизиологические изменения, развивающиеся вследствие ФП.
Фармакологическая или электрическая кардиоверсия болееэффективна, если ФП сохраняется менее 24 ч., в то время как длительное сохранение аритмии снижает вероятность восстановления синусового ритма. На этом основании был сделан вывод о том, что «фибрилляция предсердий, сохраняет фибрилляцию предсердий». В эксперименте на овцах, когда использовали автоматическую электростимуляцию предсердий, которая вызывала развитие ФП при спонтанном восстановлении ритма, то первоначально пароксизмы проходили самостоятельно. Однако повторные эпизоды аритмии становились все более продолжительными. В конечном итоге ФП персистировала и сопровождалась более высокой активацией предсердий. Увеличение длитель-ности эпизодов ассоциировалось с нарастающим укорочением эффективного рефрактерного периода. Этот феномен называют электрофизиологическим ремоделированием. В первые несколько дней после развития ФП отмечаются изменения электрофизиологических свойств предсердий, происходит укоро-чение эффективного рефрактерного периода. Электрическое ремоделирова-ние способствует сохранению ФП в течение первых дней.
Нарушается также и сократительная функция предсердий. Основными клеточными механизмами сократительной дисфункции считают снижение поступления ионов кальция в клетки, нарушение выделения ионов кальция из внутриклеточных депо и нарушение обмена энергии в миофибриллах. Для нормализации сократимости предсердий может потребоваться от нескольких дней до нескольких недель после восстановления ритма.
Рисунок 3
Основные электрофизиологические механизмы развития ФП.
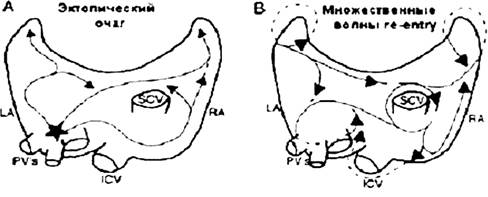
ФП. (А) Эктопическая активация. Триггер (обозначен звездочкой)часто находится в области легочных вен. (В) Циркуляция возбуждения (re-entry). LA - левое предсердие
RA - правое предсердие, PVs - легочная вена, ICV - нижняя полая вена, SCV -верхняя полая вена
Рисунок 4
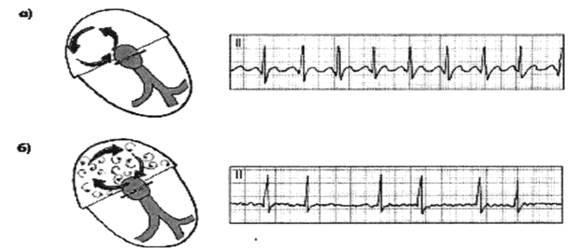 Схема возникновения круговой волны возбуждения (re-entry)при трепетинаа и фибрилляции предсердий
Схема возникновения круговой волны возбуждения (re-entry)при трепетинаа и фибрилляции предсердий
Возникновение круговой волны re-entry при трепетании (а) и фибрилляции
(б) предсердий. Справа — ЭКГ, типичные для этих нарушений ритма.
2.3 Факторы, предрасполагающие к развитию фибрилляции предсердий
1. Электрофизиологические нарушения: повышенный автоматизм, нарушения проводимости (re-entry).
2. Повышение давления в предсердиях: порок митрального или трикуспи-дального клапанов, поражение миокарда (первичное или вторичное; приводя-щее к нарушению систолической или диастолической функции), изменения полулунных клапанов (вызывают гипертрофию желудочков), системная или легочная гипертония (тромбоэмболия легочной артерии), внутрисердечные опухоли или тромбы.
3. Ишемия предсердий: ишемическая болезнь сердца.
4. Воспалительные или инфильтративные заболевания предсердий: перикар-дит, амилоидоз, миокардит, возрастные фиброзные изменения.
5. Лекарства, алкоголь, кофеин.
6. Эндокринные нарушения: гипертиреоз, феохромоцитома, ожирение. Ожирение является важным ФР развития ФП. Увеличение риска связывают с дилатацией ЛП. По мере возрастания индекса массы тела наблюдается увеличение диаметра ЛП, а изменения массы тела ассоциировались с регрессом дилатации предсердия. Эти данные указывают на наличие физи-логической связи между ожирением, ФП и инсультом, а также позволяют предположить, что снижение массы тела может привести к уменьшению риска, ассоциирующегося с ФП.
7. Изменения вегетативной нервной системы: снижение активности парасим-атической системы, повышение активности симпатической системы. Измене-ия активности вегетативной нервной системы вызывает колебания частоты желудочкового ритма.(снижение во время сна и увеличение при физической нагрузке.
8. Первичные опухоли или метастазы в стенку предсердий.
9. Операции на сердце, легких или пищеводе.
10. Врожденные пороки сердца.
11. Нейрогенные факторы: субарахноидальное кровоизлияние, негеморра-гический инсульт.
12. Идиопатическая (изолированная) ФП. Примерно 30-45% случаев пароксизмальной ФП и 20-25% случаев персистирующей ФП наблюдаются у молодых людей, без заболевания сердца. У части больных с изолированной или семейной ФП со временем появляются признаки заболевания сердца. Хотя ФП может развиться у пожилых людей без симптомов заболевания сердца, ее причиной считают повышение жесткости мышцы сердца. В то же время заболевания сердца у пожилых людей могут быть не связаны с ФП.
13. Семейная ФП. Семейная ФП, наблюдающаяся у членов одной семьи встречается чаще, чем считалось ранее, однако ее следует отличать от других генетических заболеваний, таких как семейные кардиомиопатии. Вероят-ность развития ФП повышена у детей больных с ФП. Молекулярные дефек-ты, лежащие в основе семейной ФП, не установлены. Наличие связи ФП с определенными локусами хромосом в некоторых семьях указывает на роль генетических мутаций. ФП может встречаться при синдроме удлинен-ого QT, гипертрофической кардиомиопатии, при мутации гена натрийуретического пептида, мутациях гена натриевых каналов сердца и др.
2.4 Классификация ФП
Клиницист должен распознать впервые выявленный приступ ФП,
действительно ли он сопровождается симптомами, оканчивается ли
самостоятельно. При этом необходимо учитывать, что определить реальную длительность пароксизма удается не всегда. Кроме того, ему могут
предшествовать диагностированные пароксизмы ФП. Когда у больного
было 2 или больше приступа, ФП считают рецидивирующей. Если аритмия
заканчивается спонтанно, рецидив ФП называется пароксизмом, а форма -
пароксизмальной; когда аритмия продолжается более 7 дней, ФП называется
персистирующей.
Впервые выявленная ФП может быть пароксизмальной или
персистирующей. Категория персистирующей ФП также включает случаи
длительной ФП (например, больше чем 1 год), когда кардиоверсия не была
показана или не была предпринята, обычно это приводит к хронической ФП.
Эти варианты ФП не являются взаимоисключающими. У одного и того же
пациента могут наблюдаться несколько эпизодов пароксизмальной ФП и
отдельные эпизоды персистирующей или наоборот. Целесообразно
определять тип ФП на основании более частых эпизодов аритмии.
С учетом течения и длительности аритмии выделяют несколько типов ФП: впервые выявленная ФП, этолюбой первый эпизод независимо от длительности симптомов, пароксизмальная ФП, когда синусовый ритм восстанавливается самостоятельно, обычно в течение 48 ч. (более указан-ного срока вероятность спонтанной кардиоверсии низкая и необходимо решить вопрос о возможности антикоагуляции); персистирующая ФП, когда длительность эпизода превышает 7 дней, при этом для восстановления необходима медикаментозная или электрическая кардиоверсия; длительно персистирующая ФП, если персистирующая ФП продолжается ≥ 1 года и выбрана стратегия контроля ритма; постоянную ФП диагностируют, когда считается возможным сохранение аритмии, и кардиоверсия не проводится (если предполагается восстановление ритма, то аритмию называют «дли-тельно персистирующей»). Первым проявлением бессимптомой аритмии могут быть осложнения (ишемический инсульт или тахикардиомиопатия). Бессимптомные формы возможны при любой форме  аритмии.
аритмии.
| Рисунок 5 Варианты фибрилляции предсердий |
1. Эпизоды аритмий, сохраняющиеся обычно <7 дней (чаще < 24 ч);
2. Эпизоды обычно продолжаются более 7 дней;
3. Или длительно персистирующая, когда кардиоверсия оказалась неэффективной или не проводилась;
4. Пароксизмальнаяк и персистирующая ФП может рецидивировать.
Приведенная классификация используется для обозначения эпизодовП длительностью более 30с, не связанных с обратимыми причинами. Вторичную ФП, развивающуюся при ОИМ, операциях на сердце, перикардите, миокардите, гипертиреозе или острых заболеваниях легких, рассматривают отдельно. В этих случаях ФП не является первичной проблемой, а лечение основного заболевания обычно приводит к восстановлению синусового ритма. Однако если ФП возникает на фоне компенсированного гипотиреоза, то используют общую классификацию. Изолированной называют ФП, возникающую у пациентов в возрасте моложе 60 лет, у которых отсутствуют клинические или эхокардиографические признаки заболеваний сердцах. В таких случаях риск ТЭ осложнений и смерти низкий. Со временем риск ТЭ или смерти увеличивается, что может быть следствием старения или появления изменений сердца. Термином неревматическая (неклапанная) ФП обозначают случаи ФП, не связанной с ревматическим пороком сердца, протезированными клапанами сердца или восстановительными операциями на клапанах.
ГЛАВА 3. ГЕМОДИНАМИЧЕСКИЕ ПОСЛЕДСТВИЯ ФИБРИЛЛЯЦИИ ПРЕДСЕРДИЙ
К факторам, оказывающим влияние на гемодинамику при ФП, относятся:
ü утрата систолы предсердий;
ü нерегулярные сокращения желудочков;
ü тахикардия и нарушение коронарного кровотока.
Внезапное нарушение координированной механической функции предсердий при ФП приводит к снижению ФВ на 5-15%. Отсутствие систолы предсердий может привести к значительному снижению сердечного выброса, особенно при нарушении заполнения желудочка в диастолу (при сниженной податливости желудочков при митральном стенозе, АГ, гипертрофической или рестриктивной кардиомиопатии), когда сокращение предсердий вносит значительный вклад в наполнение желудочков. Сократимость миокарда при ФП не является постоянной в связи с наличием зависимости между силой сокращения и длительностью сердечного цикла. У больных с персис-тирующей ФП средние объемы левого и правых предсердий со временем увеличиваются, а восстановление и сохранение синусового ритма приводит к их уменьшению. При ЧПЭхоКГ продемонстрировано восстановление сократимости ЛП и скорости кровотока после кардиоверсии, что указывает на обратимость предсердной кардиомиопатии. Хотя можно предположить, что восстановление синусового ритма должно улучшать другие гемодинамические нарушения, характерные для ФП, это не всегда так.
Высокая частота желудочкового ритма сопровождается нарушением наполнения желудочков вследствие сокращения диастолы. Стойкое увеличе-ние частоты желудочкового ритма при ФП более 120-130 в мин. может выз-вать нарастание митральной регургитации и развитие дилатационной кардио-миопатии (кардиомиопатии, индуцированной тахикардией). Важно распознавать эту форму кардиомиопатии, при которой ХСН является не причиной, а следствием ФП, а контроль желудочкового ритма может при-вести к обратному развитию поражения миокарда. Предложены различные гипотезы, объясняющие развитие кардиомиопатии, индуцированной тахикар-дией, однако точный патогенез ее не установлен.
3.1 Тромбоэмболии, патофизиология и клиническое значение
Хотя ИИ и окклюзию артерий большого круга кровообращения у больных с ФП обычно связывают с ТЭ из левого предсердия, патогенез ТЭ сложен. Причиной инсульта у больных с ФП в 25% случаев могут быть поражение церебральных сосудов, другие источники эмболий или атеро-матозные изменения проксимального отдела аорты. Риск развития инсульта у больныхс ФП составляет 3-8% в год и зависит от наличия других факторов риска. Примерно у половины пожилых больных с ФП имеется АГ (основной фактор риска цереброваскулярной болезни), а у 12% - стеноз каротидной артерии. Частота атеросклероза сонных артерий у больных с ФП и инсультом существенно не отличается от таковой у больных без ФП, а этот фактор риска, по-видимому, имеет не очень большое значение.
Образование тромба, которое является следствием стаза крови в ушке ЛП, читают основной причиной ТЭ у больных с ФП (≥ 90%). Внутри-сердечные тромбы не всегда удается выявить с помощью трансторакальной ЭхоКГ, а ЧПЭхоКГ является более чувствительным и специфичным методом анализа функции ушка ЛП и диагностики тромбов. Результаты ЧПЭхоКГ в динамике во время кардиоверсии продемонстрировали снижение скорости кровотока в ушке ЛП в результате утраты систолы предсердия при ФП. У больных с ФП, перенесших инсульт, тромбы обнаруживают чаще, чем у больных без инсульта. Хотя предполагается, что тромбообразование проис-ходит, если ФП сохраняется в течение, по крайней мере, 48 ч, тем не менее, при ЧПЭхоКГ тромбы обнаруживали и через более короткий срок. Повыше-ние риска ТЭ после успешной кардиоверсии (электрической, фармакологи-ческой или спонтанной) может быть следствием оглушения миокарда ушка ЛП. Оно наиболее выражено непосредственно после кардиоверсии; улучше-ние транспортной функции предсердий обычно происходит в течение нес-кольких дней, хотя иногда для этого требуется 3-4 нед. в зависимости от длительности ФП. Известно, что более 80% ТЭ после кардиоверсии регистрируются в первые 3 дня и почти все - в течение 10дней. С помощью ЧПЭхоКГ подтверждено растворение тромбов у большинства больных. Динамический характер дисфункции ЛП после кардиоверсии послужил основанием для антикоагуляции, которую продолжают в течение нескольких недель до и после восстановления синусового ритма. Хотя оглушение мио-карда может быть менее выраженным при определенных состояниях или при короткой продолжительности ФП, однако антикоагуляцию рекомендуется проводить во время кардиоверсии и в течение, по крайней мере, 4 нед. после нее у всех больных, у которых длительность ФП составляет более 48 ч или неизвестна, включая пациентов с изолированной ФП (если нет противо-показаний). Скорость кровотока в ушке ЛП при ТП обычно ниже, чем при синусовом ритме, но выше, чем при ФП. Однако неясно, позволяет ли это объяснить пониженную частоту тромбо-образования и ТЭ при ТП. При этой аритмии, как и при ФП, после кардиоверсии наблюдается замедленное опорожнение ушка ЛП, что создает угрозу развития ТЭ и является основанием для антикоагуляции. Развитие ТЭ при ФП является следствием сложного взаимодействия различных факторов, включая стаз крови, эндоте-лиальную дисфункцию, системную и возможно локальную гиперкоагуляцию. Тесная ассоциация между АГ и инсультом у больных с ФП, возможно, опосредуется ТЭ из ушка ЛП, однако АГ повышает также риск эмболий из других источников. Важное значение имеет изучение вопроса о том, может ли лечение АГ привести к снижению риска развития ИИ у больных с ФП. Возрастное повышение риска инсульта у больных с ФП также является ре-зультатом различных факторов. Пожилой возраст - это ФР атеросклероза, а образование бляшек в дуге аорты может привести к инсульту независимо от ФП. Неблагоприятное значенивозраста повышается при наличии других факторов риска, таких как АГ или женский пол. Риск инсульта особенно высокий при наличии ФП у женщин в возрасте старше 75 лет. Систолическая дисфункция ЛЖ позволяет предсказать развитие ИИ у больных с ФП, не получающих антитромботические средства, но не у больных группы сред-него риска, принимающих аспирин.
ГЛАВА 4. КЛИНИЧЕСКИЕ ПРОЯВЕНИЯ ФИБРИЛЛЯЦИИ ПРЕД-СЕРДИЙ
ФП может проявляться сердцебиением, вызывает нарушения гемоди-намики и тромбоэмболические осложнения или протекает бессимптомно. Результаты мониторирования ЭКГ свидетельствуют о том, что у одного и то-го же больного эпизоды ФП могут сопровождаться или не сопровождаться клиническими симптомами. Со временем сердцебиения могут исчезнуть, поэтому у больных с постоянной аритмией клинические проявления иногда отсутствуют. Это особенно характерно для пожилых людей. У некоторых пациентов симптомы возникают только при пароксизмальной ФП или появляются на время при устойчивой аритмии.
Симптомы ФП зависят от правильности и частоты желудочкового ритма, состояния сердца, длительности ФП и индивидуальных факторов. Первым проявлением ФП могут быть тромбоэмболия или нарастание СН, однако большинство больных жалуются на учащенное сердцебиение, боль в груди, одышку, утомляемость, головокружение или обморок. Полиурия мо-жет быть следствием секреции предсердного натрийуретического фактора, особенно при восстановлении синусового ритма. ФП, сопровождающаяся стойким увеличением частоты желудочкового ритма, может привести кразвитию кардиомиопатии, индуцированной тахикардией, особенно у боль-ных, которые не знают о существовании аритмии. Обморок – это нечастое осложнение, которое может развиться при восстановлении ритма убольных с дисфункцией синусового узла или на фоне частого желудочкового ритма у больных гипертрофической кардиомиопатией, стенозом аортального отвер-стия или синдромом преждевременного возбуждения.
Качество жизни у больных с ФП качество жизни значительно ухуд-шается по сравнению с пациентами того же возраста. Устойчивый синусовый ритм сопровождается улучшением качества жизни и переносимости физи-ческой нагрузки, хотя этот эффект был подтвержден не во всех иссле-дованиях.
Большинство больных с пароксизмальной ФП отмечали, что аритмия оказывает влияние на образ жизни, хотя их ощущения не зависели от частоты или длительности клинически явных эпизодов аритмии.
Обследование пациентов с мерцательной аритмией
1. Анамнез и физикальное обследование. Диагноз ФП должен быть подтвержден с помощью ЭКГ или амбулаторного холтеровского монито-рирования. При наличии ФП необходимо определить, является ли она па-роксизмальной или персистирующей, установить причину и выявить сопут-ствующие заболевания сердца, которые могут способствовать развитию аритмии. Обследование обычно проводят в амбулаторных условиях, за исключением случаев, когда НРС не документировано и необходимо наблю-дение за пациентом. Физикальное обследование позволяет заподозрить ФП при наличии неритмичной пульсации. Диагноз ФП должен быть подтвержден на ЭКГ, по крайней мере, в одном отведении. У больных с имплантированными водителями ритма или дефибрилляторами наличие диагностических функций или функции памяти у прибора позволяет автоматически регистрировать аритмию.
2. Инструментальные методы и лабораторные методы.
Рентгенографию грудной клетки проводят для исключения заболеваний легких и легочных сосудов. По крайней мере, однократно следует провести исследования функции щитовидной железы, почек и печени, анализ крови измерить сывороточные уровни электролитов. Всем больным необходимо проводить двухмерную допплеровскую ЭхоКГ для измерения размеров левых предсердия и желудочка, толщины стенки ЛЖ и его функции, а также для исключения порока клапанов сердца, заболевания перикарда и ГКМП. Трансторакальная ЭхоКГ редко позволяет выявить тромбы в ЛП или ушке ЛП. Следующие изменения при ЧПЭхоКГ ассоциируются с развитием ТЭ у больных с неревматической ФП: тромб, эхоконтрастные тени, снижение скорости кровотока в ушке ЛП и атероматозные изменения аорты. Однако необходимы проспективные исследования с целью сравнения перечисленных изменений с клиническими и эхокардиографическими предикторами ТЭ. Наличие тромба в ЛП или ушке ЛП у больных с инсультом или системной эмболией убедительно подтверждает их кардиогенное происхождение.
3. Дополнительные исследования.
Могут быть выполнены один или несколько тестов: проба с 6-минутной ходьбой, если вызывает сомнения адекватность контроля частоты желудоч-кового ритма; проба с физической нагрузкой, если вызывает сомнение адекватность контроля частоты желудочкового ритма (стойкая ФП), с целью воспроизведения ФП, индуцированной физической нагрузкой, для исклю-чения ишемии перед назначением антиаритмического препарата.Хотеровское мониторирование с целью оценки адекватности контроля частоты желудочкового ритма. Электрофизиологическое исследование дляуточнения механизма тахикардии с широкими комплексами QRS, для идентификации другой аритмии, такой как ТП трепетание предсердий илипароксизмальной наджелудочковой тахикардии. Более ранняя диагностика позволила бы своевременно назначить терапию и предотвратить не только последствия аритмии, но и прогрессирование с развитием рефрактерной аритмии.
ГЛАВА 5. МЕТОДИЧЕСКИЕ РЕКОМЕНДАЦИИ ПО ЛЕЧЕНИЮ МЕРЦАТЕЛЬНОЙ АРИТМИИ
Американский колледж кардиологии (АСС) и Американская кардиологическая ассоциация (AHA) совместно занимаются разработкой методических рекомендаций в области сердечнососудистых заболеваний с 1980г. Большой честью для членов специального комитета является то, что вразработке этих рекомендаций с 2001г. участвует Европейское кардиологи-ческое общество (ESC). Данный документ редактируется рецензентами и ежегодно пересматривается рабочей группой. Эксперты тщательно анализи-руют научную литературу, при обсуждении методов фармакотерапии исполь-зуются результаты клинических исследований лекарственных средств, заре-гистрированных в Северной Америке и/или Европе. В конце августа 2010г. на Конгрессе ESC, проходившего в Стокгольме были представлены новые рекомендации по ведению больных с ФП. В отличие от предыдущих Рекомендаций (2001г. и 2006г.) эти рекомендации исключительно Европейские. В Европе и США для лечения пациентов разрешены различные препараты и по сравнению с Европой в США работает значительно больше врачей кардиологов и электрофизиологов, поэтому Европейские рекоменда-ции ориентированы и на врачей общей практики и семейных врачей.
В целом тактика ведения больных с ФП не требует значительной адаптации для России, но есть некоторые особенности. В России отсутствует ряд лекарственных препаратов, которые приводятся в рекомендациях (1Сфлекаинид и III класс дофетилид, ибутилид). В рекомендациях не приводятся такие отечественные препараты как нибентан и этацизин. По мнению некоторых отечественных авторов, в России вместо ибутилида для внутривенной кардиоверсии при ФП, по видимому можно использовать нибентан, эффективность и безопасность которого не изучалась в крупных рандомизированных клинических испытаниях. Ввиду отсутствия в России полного спектра ААП, приводимых в рекомендациях, выбор препарата для кардиоверсии в России может ограничиваться амиодароном (в/в и per os), нибентаном (в/в), прокаимидом (в/в) и пропафеноном (в/в и per os).В лечении больных с ФП выделяют три цели:
1) контроль ЧСС;
2) профилактика тромбоэмболий;
3) контроль ритма.
Многочисленные клинические исследования показали, что стратегия контроля синусового ритма не имеет преимуществ перед контролем частоты желудочкового ритма. Более строгий контроль частоты желудочкового ритма также не давал дополнительного эффекта. Результаты рандомизированных исследований, в которых сравнивались исходы стратегий контроля ритма и ЧСС у больных с ФП: в исследовании AFFIRM не было выявлено разницы смертности или частоты инсульта на фоне использования двух стратегий; в исследовании RACE контроль ЧСС не уступал стратегии контроля ритма по эффективности в профилактике смерти и осложнений ССЗ. Данные о влия-нии антиаритмических и хронотропных средств на качество жизни не одно-значны. В исследованиях AFFIRM, RACE, PIAF и STAF не было выявлено разницы качества жизни на фоне контроля ЧСС или ритма. Контроль ритма в исследованиях PIAF и НОТ CAFE обеспечивал улучшение толерантности к физической нагрузке по сравнению с таковой на фоне контроля ЧСС, однако это не привело к улучшению качества жизни. Новые подходы к антиаритми-ческой терапии могут привести к улучшению результатов лечения.
В первую очередь следует выбрать первичную стратегию лечения - контроль ЧСС или ритма. Если выбрана первая стратегия, то не предпринимаются меры, направленные на восстановление и/или удержание синусового ритма. Независимо от выбранной стратегии - контроль ЧСС или ритма — необходимо также использовать антитромботические средства для профилактики ТЭ. В лечении используют фармакологические и нефармакологические методы лечения. Лекарственные средства и аблация позволяют контролировать как ЧСС, так и ритм. В определенных ситуациях хирургическое вмешательство имеет преимущества. Необходимость в антикоагуляции зависит от риска развития инсульта, а не сохранения синусового ритма. Если планируется контроль ритма, то лечение обычно начинают с лекарственных средств, а аблацию рассматривают как метод вто-рой линии, особенно у больных с изолированной ФП. У некоторых больных, особенно молодых людей, у которых ФП сопровождается выраженными сим-птомами и необходимо удержание синусового ритма, радиочастотная абла-ция имеет преимущества перед многолетней антиаритмической терапией. Уникальная возможность аблации возникает у больных с ФП, которым пла-нируется выполнение операции на сердце. Операция "лабиринт" или аблация левого предсердия могут быть дополнением к аортокоронарному шунтирова-нию или операциям на клапанах сердца и позволяют предупредить рецидив ФП после хирургического вмешательства. Тромбы в 95%случаев образуются в ушке левого предсердия, поэтому эту структуру обычно исключают из циркуляции во время кардиохирургических вмешательств у больных группы риска развития послеоперационной ФП, хотя не доказано, что эта мера эффективна в профилактике инсульта. Если планируется кардиоверсия, а длительность ФП не известна или превышает 48 ч, то больным, не нужда-ющимся в длительной антикоагулянтной терапии, может быть проведена кратковременная антикоагуляция. Если контроль ЧСС не приводит к адек-ватному симптоматическому эффекту, то очевидной целью лечения является восстановление синусового ритма. Ранняя кардиоверсия может оказаться необходимой, если ФП сопровождается артериальной гипотонией или деком-пенсацией ХСН. И наоборот, уменьшение симптомов на фоне контроля ЧСС у пожилых пациентов может послужить основанием для отказа от попыток восстановления синусового ритма. В некоторых случаях, когда причиной ФП являются обратимые состояния, например, тиреотоксикоз или операция на сердце, длительная терапия может не потребоваться.
Бессимптомные рецидивы ФП у больных, получающих антиарит-мические средства, могут быть причиной ТЭ осложнений после прекращения антикоагуляции. В связи с этим у больных с высоким риском инсульта может быть необходима антикоагулянтная терапия независимо от выбранной стратегии лечения, хотя дизайн исследования AFFIRM не позволил получить ответ на этот вопрос. Вторичный анализ подтверждал эту гипотезу, однако частота инсульта на фоне стратегии контроля ритма у больных, прекрат-ивших прием варфарина, осталась неопределенной, поэтому необходимы до-полнительные исследования для изучения этой важной проблемы. Уменьше-ние симптомов было отмечено после выполнения операции «лабиринт» у больных с ФП. Однако у больных с одинаковым состоянием здоровья ка-чество жизни может быть совершенно разным, поэтому лечение следует под-бирать индивидуально с учетом характера, выраженности и частоты сим-птомов, предпочтения больного, сопутствующих заболеваний и ответа на лечение. В зависимости от наличия симптомов контроль ЧСС может быть приемлемой первичной стратегией лечения у пожилых больных с персис-тирующей ФП, страдающих АГ или заболеванием сердца. У молодых людей, особенно с изолированной пароксизмальной ФП, может оказаться предпочтительной стратегия контроля ритма. Часто используют препараты, которые одновременно оказывают антиаритмическое и хронотропное дей-ствие. При отсутствии ответа на антиаритмическую терапию возможным ме-тодом контроля синусового ритма является катетерная аблация. У больных с ФП частота желудочкового ритма может резко возрастать при физической нагрузке, даже на фоне адекватного контроля ЧСС в покое. Улучшение внутрижелудочкового проведения и снижение частоты желудочкового ритма не только обеспечивает адекватное заполнение желудочков и позволяет избежать ишемии миокарда, связанной с тахикардией, но и может привести к улучшению гемодинамики. Может оказаться полезным измерение ЧСС при субмаксимальной или максимальной физической нагрузке или монитори-рование ее в течение длительного срока (с помощью холтеровского метода). Критерии адекватности контроля ЧСС были выбраны преимущественно на основании кратковременных гемодинамических эффектов и недостаточно изучены с точки зрения влияния на правильность желудочкового ритма, качество жизни, симптомы или риск развития кардиомиопатии. Критерии контроля ЧСС зависят от возраста больного. Обычно считают целесообраз-ным добиваться снижения ЧСС до60-80 в минуту в покое и до 90-115 в минуту при умеренной физической нагрузке. Больным, у которых ФП сопро-вождается клиническими симптомами и тахикардией, необходимо немедлен-но начать лечение, а приналичии АГ, стенокардии или СН следует обсудить целесообразность кардиоверсии. Стойкая неконтролируемая тахикардия мо-жет привести кухудшению функции желудочков (кардиомиопатия, индуцированная тахикардией), которая улучшается на фоне адекватного кон-троля ЧСС. Кардиомиопатия, вызванная тахикардией, подвергается обратно-му развитию в течение 6 мес на фоне контроля ритма или ЧСС. Если тахикардия возобновляется, то ФВ ЛЖ снижается, а ХСН развивается быс-трее и сопровождается относительно неблагоприятным прогнозом).
6.1 Фармакологическая кардиоверсия
Фармакологическую кардиоверсию проще выполнить, чем электрическую. Однако она менее эффективна, чем электрическая, кроме того, существенна опасность токсических побочных эффектов ААП.
Фармакологическая кардиоверсия наиболее эффективна, если выполняется впервые 7 дней.
Эксперты АКК/ААС/ЕКО рекомендуют при МА, длящейся менее 7 дней,применять следующие препараты (по мере убывания эффективности):
· ПРОПАФЕНОН внутрь или в/в (1А класс рекомендаций);
· АМИОДАРОН внутрь или в/в (IIа, А класс рекомендаций);
· ХИНИДИН внутрь (IIа, В класс рекомендаций).
ААП, эффективность которых не доказана или недостаточно изучена:
· Прокаинамид в/в (IIb, С класс рекомендаций);
· Дигоксин внутрь или в/в (III А класс рекомендаций);
· Соталол внутрь или в/в (IIIA класс рекомендаций).
При МА, длящейся более 7 дней, эксперты ААС/АКК/ЕКО рекомендуют (по мере убывания эффективности):
· АМИОДАРОН внутрь или в/в (II а, А класс);
· ПРОПАФЕНОН внутрь или в/в (II b, В класс);
· ХИНИДИН внутрь (II b, В класс).
ААП, эффективность которых не доказана или недостаточно изучена:
· Прокаинамид в/в (IIb, С класс рекомендаций);
· Соталол внутрь или в/в (III А класс рекомендаций);
· Дигоксин внутрь или в/в (III С класс рекомендаций).
38% больных восстанавливают ритм через 12 часов после введенияплацебо при МА, длящейся менее 7 дней. При МА, длящейся более 7 дней,плацебо восстанавливает ритм только в 3-4%.
Пропафенон. При приеме внутрь 450-600 мг (3-4 т) однократно, вос-становление ритма в 40-80% случаев. При введении в/в 1.5-2.0 мг/кг за 10-20мин. Более эффективен при ФП и несколько менее при ТП. Возможно менее эффективен у больных со структурным поражением сердца. Эффект наступает между 2 и 6 часами после приема внутрь, при в/в введении быстрее.
Тяжелые побочные эффекты встречаются нечасто, однако они включают развитие ТП с быстрым желудочковым ритмом, ЖТ, нарушения внутрижелудочковой проводимости, гипотонию, брадикардию в моментвосстановления синусового ритма.
Препарат следует назначать с осторожностью или не назначать вообще больным с органическими заболеваниями сердца. Не рекомендуется назначать больным с тяжелой ХСН или обструктивными заболеваниями легких.
Амиодарон восстанавливает синусовый ритм более чем через 12 часов почти у 80% больных. Препарат может назначаться в/в, внутрь и двумя путями одновременно. Препарат действует медленнее, чем другие препараты. Применяется несколько вариантов быстрого насыщения амиодароном для восстановления синусового ритма.
Вне стационара - прием внутрь 600-800 мг/сут до общей дозы 10 г за несколько дней, затем по 200-400 мг/сут.
В стационаре возможен прием per os 30 мг/кг однократно (постепенный прием таблеток), восстановление ритма через 8 часов после приема пос-ледней таблетки у 87% больных. Или (в стационаре) - 1.2-1.8 г в день в несколько приемов внутрь до общей дозы 10 г за несколько дней, затем по 200-400 мг/сут.
При в/в введении амиодарон вводят в дозе 5-7 мг/кг за 30-60 мин, затем по 1.2-1.8 г в день в виде непрерывной инфузии в/в или в несколько приемов внутрь по 1.2-1.8г/сут до общей дозы 10 г за несколько дней, затем внутрь по 200-400 мг/сут. Одинаково эффективен при ФП и ТП.
Побочные эффекты — брадикардия, гипотония, расстройства зрения, тошнота, запор после приема внутрь, флебит после введения препарата в периферическую вену.
Прокаинамид (новокаинамид) — используется для восстановления РИТМА у больных с эпизодом МФ длительностью не более 24 часов. Прокаинамид, по-видимому, менее эффективен чем другие ААП, Кроме того, его эффективность при персистирующем МП изучена недостаточно. Гипотония, — главный побочный эффект. В связи с этим препарат вводят очень медленно внутривенно 20-30 мг/мин до общей дозы 1000 мг. Если ЧСС при МП более 120 в мин, то предварительно вводят препараты, уменьша-ющие ЧСС (обзидан 0,1 мг/кг со скоростью 1 мг/мин или дигоксин).
6.2 Электрическая кардиоверсия
Наиболее успешна ЭКВ при продолжительности эпизода МА менее 1 года, молодом возрасте пациента, при ТП. Факторами риска неудачной ЭКВ являются дилатация ЛП, органическое заболевание сердца и кардиомегалия. Эксперты ACC/AHA/ESC при проведении электрической кардиоверсии (ЭКВ) рекомендуют переднезаднее расположение электродов, что более
эффективно (87% против 76%) и требует разряда меньшей мощности. ЭКВ выполняется под общим наркозом, для которого лучше использовать препараты для кратковременного наркоза или седативные средства. Электрический разряд синхронизируют с зубцом "R" на ЭКГ. Начальный разряд для лечения ТП составляет 50 Дж. При ФП требуется более мощный начальный разряд — 200 Дж. Мощность последующих разрядов повышаютна 100 Дж до тех пор, пока не достигнут максимальной мощности в 400 Дж.Чтобы свести к минимуму повреждение миокарда, интервал между последовательными разрядами должен быть не менее 1 мин. Начиная медикаментозную терапию до ЭКВ, можно повысить вероятность немедлен-ного успеха и подавить ранние рецидивы МП. Предварительная фармакоте-рапия наиболее обоснована у больных с неудачной первоначальной попыт-кой ЭКВ, а также у тех, кому первоначальную ЭКВ проводили в связи с персистирующим МП. Предварительную медикаментозную терапию можно начинать вне стационара (амиодарон, соталол, бета-адреноблокаторы) и в стационаре (хинидин, прокаинамид, дизопирамид, пропафенон).
Опасности предварительной медикаментозной терапии включают возмож-ность парадоксального повышения порога дефибрилляции (флекаинид) и ускорение желудочкового ритма в начале терапии ААП IA или 1С под-классов.
В случае восстановления ритма после ЭКВ больные, получающие ААП,
которые удлиняют интервал Q-T (амиодарон, соталол), должны оставаться
под наблюдением в стационаре не менее 1-2 суток, чтобы можно было
оценить эффекты замедления ритма сердца и своевременно вмешаться, если
разовьется ЖТ типа "пируэт".
Пропафенон, назначаемый за 2 дня до ЭКВ, подавляет немедленные
рецидивы МА (в течение первых 10 мин).
Пропафенон в комбинации с верапамилом (3 дня до и 3 дня после ЭКВ)
предупреждает возникновение немедленных и подострых рецидивов.
Амиодарон и соталол, по-видимому, также эффективны в случаях первона-чальной неэффективной ЭКВ.
Добавление магния, также повышает эффективность ЭКВ. Насыщающая доза хинидина (1200 мг за 24 часа до ЭКВ) у больных с персистирующим пароксизмом МА значимо повышает эффективность ЭКВ (снижение числа разрядов и их мощности).
6.3 Осложнения при ЭКВ
1. Тромбоэмболии (ТЭ) наблюдаются у 1-7% больных, которые до ЭКВ
не получали профилактической антитромботической терапии и МА,
продолжающейся более 48 часов. Риск ТЭ сохраняется в течение 1 месяца
после кардиоверсии.
2. Опасные НРС (ЖТ, ФЖ) могут провоцироваться у больных с гипо- калиемией или дигиталисной интоксикацией. Для безопасной и эффективной
ЭКВ требуется нормальный уровень калия. При клинических и ЭКГ
признаках передозировки гликозидов необходимо отложить ЭКВ до исчезно-вения признаков дигиталисной интоксикации не менее чем на 24 часа. При отсутствии признаков передозировки гликозидов нет необходимости отме-нять дигоксин перед плановой кардиоверсией. Если у больного до ЭКВ заре-гистрирован медленный желудочковый ритм (в отсутствии лекарственных препаратов) необходимо профилактическое введение трансвенозного или чрескожного электрода для временной ЭКС.
3. Возможно возникновение преходящей элевации сегмента ST, а также
острой левожелудочковой недостаточности, гипотонии.
6.4 Показания для восстановления ритма методом ЭКВ и/или ФКВ.
Класс I (безусловные рекомендации)
- немедленная ЭКВ у больных с пароксизмальной МА и быстрым желудоч-ковым ритмом (более 150 в мин.), у которых имеются ЭКГ-признаки
ОИМ или симптомная гипотония, стенокардия или сердечная недостаточ-ность, которая не реагирует на фармакологические вмешательства.
- ЭКВ у больных без нестабильной гемодинамики, когда симптомы ФП
плохо переносятся.
Класс IIA (больше «за» чем «против»)
- ФКВ или ЭКВ для быстрого восстановления синусового ритма у больных с
впервые выявленным эпизодом ФП.
- ЭКВ у больных с персистирующей ФП, если рецидив маловероятен.
- повторная ЭКВ после предварительной фармакотерапии у больных с реци-дивом ФП, наступившим при отсутствии профилактической теарпии ААП, если первая ЭКВ была успешна.
Класс IIB (больше «против» чем «за»)
ФКВ при персистирующей ФП.
Подготовка больных к кардиоверсии.
После ЭИТ спонтанное контрастирование в ЛП появляется и нарастает
в 35 % случаев, что является следствием "оглушения" предсердий при ЭИТ.
В связи с этим непрямые антикоагулянты (НАК) должны применяться не
менее чем 3 недели до и 4 недели после кардиоверсии под контролем MHO
(2-3 для пациентов в возрасте до 75 лет, 1.5-2.5 для больных 75 лет и старше). Непосредственно перед ЭКВ больному проводят ЧпЭХО-КГ. Если при ЧпЭхоКГ не обнаруживают тромбы или феномен спонтанного контрасти-рования в полости ЛП, то проведение ЭКВ возможно. Если при ЧпЭХО-КГ обнаруживают тромбоз полости ЛП, то терапию НАК под контролем MHO продолжают еще в течение 2-4 недель, после чего обязательно повторяют ЧпЭХО-КГ. С другой строны, если при ЧпЭХО-КГ не обнаружены тромбы и спонтанное контрастирование в ЛП, то антикоагу-лянтную подготовку мож-но сократить до 1 недели (ACUTE), после кардио-версии НАК следует и в этом случае принимать не менее 4 недель. При остро возникшей МА (до 48 часов) внутрисердечные тромбы выявляются у 14% больных. Поэтому всем таким больным перед восстановлением синусового ритма введение гепарина в/в в дозе 12-18 ЕД/кг/ час после болюса 4000 ЕД в/в под контролем АЧТВ (которое должно быть удлинено в 1,5-2,5 раза от исходного). Возможно также введение низкомолекулярных гепаринов в ле-чебных дозах. Если ритм восстановить не удается больного переводят на НАК и далее решают вопрос о кардиоверсии.
Кроме того, во время подготовительного периода необходимо добиться нормосистолии, то есть адекватной ЧСС (60-80 уд/мин в покое и 90-110 уд/мин при физической нагрузке). Обычно с этой целью используют бета- адреноблокаторы (метопролол, бисопролол). При наличии противопоказаний или при неэффективности бета-адреноблокаторов у больных с ФВ более 40% возможно использование верапамила или дилтиазема. При неэффективности последних возможно контролировать ЧСС амиодароном.
Во время подготовительного периода необходимо также добиться максимальной компенсации ХСН и АГ. С этой целью больному должны быть назначены ИАПФ, при наличии признаков задержки жидкости в организме — мочегонные препараты, больным с III и IV ФК ХСН назначают также небольшие дозы спиронолактона (12,5-50 мг/сут) в качестве нейромодулятора.
В процессе подготовки к ЭКВ необходимо контролировать уровень калия плазмы крови. Чем в большей степени будет скомпенсирован больной перед восстановлением синусового ритма, тем больше вероятность удачной кардиоверсии и сохранения ритма в будущем.
После восстановления синусового ритма продолжают терапию основного заболевания, возможен прием ААП для профилактики рецидивов МА.
6.5 Противопоказания для восстановления синусового ритма
Абсолютные противопоказания
· Наличие неорганизованного внутрисердечного тромба.
Относительные противопоказания
· Пороки сердца, подлежащие хирургической коррекции.
· Малый (менее 6 месяцев) срок с момента проведения хирургической коррекции пороков сердца.
· Активность ревматического процесса II-III степени (неустраненная).
· Тиреотоксикоз (неустраненный).
· Наличие плотного внутрисердечного тромба у больного с ТЭ в анамнезе.
· Возраст > 65 лет у больных с пороками сердца и >75 лет у больных ИБС.
· Недостаточность кровообращения III ст.
· Кардиомегалия. Значительное расширение ЛП у больных митральным пороком сердца, ДКМП, аневризмой ЛЖ и другими заболеваниями, осложнившимися недостаточностью кровообращения.
· Давность настоящего эпизода МА более 3 лет, за исключением МА на фоне тиреотоксикоза, когда давность аритмии не уменьшает эффективности ААТ.
· Частые (1 раз в месяц и чаще) приступы МА перед ее настоящим эпизодом, требовавшие внутривенного введения ААП или ЭИТ. В этой ситуации восстановление синусового ритма не решает вопрос дальнейшей тактики лечения больного.
· Ожирение III ст.
· Изолированная хроническая идиопатическая ФП у лиц, не имеющих расширения ЛП и каких-либо других признаков заболевание сердца. Волны f при этом едва различимы, сохранить синусовый ритм крайне трудно.
· Предшествующий появлению данного эпизода МА, СССУ (с выраженными клиническими проявлениями).
· Брадикардитическая ФП с редкими желудочковыми ответами, в особенности у пожилых больных, не принимавших дигиталиса, верапамила, бета-адреноблокаторов. У многих из них после восстановления синусового ритма появляется выраженная синусовая брадиардия как проявление СССУ.
6.6 Профилактика рецидивов мерцательной аритмии
После ЭКВ большая часть рецидивов наступает в течение 1-го месяца. Различают несколько форм рецидивов:
- ранние рецидивы, возникающие менее чем через 2 недели;
- поздние — более чем через 2 недели.
Среди ранних рецидивов различают полную неэффективность ЭКВ и не-медленные рецидивы (через 1 -2 мин синусового ритма), эти формы встречаются в 25% случаев. Подострые рецидивы возникают в сроки от 1 сут до 2 недель еще у 25% больных.
Факторами риска для возникновения частых рецидивов МП являются:
- женский пол;
- органические заболевания сердца (особенно ревматические пороки);
- дилатация ЛП;
- возраст старше 70 лет;
- длительность эпизода МП более 3 мес.
Даже при повторных ЭКВ и профилактическом приеме ААП рецидивы в течение 4 лет отсутствуют только у 30% больных.
Таким образом, пароксизмальная или персистирующая МА является хроническим заболеванием, и у большинства больных рано или поздно воз-никает рецидив. По этой причине большинство больных нуждаются в профилактическом назначении ААП для поддержания синусового ритма. Однако, пока не известно, предотвращает ли поддерживающая терапия ТЭ и смерть. Поскольку клинические факторы, которые предрасполагают больно-го к рецидивам МА (пожилой возраст, ХСН, АГ, дилатация ЛП и дисфункция ЛЖ), являются также факторами риска для ТЭ, устранение МА может не снижать риск НМК.
Удержание синусового ритма с помощью ААП может снижать час-тоту развития сердечной недостаточности, однако в одном исследовании по-казано, что повторные кард
Дата добавления: 2017-01-21; Мы поможем в написании ваших работ!; просмотров: 374 | Нарушение авторских прав
Лучшие изречения:






