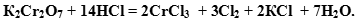Далее определим окислитель и восстановитель и составим полуреакции процессов восстановления и окисления.
4.
o добавляем Н+ в ту часть полуреакции, где избыток кислорода;
o в противоположную часть добавляем Н2О;
O уравниваем атомы кислорода, затем атомы водорода;
o подсчитываем заряды в полуреакциях, уравниваем заряд, для этого отнимаем или добавляем электроны.
В приведенной реакции окислитель — MnO4 — принимает 5 электронов восстанавливаясь в кислой среде до Mn2+. При этом освобождается кислород, входящий в состав MnO4—, который, соединяясь с H+, образует воду:
MnO4— + 8H+ + 5e— = Mn2+ + 4H2O
Восстановитель SO32- — окисляется до SO42-, отдав 2 электрона. Как видно образовавшийся ион SO42- содержит больше кислорода, чем исходный SO32-. Недостаток кислорода восполняется за счет молекул воды и в результате этого происходит выделение 2H+:
SO32- + H2O — 2e— = SO42- + 2H+
5. Находим коэффициент для окислителя и восстановителя, учитывая, что окислитель присоединяет столько электронов, сколько отдает восстановитель в процессе окисления-восстановления:
MnO4— + 8H+ + 5e— = Mn2+ + 4H2O ¦2 окислитель, процесс восстановления
SO32- + H2O — 2e— = SO42- + 2H+ ¦5 восстановитель, процесс окисления
5. Затем необходимо просуммировать обе полуреакции, предварительно умножая на найденные коэффициенты, получаем:
2MnO4— + 16H+ + 5SO32- + 5H2O = 2Mn2+ + 8H2O + 5SO42- + 10H+
6. Сократив подобные члены, находим ионное уравнение:
2MnO4— + 5SO32- + 6H+ = 2Mn2+ + 5SO42- + 3H2O
7. Запишем молекулярное уравнение, которое имеет следующий вид:
5Na2SO3 + 2KMnO4 + 3H2SO4 = 5Na2SO4 + 2MnSO4 + K2SO4 + 3H2O
Задача. Составление уравнений полуреакций в щелочной среде
Расставить коэффициенты в уравнении методом электронно-ионного баланса.
KAsO2 + Br2 + KOH = K3AsO4 + KBr + H2О
Решение задачи
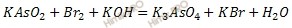
Записывают схему реакции в ионно-молекулярной форме и определяют ионы и молекулы которые изменяют степень окисления:
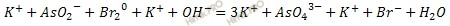
Участие в реакции ионов OH- говорит о том, что процесс протекает вщелочной среде.
Рассмотрим порядок действий при составлении уравнений полуреакций в щелочной среде.
1. В ионно-молекулярном уравнении каждой полуреакции уравнивают числа атомов всех элементов.
Полуреакции имеют вид:
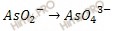
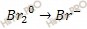
В данном случае среда щелочная, поэтому ионно-молекулярное уравнение полуреакции имеет вид:
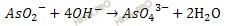
2. Для уравнивания атомов водорода и кислорода в уравнениях для щелочной среды:
· добавляем воду в ту часть полуреакций, где избыток кислорода;
· в противоположную часть добавляем удвоенное число гидроксид-ионов;
· перед Н2О ставим коэффициент, показывающий разницу в числе атомов кислорода в правой и левой частях полуреакций, а перед ОН─ - его удвоенный коэффициент.
Составляют электронно-ионные уравнения полуреакций. Для этого в левую часть каждой полуреакции добавляют (или вычитают) электроны с таким расчетом, чтобы суммарый заряд в левой и правой частях уравнений стал одинаковым.
Получаем:
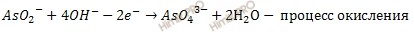
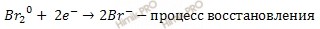
3. В данном случае баланс по электронам есть. Поэтому просто суммируют электронно-ионное уравнение:
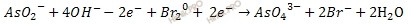
4. Сокращают подобные члены и получают ионно-молекулярное уравнение окислительно-восстановительной реакции в щелочной среде:
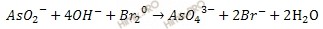
5. По полученному ионно-молекулярному уравнению окислительно-восстановительной реакции составляют молекулярное уравнение. Для этого по схеме реакции определяют, из каких молекул получены данные ионы.
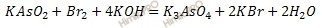
Задача. Закончить уравнение реакции между бихроматом калия и соляной кислотой.
Ион 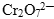 содержит хром в его высшей степени окисления (+7), следовательно, может выступать только в роли окислителя. По схеме составим полуреакцию, учитывая, что среда кислотная (HCl).
содержит хром в его высшей степени окисления (+7), следовательно, может выступать только в роли окислителя. По схеме составим полуреакцию, учитывая, что среда кислотная (HCl).
Полуреакция восстановления: 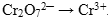
Ионы 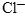 могут только окисляться, т.к. хлор имеет самую низшую степень окисления (-1); хлор окисляется до с.о. «ноль» (0). Составим полуреакцию окисления:
могут только окисляться, т.к. хлор имеет самую низшую степень окисления (-1); хлор окисляется до с.о. «ноль» (0). Составим полуреакцию окисления: 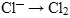

Суммируем сначала левые, а затем правые части полуреакций, не забывая предварительно умножить множитель на коэффициент, если он стоит перед формулой.
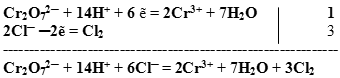
Получили сокращенное ионное уравнение.
Добавляем недостающие катионы или анионы, учитывая, что количество добавляемых ионов в правую и левую части ионного уравнения должно быть одинаковым.
В данном случае источником ионов 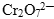 ─ была соль
─ была соль 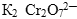 , поэтому с каждым молем
, поэтому с каждым молем 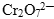 в раствор попадает 2 моль ионов
в раствор попадает 2 моль ионов 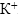 . В реакции они участия не принимают, поэтому в неизменном виде должны перейти в правую часть уравнения. Вместе с 14 моль ионов
. В реакции они участия не принимают, поэтому в неизменном виде должны перейти в правую часть уравнения. Вместе с 14 моль ионов 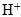 в раствор должно вноситься 14 моль ионов
в раствор должно вноситься 14 моль ионов 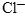 . Но у нас из них участвует в реакции только 6 моль
. Но у нас из них участвует в реакции только 6 моль 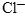 в качестве восстановителя, а остальные 8, как и ионы
в качестве восстановителя, а остальные 8, как и ионы 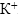 , в неизменном виде остаются после реакции, т.е. дописываются в правую часть.
, в неизменном виде остаются после реакции, т.е. дописываются в правую часть.
Обратите внимание на подчеркнутое предложение выше!
В результате получаем:
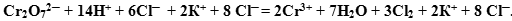
После этого можно объединить ионы в формулы реальных веществ: