Трансаминирование аминокислот: механизм, коферменты, значение. Что такое непрямое дезаминирование и его значение? Активность каких трансаминаз возрастает в сыворотке крови и при каких заболеваниях?
Трансаминирование – реакции межмолеклярного переноса аминогруппы от аминокислоты на альфа-кетокислоту без промежуточного образовния аммиака. Впервые р-ии трансаминирования были открыты советскими учеными Браунштейном и Крицман в 1937 году. Р-ии трансаминирования явлются обратимыми и универсальными для все живых организмов, протекают при участии специфических ферментов – аминотрансфераз или трансаминаз. Теоретически реакции трансаминирования возможны между любой амино- и кетокислотой, однако наиболее интенсивно они протекают в том случае, когда один из этих соединений представлен дикарбоновой кето- или аминокислотой.
В переносе NH2 актив участие принимает кофермент трансаминаз – пиридоксальфосфат (производное витамина В6), который в процессе реакции обратимо превращается в пиридоксальаминфосфат.
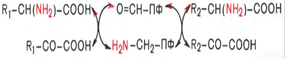
Механизм. Общую теорию механизма ферментативного трансаминирования разработали советские ученые Браунштейн и Шемякин.Механизм:
Перенос аминогруппы на кофермент – пиридоксальфосфат под действием ферментов трансаминирования =>обраование шиффова основания => внутримолекулярные превращения (лабилизация альфа-водородного атома, перераспределение энергии связи) => освобождение альфа-кетокислоты и пиридоксаминофосфата => (вторая стадия) пиридоксаминофосфат реагирует с любой другой альфакеокислотой, что через те же стадии образования промежуточных продуктов, только в обратном порядке, приводит к синтезу новой аминокислоты и освобождению пиридоксальфосфата. Обе стадии реакции дезаминирования в виде общей схемы:
Значение:
Мочевинообразование
Глюкогеноз
оптимизация смеси аминокислот, поступающих из кишечника во внутреннюю среду организма:
Природные белки при расщеплении в кишечнике дают смесь аминокислот, в к-ых соотношение отдельных аминокислот м. б. оч. далеким от потребности наших клеток. В орг-ме синтезируются ряд кетокислот, к-ые в результате трансаминирования могут превращ. в заменим. аминокислоты
Перераспределение аминного азота поступающего из кишечника
Трансаминирование входит в качестве одного из этапов в более сложные процессы превращения аминокислот трансдезаминирование и трансреамикирования.
Браунштейн предложил путь непрямого дезаминирования через реакции трансаминирования, названный трансдезаминированием. Согласно этому: все аминокислоты сначала реагируют с альфа-кетоглутаровой кислотой в реакции трансаминирования с образованием глутаминовой кислоты и соответствующей кетокислоты. Образовавшаяся глутаминовая кислота затем подвергается непосредственному окислительному дезаминированию под действием глутаматдегидрогеназы. Суммарная реакция:
R1—CH(NH2)—COOH + НАД+ + Н2O –> R1—СО—СООН + НАДН2 + NH3.
Значение: т к обе р-ии (трансаминирование и дезаминирование) являются обратимыми, то создаются все условия для синтеза любой аминокислоты, если в организме имеются соответств. альфа-кетокислоты.
Клиническое значение определения активности трансаминаз:
Для клинических целей наибольшее значение имеют две трансаминазы – АсАт, АлАт, катализирующие соответственно следующие обратимые реакции:
Аспартат + альфаα-Кетоглутарат= Оксалоацетат + Глутамат&Аланин + альфаα-Кетоглутарат= Пируват + Глутамат
В сыворотке здоров людей активность трансаминаз в тысячи раз ниже, чем в паренхиматозных органах. Поэтому органические поражения при острых и хронических заболеваниях, сопровождающиеся деструкцией клеток, приводят к выходу трансаминаз из чага поражения в кровь.
Инфаркт миокарда: уровень АсАт повышается в 20-30 раз. Максимальная активность трансаминаз приходится на конец первых суток, через 2-3 дня приодит в норму.
Гепатиты: наблюдается гипертрансаминаземия за счет повышения уровня в основном АлАт, носит более затяжной и умеренный характер.
Различного рода коронарная недостаточность (стенокардия, пороки сердца и т д, кроме инфаркта) – незначительная гипертрансаминаземия
Как утилизируется азот аминогрупп аминокислот при их катаболизме? В результате чего может иметь место гипераммониемия? Что такое остаточный азот, чему он равен в норме и почему может возрастать?
Главный путь удаления азота из организма – орнитиновый цикл. Орнитиновый цикл выполняет 2 функции:
1) превращение азота аминокислот в мочевину, кот экскретируется, предотвращая накопление токсических продуктов (аммиака)
2) цикл включает реакции, необходимые для синтеза аргинина, пополняя его фонд в организме
В орнитиновом цикле участвуют 5 ферментов. Соответственно есть 5 болезней, связанных с недостаточностью какого-либо из этих ферментов. Аргиназа – накопление аргинина и предшествующих ему метаболитов. Аргининсукциназа – накопление аргининянтарной кислоты и предшествующих ей метаболитов. Карбаммоилфосфатсинтетаза I – накопление аммиака и его предшественников (т.е. аминокислот, таких как глутамин и аланин).и т.д.
Повышение концентрации аммиака вызывает рвоту, возбуждение, припадки с потерей сознания и судорогами. При хронической врожденной аммониемии – отставание в умственном развитии. Нарушение функционирования орнитинового цикла – наиболее частая причина гипераммониемии. К другим симптомам гипераммониемии относят от тяжелых нарушений обмена веществ и функции, которые приводят к летальному исходу вскоре после рождения, до таких, которые проявляются лишь тем, что индивиды не склонны к потреблению мясной и другой, богатой белками, пищи. Точный диагноз типа гипераммониемии устанавливают путем определения метаболитов орнитинового цикла в крови или моче, а также путем измерения активности ферментов цикла в биоптате печени.
В норме орнитиоый цикл функционирует на 60% от полной мощности. Запас мощности необходим для того, чтобы не возникла гипераммониемия при неизбежных колебаниях количеств потребляемого белка. При циррозе печени мощность орнитинового цикла снижена, в связи с чем у больных циррозом печени возникновение катаболических состояний (инфекционные болезни, массивные операции) также может привести к гипераммониемии.
Декарбоксилирование аминокислот: механизм реакции,коферменты, виды декарбоксилирования. Биогенные амины - перечислить и дать формулы наиболее важных, указать физиологические и патофизиологические эффекты.
декарбоксилирование аминокислот-процесс отщепления карбоксильной группы аминокислот в виде СО2. В живых организмах открыты 4 типа декарбоксилирования АК:
1.α-декарб-ие,хар-е для тканей животных,при кот-ом от АК отщеп-ся карбокс-ая группа,стоящая по соседству с α-углер-ым атомом.
 R-CH(NH2)-COOH R-CH2-NH2+ CO2
R-CH(NH2)-COOH R-CH2-NH2+ CO2
2.ω-декарб-ие,свойс-ое микроорган-ам. например,из аспаргиновой к-ты образ-ся α-аланин.
 COOH-CH2-CH(NH2)-COOH CH3-CH(NH2)-COOH+CO2
COOH-CH2-CH(NH2)-COOH CH3-CH(NH2)-COOH+CO2
3.декарб-ие,связ-е с р-ей трансаминирования.
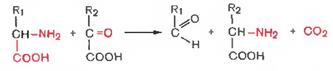
В этой р-ии обр-ся альдегид и новая АК,соотв-ая исходной кетокис-те.
4.декрб-ие,связ-е с р-ей конденсации 2-х мол-л
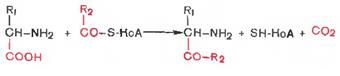
эта р-ия в иканях жив-ых осущ-ся при синтезе δ-аминолевулиновой к-ты из глицина и сукцинил-коА и при синтезе сфигнолипидов,у раст-ий при синтезе биотина.
Р-ии декарбок-ия являются необратимыми. Они катализ-ся декарбоксилазами АК-от, отличающимися от декарбоксилаз α-кетокислот как белковым компонентом,так и природой кофермента. Декарбоксилазы АК-от состоят из белковой части,обесп-ей специф-ть действия, и простетической группы,представленной пиридоксальфосфатом.
Декарбоксилаза аромат-их АК-от сод-ся в надпочечниках и в ЦНС,играет важную роль в рег-ии сод-ия биогенных аминов. Образующийся из 5-окситриптофана серотонин оказ-ся высокоактивным биогенным амином. Он обладает сосудосужив-им эффектом,рег-ет АД, темп-ру тела,дыхыние,почечную фильтр-ию, явл-ся медиатором нервных процессов в ЦНС. Дофамин явл-ся пред-ом катехоламинов. Ист-ом ДОФА в орг-ме яв-ся тирозин,кот-ый под д-ем гидроксилазы прев-ся 3,4-дииоксифенилаланин. Тирозин-3-монооксигеназа открыта в надрочечниках,ткани мозга и ПНС. Её роль оч высока,катализ-ая этим фкрментом р-ия опред-ет скорость биосинеза катехоламинов,рег-их деят-ть ССС. В жив-ых тканях с выс-ой скор-ю прот-ет декарбкс-ие гистамина. Оказ-ет сосудорасшир-ее д-ие,большое кол-во гистамина обр-ся в обл-ти воспаления,он ускряет приток лейкоцитоа, уч-етв секреции HCL в жел-ке, гистаминуприпис-ют роль медиатора боли. Продукт декарб-ия глутаминовой к-ты- ГАМК. Он обладает тормозящим д-ем на деят-ть ЦНС,больше всего его обнаружено в сером веществе. даёт хороший эффект при лечении эпилепсии. В жив-ых тканях декарб-ся 2 произ-ых цистеина-цистеиновая и цистеинуриновая к-та. В процессе этих р-ий образ-ся таурин,к-ый исп-ся в орг-ме для синтеза парных желчных кислот. Следует отметить 2 недавно открытых фермента,катализ-их декарб—ие орнитина и S-аденозилметионина с образ-ем соотв-но путресцина и S-метиладенозилгомоцистемина. Последние исп-ся для синтеза полиаминов спермидина и спермина. Полиамины играют важную рольв процессах пролиферации клеток,в регуляции синтеза нуклеиновых к-от и белков.
Переваривание белков в кишечнике: условия, действующие ферменты и их специфичность, всасывание. Парентеральное питание – для чего используется и что при его осуществлении применяется?
Перев-ие белков в кишечнике. Осущ-ся в тонком киш-ке,где д-ют ферменты панкреатического и кишечного соков.Трипсин и химотрипсин д-ют на белки аналогично пепсину,оба фермента наиб активны в слабощелочной среде(рН 7,2-7,8).Благодаря гидролит-му д-ию всех 3 эндопептидаз образ-ся пептидазы и некот-ое кол-во своб-ых АК.Дальнейший гидролиз пептидов до своб-ых АК осущ-ся под влиянием пептидаз.Помимо панкреатической карбоксипептидазы,на пептиды д-ют кишечная аминопептидаза и разнообраз-ые дипептидазы. аминопептидаза влияетна пептидную связь с N-конца пептида,карбоксипептидаза раз-ет пептидную связь с против-го С-конца пептида. Эти фермернты отщеп-ют по 1 АК от пептида и в конце ост-ся дипептиды,на кот-е д-ют дипептидазы и образ-ся свобод АК,кот –е затем вса-ся. Эластаза и коллагеназа подж. жел-зы гидрол.-ют эластин и коллаген. Парентеральное питание-приводит к развитию сенсибилизации(повыш-ой чув-ти организма к чуж-му белку),а повторное введение белков может привести к анафилаксии. Но к такому методу введения белков вынуждены прибегать при непрходимости пищевода из-за ожогов,отравлений,при раке пищ-да и желудка,после операций на ЖКТ.Для предотвращения осложнений исп.ют гидролизаты белков(смесь АК),такое введение не выз-ет аллергии,т.к. АК не обладают тканевой специф-тью, Но есть риск нарушения психической деятельности.
Показать превращения аминокислот фенилаланина и тирозина, указать промежуточные продукты на путях, ведущих к образованию катехоламинов, йодтиронинов и меланинов.
Фенилаланин-незаменимая аминокислота(ткани живот.не способны синтез-ть его бензольн.кольцо).Тирозин заменим при достаточ. поступл.первого с пищей.Основн.путь превращ.фенилаланина нач-ся с его гидроксилир-я(ферм-т – фенилаланин-4-монооксигеназа).При наруш.синтеза этого фермента в печени данная реакция блокир-ся =>развив-ся тяжел.наследст.болезнь-фенилкетонурия(замедл.умствен.развит,выдел.с мочой больш.кол-ва фенилпировиноград.к-ты,фенилал.накап-ся в тк.).В процессе трансаминир-я тирозин превр-ся в п-оксифенилпировиноградн.к-ту,котор.под действием спец. Оксидазы превр-ся в гомогентизиновую к-ту.последняя под действием оксидазы гомогент-ой к-ты превр-ся в малеилацетоуксусную к-ту,кот.прев-ся в фумарилацетоуксусную к-ту под действием изомеразы.
(промежут.продукты на рис.)
Фенилаланин и тирозин яв-ся предшест-ми меланинов.в этом важ.процессе приним-т участ.фермент-тирозиназа.при потере способности синтез-ть его возник-т альбинизм-врожден.отсутст.пигментов в коже и т.д.
Алкаптонурия харак-ся выдел-м с мочой больш.кол-ва гомогентиз-ой к-ты(темн.окраска).при болезни набл-ся отложен.пигмента в тк.,потемнен.носа,ушей,склеры.дефект связан с врожд.отсутст.в печени и почках оксидазы гомоген-ой к-ты.
При наруш.обмена триптофана возник-т болезнь Хартнупа.(кожн.пораж.,псих.расстройства,атаксия-повыш.выделение с мочой индолилацетата)
Болезнь кленового сиропа(выдел-ся также индолилацетат и индолилмолоч.к-та)
Цистинурия-насл.забол.,выдел-ся с мочой в 50 раз > нормы кол-ва 4 аминок-т:цистина,лизина,аргинина,орнитина.(люди здоровы,но есть тенденция к образ-ю в орг-ме камней).
Болезнь Вильсона-наруш.синтеза церулоплазмина.
Цистиноз-врожд.наруш.реабсорбции почти всех аминок-т.
Дезаминирование аминокислот - показать уравнения возможных реакций и указать названия получающихся продуктов. Какое дезаминирование преобладает в организме человека? В чем заключается связь дезаминирования и трансаминирования?
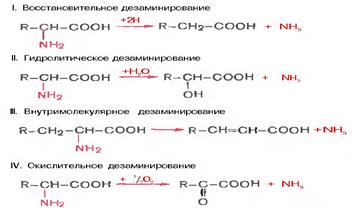
Продуктами дезаминирования кроме аммиака(идет в мочевину) являются жирные к-ты, оксик-ты, кеток-ты(идут в цикл кребса)
Для орг-ма чел преобладающ типом реакции явл-ся окислительное дезаминир-е, за искл гистидина(внутримолекулярн дезаминир-е)
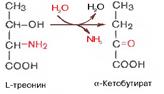
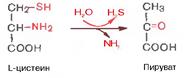
биосинтетического процесса.
Перечислить незаменимые аминокислоты, объяснить причину их незаменимости. Что такое полноценные и неполноценные белки? Указать величину суточной потребности в пищевом белке, от чего она зависит? Какие изменения и заболевания могут быть при недостаточном белковом питании?
Аргинин, валин, гистидин, изолейцин, лейцин, лизин, метионин, треонин, триптофан, фенилаланин.
Незаменимость указанных аминок-т для роста и развития орг-ма жив-х и чел-а связана с отсутствием способности тканей синтезировать углеродные скелеты незаменимых аминок-т, поскольку процесс аминирования соответствующих кетопроизводных осуществляется сравнительно легко посредством реакций трансаминирования. Следовательно все эти аминок-ты должны поступать с пищей.
Полноценные белки содержат весь набор незаменимых аминокислот
Нормы белка в питании учитывают разные климат условия, условия труда, профессию, возраст и др. Взрослый человек, занимающ умств трудом при средней физ нагрузке должен получать 100-120 г белка в сутки при энерго тратах 12000 кДж. При изменении условий труда эта норма белка увелич на 10 г на каждые 2100 кДж.
Белковая недостаточность у человека развивается при полном и частичном голодании, а также при однообразном белковом питании, когда в диете преобладают белки растит происхождения. Результатом этих состояний явл-ся развитие отрицат азотистого баланса, гипопротеинемии, нарушения коллоидно-осмотического и водно-солевого обмена (развитие отеков). При тяжелых формах пищ дистрофий, н-р, квашиоркоре – наблюдаются тяжелые поражения печени, остановка роста, резкое снижение сопротивляемости орг-ма инфекциям, отечность, атония мышц, часто с летальным исходом.






