Несмотря на стабильное снижение заболеваемости и летальности, рак желудка (РЖ) по-прежнему остается крайне актуальной проблемой человечества. Длительное время это грозное заболевание оставалось ведущей причиной смертности от онкологической патологии во всем мире. В последнее время благодаря изменениям пищевого рациона, методик приготовления и хранения пищи частота этого заболевания в экономически развитых странах постепенно снижается. Однако проблема раннего выявления и лечения РЖ на сегодняшний день остается высокоактуальной.
ДИАГНОСТИКА
1) Наиболее признанным методом выявления ранних форм рака желудка является фиброгастроскопия (ФГС, EGD – esophagogastroduodenoscopy), основанная на визуальной оценке патологических изменений слизистой. Специфичность отдельно взятых макроскопических признаков малигнизации повреждений (неровность краев, размеры более 2 см, изменение перистальтики, складчатости, локализация язвенного дефекта на большой кривизне желудка и т.д.) не превышает 70% [2]. Чувствительность одной только ФГС в определении наличия озлокачествления составляет 70-80%, а специфичность – 65-85%. Эти показатели во многом зависят от опыта эндоскописта и правильности выполнения методики [12, 13, 14, 15]. Чувствительность ФГС в выявлении малигнизации язвы желудка, дополненной биопсией, повышается до 95%, а специфичность достигает 99,5% [16]. Число диагностических ошибок разделения злокачественных и доброкачественных язв желудка при эндоскопическом исследовании с биопсией может достигать 15-25% [17]. Во время ФГС также рекомендуется брать материал и для цитологического исследования. Хотя выявление признаков злокачественности в этом случае не является надежным критерием для окончательной постановки диагноза, докладывается о 100% чувствительности метода при совместном применении цитологического и гистологического исследования. Если заключения проведенных исследований неоднозначны, рекомендуют выполнение многократных повторных биопсий. При язве желудка биопсию следует брать во время каждого контрольного осмотра, вплоть до ее полного рубцевания [18, 19]. Существующие в настоящее время ультратонкие эндоскопы (u-EGD – ultrathin EGD) диаметром до 5,5 мм позволяют выполнять эндоскопию трансназально. В отличие от обычной ФГС (conventional EGD) данная методика не требует седации и значительно легче переносится больными. Качество изображения у ультратонких эндоскопов из-за малых размеров используемой оптики и меньшей освещенности в настоящее время хуже, чем у обычных эндоскопов. Данный метод рекомендуется как скрининговый метод исследования для выявления РРЖ, однако его диагностическая точность пока не изучена достаточно хорошо [20, 21]. Для улучшения визуализации измененных участков слизистой желудка применяется хромоскопия (chromoscopy), которая основана на различии в окраске нормальных и пораженных диспластическим процессом тканей под действием специфических красителей. Эта процедура является простым, быстрым и недорогим методом, практически не имеющим побочных эффектов, позволяет брать биопсию прицельно, из участков, окраска которых отличается от здоровой ткани. Точность выявления злокачественного роста во время ФГС с использованием хромоскопии достигает 91% [22]. Использование увеличительной техники во время эндоскопии (zoom-endoscopy, МЕ – magnifying endoscopy) позволяет более точно определять минимальные нарушения архитектоники слизистой оболочки, различать участки неопластических изменений и определять их границы благодаря 100-кратному увеличению изображения. Обычно увеличительная эндоскопия выполняется совместно с хромоскопией [23, 24]. При использовании систем воспроизведения изображения в узком диапазоне спектра (NBI – narrow band imaging) во время ФГС для освещения применяется белый свет, пропущенный через специальные фильтры. Благодаря тому, что световые лучи различных диапазонов спектра отражаются от структурных элементов слизистой по-разному, получаемая картина становится более контрастной, что позволяет анализировать изменения архитектоники сосудистого рисунка. Чувствительность выявления дисплазии при ФГС с использованием системы NBI составляет 89%, специфичность – 93% [25]. Несколько иначе работает система MBI (multi band maging), также имеющая названия FICE (от торгового названия Fuji Intelligent Color Enhancement) и OBI (optimal band imaging). Световые фильтры при этом не используются. Получаемое изображение при освещении обычным светом программно анализируется аппаратом и отображается на мониторе с усилением различных спектров [26]. Системы воспроизведения изображений в различных спектрах зачастую конструктивно совмещены с возможностью увеличения [27]. Системы NBI и MBI являются своего рода методами виртуальной хромоскопии [28]. Чувствительность выявления РРЖ при совместном использовании систем увеличения и NBI составляет около 70%, специфичность – 85%, точность – 80% [13, 29].
2) Одной из новых возможностей эндоскопии является так называемая конфокальная лазерная эндомикроскопия (confocal laser endomicroscopy), которая позволяет во время выполнения эндоскопии проводить анализ изменений слизистой на клеточном уровне благодаря 1000-кратному увеличению изображения [30]. Микроскопическому анализу подвергают наиболее подозрительные участки слизистой желудка. Для получения изображения используется лазер и флуоресцирующие вещества. Докладывается о чувствительности выявления неоплазии, достигающей 84%, специфичности – 95%. Данная методика пока не получила широкого применения. Необходимы разработка протоколов интерпретации результатов и дальнейшее изучение диагностических возможностей [31].
3) Оценить глубину инвазии опухоли, ее размеры, состояние регионарных лимфоузлов, характер изменений прилежащих органов позволяет эндосонография (ЭСГ, ESG – endosonography). Благодаря наличию ультразвукового датчика на конце эндоскопа одновременно с ФГС выполняется эндосонографическое исследование со стороны слизистой желудка. Следует иметь в виду, что визуализируемое расстояние не превышает 5 см от датчика. Точность эндосонографии в выявлении РРЖ составляет лишь 80%, в определении глубины инвазии опухоли – 88-92%, в наличии метастатического поражения лимфоузлов – 60-85%. Информативность эндосонографии выше при диагностике рака желудка поздних стадий, при ранних формах она менее эффективна [32, 33, 34]. Чувствительность и специфичность ЭСГ в определении прорастания опухоли в пределах подслизистого слоя составляет 88% и 100%, в обнаружении регионарных метастазов уровня N1 (по международной классификации опухолей TNM) – 58% и 87%, соответственно. Чувствительность выявления отдаленных метастазов составляет около 73%, специфичность – 88% [35]. Современные эндосонографические аппараты позволяют получать трехмерное изображение (3D-эндосонография, 3D-EUS). Точность определения глубины инвазии опухоли у данного метода может достигать 100% [36].
4) Эзофагогастродуоденоскопия с биопсией – является ведущим методом диагностики. В последние годы для улучшения осмотра слизистой (чаще применяется для обнаружения раннего РЖ) перед процедурой применяются препараты, снижающие моторику желудка, и медикаменты, удаляющие слизь со слизистой (диметилполисилоксан, диметикон в комбинации с двуокисью кремния). Опытный эндоскопист может заподозрить инвазию РЖ в подслизистый слой, однако часто биопсии недостаточно, чтобы получить достаточно подслизистого материала. Этот факт заслуживает внимания, поскольку известно, что при инвазии опухоли в слизистую частота метастазов в регионарные лимфоузлы не превышает 2–3%, а при инвазии в подслизистый слой достигает 15–18% [4,10,15,17]. Аргументы в пользу операции с лимфодиссекцией регионарных лимфоузлов в последнем случае принимают решающее значение. В развитых странах, и прежде всего в Японии, широко используется ультразвуковая эндоскопия, позволяющая визуализировать 5 слоев стенки желудка и довольно точно определять индекс Т. Точность эндоскопического УЗИ приближается к 90%. Метод также применяется для определения прилежащих увеличенных лимфоузлов (чаще при раке пищевода )
5) Тонкоигольная пункционная аспирационная биопсия под контролем эндосонографии (ЭСГ-ТИА, EUS-FNA – endoscopic ultrasound-guided fine-needle aspiration) выполняется специальным эндоскопом со встроенным эндосонографическим датчиком и биопсийной иглой. ЭСГ-ТИА является относительно безопасной диагностической процедурой, однако техника ее выполнения не является простой. Перистальтика желудка и экскурсии грудной клетки при дыхании вносят определенные трудности. Точность ЭСГ-ТИА в определении неустановленной лимфаденопатии узлов, расположенных вблизи верхних отделов желудочно-кишечного тракта, достигает 90-98% [37]. Чувствительность и специфичность выявления метастазов в прилегающие лимфоузлы составляет 85-93% и 93-100%, соответственно, что выше, чем у эндосонографии (49-99% и 33-99%, соответственно) [33].
6) Рентгеноскопия желудка. По данным японских авторов, ранний РЖ рутинным рентгенологическим методом пропускается почти в 25%. Однако метод не только не остался во многих скрининговых программах Японии, но применяется наряду с ЭГДС для дополнительной информации. Исключительно важную роль метод играет с целью изучения распространения опухоли в области кардиоэзофагеального соустья на пищевод и при распространении опухоли на 12–перстную кишку, что влияет на выбор оперативного доступа и планирование объема операции. Как правило, рентгенологическое исследование более точно оценивает распространение опухоли по подслизистому слою за счет видимой ригидности стенок органа (пищевода, желудка или 12–перстной кишки). В случаях подслизистого роста опухоли («linitis plastica») рентгенологический метод может оказаться ведущим в установке диагноза.
7) Компьютерная томография (КТ) иногда выполняется для установки диагноза, но метод нельзя назвать точным и чувствительным при РЖ. Основная роль сводится к определению метастазов в печени и определению увеличенных лимфоузлов. Достоверных признаков инвазии в прилежащие органы, в частности, в поджелудочную железу, не существует. Компьютерная томография (КТ, CT – computer tomography) в основном используется для определения распространения опухоли за пределы стенки желудка и выявления отдаленных метастазов. Метод нельзя назвать точным и чувствительным для обнаружения РРЖ и дифференциальной диагностики характера язв желудка на ранних стадиях. Чувствительность и специфичность КТ в выявлении РРЖ составляет 36-69% и 83-92%, соответственно, точность – 20-56%. Поражение лимфоузлов верно диагностируется в 48-70%, глубина инвазии – в 43-66% [41, 42, 43, 44].
8) Современные спиральные многосрезовые компьютерные томографы (MDCT – multi-detector computer tomography) позволяют выполнять трехмерную пространственную реконструкцию выводимого на монитор изображения и осуществлять так называемую виртуальную гастроскопию (virtual gastroscopy), чувствительность которой при выявлении РРЖ достигает 78-84% [42]. Точность определения глубины инвазии опухоли в стенку желудка составляет 89%, наличия метастатического поражения лимфоузлов – 78% [41, 43]. Дифференциальная диагностика характера язвы желудка складывается из оценки различных параметров (форма, край, толщина стенки, складчатость слизистой и др.). Чувствительность и специфичность выявления малигнизации достигает 90 и 100%, соответственно [45].
9) Позитрон-эмиссионная томография (ПЭТ, PET – positron emission tomography) основана на регистрации распределения в организме радиофармпрепаратов (РФП), меченных позитрон-излучающими радионуклидами. Наиболее распространенным РФП является 18F-2-деокси-2-флюоро-D-глюкоза (ФДГ) [46]. Для повышения чувствительности метода ведутся разработки по созданию РФП с высокой тканеспецифичностью и туморотропностью. В настоя- щее время с помощью ПЭТ может быть выявлено лишь около 26% больных с РРЖ [47]. В большей степени ПЭТ помогает определять агрессивность течения рака желудка, наличие отдаленных метастазов и ответ на проводимую противоопухолевую терапию. Для улучшения топической диагностики применяют аппарат, конструктивно совмещающий в себе возможности ПЭТ и КТ. Однако такое сочетание значимо не повышает выявление ранних форм рака желудка [48, 49].
10) Магнитно-резонансная томография (МРТ, MRI – magnetic resonance imaging), так же, как и КТ, в основном используется для определения отдаленных метастазов и стадирования рака желудка на поздних стадиях. Чувствительность и специфичность выявления метастазов в лимфоузлы составляет 54-85% и 50-100%, соответственно [39]. Точность в определении глубины инвазии опухоли не превышает 82%. Данные о диагностической значимости метода в выявлении РРЖ в литературе не встречаются [50].
11) Лапароскопия в большинстве случаев применяется тогда, когда есть подозрение на наличие отдаленных метастазов, не определяемых традиционными методами (УЗИ брюшной полости, клинический осмотр) – при тотальном поражении желудка, подозрении (небольшое количество жидкости в малом тазу или боковых отделах живота) на асцит, при увеличенных яичниках у женщин (подозрение на метастазы Крукенберга). При лапароскопии обязательны перитонеальный лаваж (цитологическое исследование обнаруженной в брюшной полости жидкости и смывы с брюшины), осмотр печени, гепатодуоденальной связки, мезоколон, поперечноободочной кишки, пищеводного отверстия диафрагмы. Как и при КТ, метод мало информативен при оценке задней стенки желудка.
12) Другие методы исследования. Рутинными методами в диагностике РЖ являются ультразвуковая томография органов брюшной полости, рентгеноскопия грудной клетки. В большинстве клиник Японии перед операцией определяется сывороточный уровень раковоэмбрионального антигена (СЕА), карбогидратного антигена СА19–9, при лапаротомии обязателен перитонеальный лаваж с цитологическим исследованием. По показаниям для обнаружения костных метастазов проводят трепанобиопсию.
ЛЕЧЕНИЕ
Японское Общество по изучению рака желудка (Japanese Research Society for Gastric Cancer) предложило номенклатуру лимфоузлов, которая легла в основу терминологии по лимфодиссекции, проводимой при операциях на желудке (рис. 1 и 2):
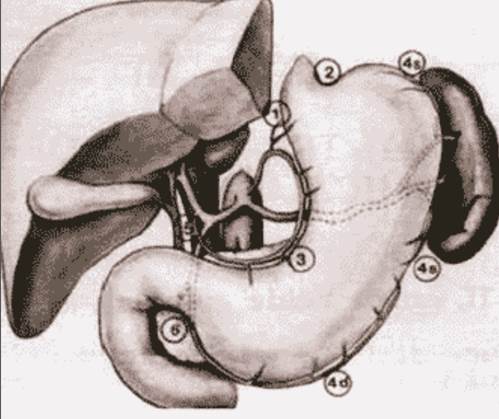 Рис. 1. Локализация и нумерация лимфоузлов согласно J.R.S.G.C.
Рис. 1. Локализация и нумерация лимфоузлов согласно J.R.S.G.C.
 Рис. 2. Локализация и нумерация лимфоузлов согласно J.R.S.G.C.
Рис. 2. Локализация и нумерация лимфоузлов согласно J.R.S.G.C.
1 - правые паракардиальные лимфоузлы;
2 – левые паракардиальные лимфоузлы;
3 – лимфоузлы малой кривизны;
4 – лимфоузлы большой кривизны;
4s – лимфоузлы вдоль левой желудочно–сальниковой артерии и коротких желудочных сосудов;
4d – лимфоузлы вдоль правой желудочно–сальниковой артерии;
5 – надпривратниковые лимфоузлы;
6 – подпривратниковые лимфоузлы;
7 – лимфоузлы левой желудочной артерии;
8 – лифоузлы общей печеночной артерии;
9 – лимфоузлы чревного ствола;
10 – лимфоузлы ворот селезенки;
11 – лимфоузлы селезеночной артерии;
12 – лимфоузлы печеночно–двенадцатиперстной связки;
13 – лимфоузлы позади поджелудочной железы;
14 – лимфоузлы корня брыжейки;
15 – лимфоузлы вдоль средней ободочной артерии;
16 – парааортальные лимфоузлы;
110 – нижние параэзофагеальные лимфоузлы;
111 – диафрагмальные лимфоузлы.
Условно вышеприведенные лимфоузлы формируют 4 этапа метастазирования. Первый этап (N1): лимфоузлы связочного аппарата желудка (1–6). Второй этап (N2): лимфоузлы левой желудочной (7), общей печеночной (8), чревного ствола (9), в воротах селезенки (10), вдоль селезеночной артерий (11). Третий этап (N3): лимфоузлы гепатодуоденальной связки (12), ретропанкреатодуоденальные лимфоузлы (13), корня брыжейки поперечноободочной кишки (14). Четвертый этап (N4): лимфоузлы вдоль средней ободочной артерии (15), парааортальные (16). Вовлечение лимфоколлекторов N1–N2, а также 12 группы (гепатодуоденальной связки) рассматривается как регионарное метастазирование, N3–N4 – как отдаленные метастазы. Этапность метастазирования является условной, так как для разной локализации опухоли в желудке не является идентичной. Кроме того, существуют так называемые «прыгающие», «скачущие» (skipping) метастазы, обнаруживаемые в непораженных промежуточных участках путей лимфооттока.
Согласно последней классификации по стадированию РЖ индекс Т означает не размер опухоли, а степень прорастания стенки желудка: T1 – прорастание слизистой и подслизистого слоя, Т2 – прорастание мышечного слоя до субсерозы, Т3 – пенетрация серозы желудка, Т4 – прорастание прилежащих структур. Формально, тотальный рак желудка с прорастанием всех слоев (но не прорастающий в соседние структуры) и небольшая опухоль размерами до 2 см с выходом на серозу могут попасть в одну стадию, что говорит о том, что даже последняя классификация не является идеальной. Индекс N при установке стадии заболевания присваивается следующим образом: поражение лимфоузлов от 1 до 6 расценивается как N1, от 7 до 15 как N2, поражение метастазами более 15 лимфоузлов расценивается как N3. Количество пораженных лимфоузлов призвано помочь в объективизации стадирования РЖ, а также, в известной мере, указывает на объем и адекватность операции. Гастрэктомия D1 (от слова dissection) предусматривает удаление перигастральных лимфоколлекторов, расположенных в связочном аппарате желудка (N1–6), гастрэктомия D2 означает удаление кроме N1–6, удаление лимфоузлов чревного ствола (N9) и его ветвей – левой желудочной (N7), общей печеночной артерии (N8), селезеночной (N11), лимфоузлов ворот селезенки (N3). Лимфодиссекция D3 предполагает в дополнение к выше перечисленным лимфоузлы гепатодуоденальной связки (N12), ретропанкреатодуоденальные (N13), лимфоузлы корня брыжейки (N14), брыжейки поперечноободочной кишки (N15), парааортальных лимфоузлов, расположенных на уровне брюшной аорты (N16). На IV Международном Конгрессе по раку желудка в Нью–Йорке (США, 2001 год) лимфодиссекция D2 определена, как стандартный объем радикального хирургического вмешательства, так как улучшает отдаленные результаты и снижает частоту местных рецидивов. Считается, что при лимфодиссекции D2 должно удаляться не менее 27 лимфоузлов, при D3 – не менее 40 лимфоузлов. На сегодняшний день можно постулировать, что больные, которым при оперативном лечении не произведена лимфодиссекция D2, должны считаться пациентами с неустановленной стадией и не должны включаться (во избежании феномена «миграции стадии») в статистические отчеты и международные протоколы исследования.
Более 10 лет назад предложена эндоскопическая резекция слизистой при раннем РЖ (EMR – endoscopic mucosal resection). Показания для EMR могут быть сформулированы следующим образом (при отсутствии отдаленных метастазов): высоко и умереннодифференцированная аденокарцинома; макроскопически IIa тип роста согласно японской классификации (superficial elevated type) размерами не более 2 см в диаметре или IIc тип (superficial depressed type) менее 1 см, отсутствие язвенных изменений в опухоли; поражение слизистой. При поражении подслизистого слоя необходима операция с лимфодиссекцией D2. Очевидно, что дополнительным условием для EMR являются квалифицированный медперсонал и соответствующая аппаратура [18,26,27].
В хирургии иногда используют термин «условно радикальная операция», при котором подразумевается полное удаление опухоли и видимых ее проявлений, однако предполагается раннее метастазирование или наличие неудаленных метастазов. Если во всех удаленных лимфоузлах обнаруживаются метастазы рака, то ясно, что вероятность оставленных метастазов крайне высока. Данное утверждение подтверждается тем фактом, что при выходе опухоли на серозный покров частота обнаружения метастазов в забрюшинных лимфоузлах достигает 15–35%. Поэтому лечебный эффект лимфодиссекции вправе можно ожидать в тех случаях, когда удаляется следующий за этапом метастазирования путь лимфооттока. Так, при поражении уровня N1 (группа лимфоузлов 1–6) нужно проводить лимфодиссекцию D2, при поражении уровня N2 (группа 1–11) лечебный эффект ожидается от лимфодиссекции D3. По мнению ряда хирургов, наиболее четко лечебный эффект лимфодиссекции D2 проявляется при II и IIIa стадии. К настоящему времени четкие показания к лимфодиссекции D3 еще не определены.
Комбинированные операции при раке желудка
При прорастании опухоли желудка в соседние органы широко применяются резекции вовлеченных структур (печени, толстой кишки, почки, поджелудочной железы, надпочечника, селезенки). При отсутствии отдаленных метастазов в печени, по брюшине, «пакетов» региональных узлов могут выполняться такие обширные операции, как гастропанкреатодуоденальная резекция [21]. Вопрос об обязательной спленэктомии при лимфодиссекции D2 также является дискуссионным. Сторонники спленэктомии считают, что без нее невозможно удаление лимфоузлов ворот селезенки, противники указывают на редкость метастазирования РЖ в указанную зону, например, при дистальном РЖ, а также на увеличение риска панкреатического свища и поддиафрагмального абсцесса. Аналогичные аргументы приводятся и в случае резекции тела и хвоста поджелудочной железы при отсутствии явных признаков врастания в поджелудочную железу. При раках проксимального отдела, опухолях задней стенки тела больше 2 см в диаметре большинство авторов производят спленэктомию. Роль спленэктомии как таковой на прогноз при РЖ изучается. При распространенных формах иногда проводятся операции с резекцией артерий чревного ствола или его полной перевязкой (операция Appleby), эвисцерации левого верхнего квадранта брюшной полости, включающей гастрэктомию, спленэктомию, субтотальную панкреатэктомию, резекцию поперечноободочной кишки, левостороннюю адреналэктомию (left upper abdominal evisceration) и т.д.
Хирургическое лечение кардиоэзофагеального рака
В большинстве стран Европы заболеваемость раком кардиоэзофагеальной зоны растет. На согласительной конференции Международной ассоциации по РЖ и Международного общества по заболеванию пищевода в 2000 году экспертной комиссией рекомендована классификация, предложенная немецким хирургом J.R. Siewert. В основе ее – ориентация на анатомический центр опухоли, расположенный относительно Z–линии, зоны перехода эпителия пищевода в желудочный. При этом используются два хирургических доступа: чрезбрюшинный и левосторонний торакоабдоминальный. Частота обнаружения медиастинальных метастазов при раках кардии достигает 30%, а пятилетняя выживаемость в таких случаях не превышает 10% [21]. Так как многие хирурги не отмечают лечебный эффект медиастинальной лимфодиссекции при метастатическом поражении средостения, а также в связи с улучшением хирургического пособия с возможностью формирования «высоких» трансдиафрагмальных эзофагоеюноанастомозов при лапаротомии, тораколапаротомный доступ больше не является преимущественным при раке кардии. Особенно актуальным становится вопрос о хирургическом доступе при раке кардиального отдела у пожилых, ослабленных больных с сопутствующими кардиореспираторными заболеваниями.
Паллиативные операции при раке желудка
Больные с явлениями стеноза выходного отдела, дисфагией, кровотечением из распадающейся опухоли, с пенетрацией опухоли в соседние органы и структуры, явлениями кишечной непроходимости (чаще при прорастании в поперечноободочную кишку), анемией, кахексией с обезвоживанием (особенно при дисфагии) часто попадают в общехирургические отделения и больницы терапевтического профиля. К сожалению, даже сами по себе вышеперечисленные осложнения, особенно у пожилых и пациентов старческого возраста в сознании многих врачей и хирургов ассоциируются с крайней запущенностью процесса и неоперабельностью. Увеличение доли пожилых людей в России только повысит актуальность проблемы. Вместе с тем практически все перечисленные осложнения встречаются либо при небольших опухолях, когда возможна радикальная операция, либо при местнораспространенных опухолях, при которых также возможно оперативное пособие. Немаловажную роль играет и так называемый «человеческий фактор». Так, по данным РОНЦ РАМН им. Н.Н. Блохина, у половины больных, которым выполнена «пробная» лапаротомия в неспециализированных, чаще в общехирургических клиниках, в последующем в специализированном онкологическом учреждении выполнялось хирургическое пособие. Среди паллиативных операций, наряду с общеизвестными (гастрэктомия, еюностома, обходные гастроэнтероанастомозы при раках, локализующихся в антральном отделе), следует отметить «шунтирующие» операции, которые выполняются чаще при неоперабельном раке проксимального отдела и кардиоэзофагеальной зоны. Суть операции заключается в обходном эзофагоеюноанастомозе, который может быть выполнен как чрезплевральным, так и абдоминальным доступом, что освобождает больного от мучительной дисфагии и необходимости пользоваться еюностомой.
Химиотерапия при раке желудка
Рак желудка мало чувствителен к химиотерапии. До сих пор не освещен вопрос, почему у одних больных метастазами поражается только печень при интактных забрюшинных лимфоузлах и брюшины, у других же при «чистой» печени – бурное метастазирование по брюшине и в лимфоузлы. Очевидно, что речь идет о разной биологической активности опухолевых клеток. Возможно, последние различаются в различной экспрессии молекул, ответственных за тропность либо к мезотелию брюшины, либо к эндотелию сосудов печени, лимфоузлов и т.д. Тем не менее выход опухоли на серозную оболочку желудка считается независимым фактором метастазирования по брюшине. Эффективность химиотерапии при РЖ не превышает 30–40%. В большинстве стран применяются комбинации PF (цисплатин и 5–фторурацил), ELF (этопозид, кальция фолинат и 5–фторурацил), ECF (эпирубицин, цисплатин и 5–фторурацил). При этом понятие «эффективность» часто включает достаточно разнородные понятия: субъективный эффект, объективный эффект – уменьшение опухоли или метастазов, общую или безрецидивную выживаемость и т.д. В целом считается, что применение химиотерапии улучшает качество жизни, то есть оказывает субъективный эффект, увеличивает безрецидивную выживаемость, не влияя на общую выживаемость, особенно при радикальных операциях, мало эффективна в адъювантном режиме и в ряде случаев увеличивает продолжительность жизни при неоперабельном РЖ. Ряд исследований в Японии и Корее показал эффективность адъювантной внутрибрюшной химиотерапии при прорастании опухоли серозного покрова. Как модификация указанного метода применяется внутрибрюшная гипертермическая химиотерапия. Эффективность метода показана как при наличии метастазов на брюшине, так и с точки зрения профилактики последних. «Золотым стандартом» в лечении РЖ последние 10 лет считалась комбинация с включением цисплатина, фторурацила и кальция фолината.
На последнем конгрессе ASCO в 2003 году в качестве препаратов, показавших эффективность в двух рандомизированных исследованиях, названы иринотекан и доцетаксел.
Заключение
Рак желудка в России остается чрезвычайно острой проблемой. Смертность за последние годы в нашей стране не снизилась. Выявляемость ранних форм, с одной стороны, низкая, однако, с другой стороны, является единственным шансом на выздоровление. Клинические проявления раннего РЖ не являются патогномоничными, но часто скрываются под обычными «желудочными» жалобами. Скрининговые программы, проводимые в экономически развитых странах, являются дорогими. В России требуется национальная скрининговая программа по выявлению наиболее распространенных онкологических заболеваний, а в условиях современной действительности скрининг РЖ должен проводиться хотя бы в группах фоновых и предраковых заболеваний. В этой связи требуется популяризация знаний (включая телевидение, радио, распространение буклетов и т.д.) о РЖ врачей общего профиля и среди населения. Особая роль должна отводиться терапевтам, гастроэнтерологам, эндоскопистам. Действенной мерой профилактики РЖ может служить изменение образа питания. Больные РЖ должны лечиться в специализированных учреждениях. При семейном РЖ должно проводиться медикогенетическое консультирование родственников. «Золотым стандартом» в хирургическом лечении является гастрэктомия (резекция) с объемом лимфодиссекции D2.
ЛИТЕРАТУРА
1. М.Н.Давыдов, Рак проксимального отдела желудка: стандарт хирургического лечения, основанный на 30-летнем опыте / М.Н.Давыдов, М.Д. Тер-Аванесов, И.С.Стилюди, А.Б.Германов, О.Н.Ефимов и др. / Вестник Российской Академии Мед. наук, М.: Медицина, - 2002, - №1, - С. 25-28.
2. Crew K.D., Neugut A.I. Epidemiology of gastric cancer // World J Gastroenterol. – 2006. – Vol. 12, №3. – P. 354-362.
3. Maconi G., Manes G., Porro G.B. Role of symptoms in diagnosis and outcome of gastric cancer // World J Gastroenterol. – 2008. – Vol. 14. – №8. – P. 1149-1155.
4. Rothenberg M.L. Иринотекан (СРТ–11): новые данные и перспективы применения – колоректальный рак и другие злокачественные опухоли. The Oncologist, 2001:6;66–80.
5. Parkin D.M. Global cancer statistics in the year 2000 // Lancet oncol. - 2001.- vol. 2 Sept. - P. 533- 543.
6. Hamashima C., Shibuya D., Yamazaki H. et al. The Japanese guidelines for gastric cancer screening // Jpn J Clin Oncol. – 2008. – Vol. 38. – №4. – P. 259-267.
7. Kaise M., Kato M., Urashima M. et al. Magnifying endoscopy combined with narrow-band imaging for differential diagnosis of superficial depressed gastric lesions // Endoscopy. – 2009. – Vol. 41, №4. – P. 310-315.






