Строение коллоидных частиц удобнее рассматривать, если проследить процессы их образования. Сделаем это на примере частиц AgI.
Образование коллоидной частицы AgI происходит в результате реакции:
AgNO3 + KI → AgI↓ + KNO3.
Молекулы AgI объединяются в практически нерастворимые частицы, в которых ионы Ag+ и I- образуют кристаллическую решётку.
Новообразованные частицы сначала имеют аморфное строение, затем в них постепенно происходит кристаллизация.
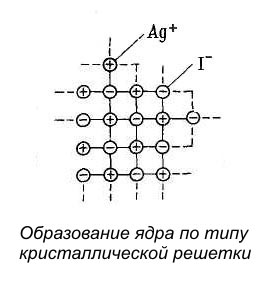
Если AgNO3 и KI взяты в эквивалентных количествах, то частицы-кристаллы растут, достигая значительной величины, превосходящей размеры коллоидных частиц, и быстро выпадают в осадок.
Если же одно из исходных веществ взято в небольшом избытке, то оно служит стабилизатором, сообщающим устойчивость коллоидным частицам AgI. Так, при избытке AgNO3 в растворе будет находится большое количество ионов Ag+ и NO3-. Однако построение кристаллической решетки AgI согласно правилу Панета – Фаянса может идти только за счёт ионов, входящих в её состав; в данном случае за счёт ионов Ag+.
Ионы Ag+ будут продолжать достраивать кристаллическую решётку ядра, прочно входя в её структуру и сообщая ему электрический потенциал.

1 - электронейтральное ядро
2 - зона достройки ядра потенциалопределяющими ионами
3 - адсорбционный слой
4 - противоионы адсорбционного слоя
В связи с этим ионы, достроившие кристаллическую решётку ядра, называются потенциалопределяющими ионами.
Величина электродинамического потенциала, или Е -потенциала, у многих коллоидных частиц достигает 1 В. Частицы с таким относительно высоким зарядом будут притягивать оставшиеся в растворе противоположно заряженные ионы NO3 (называемые поэтому противоионами). Начнётся процесс адсорбции противоионов, в результате которого установится динамическое равновесие между адсорбированными и свободными ионами.
Основная часть всех противоионов, адсорбированная на ядре коллоидной частицы, образует вместе с потенциалопределяющими ионами адсорбционный слой (позиция 3 на рисунке выше).
Ядро и адсорбционный слой вместе составляют гранулу. Гранула имеет электрический потенциал того же знака, что и Е -потенциал, но величина его меньше и зависит от количества противоионов в адсорбционном слое.
Так, если 90% их адсорбировано, то и потенциал гранулы составит 10% от Е -потенциала.
Потенциал гранулы называется электрокинетическим или дзета-потенциалом (ζ -потенциал). Кинетическим его называют потому, что он может быть обнаружен и измерен при движении частиц в электрическом поле. Его можно определить также, как потенциал на границе между адсорбционным (неподвижным относительно частицы) и диффузным (подвижным) слоями. (о диффузном слое см. ниже)
Остаток противоионов удерживается электростатическими силами притяжения вблизизи гранулы, образуя диффузный слой (позиция 5 на рисунке ниже).

5 - диффузный слой, состоящий из противоионов, не вошедших в адсорбционный слой гранулы
Гранула вместе с диффузным слоем образует мицеллу.
Толщина диффузного слоя различна, так как зависит от ионной силы раствора: чем ионная сила выше, тем толщина слоя меньше.
Концентрация противоионов в диффузном слое убывает по направлению к переферии. Соответственно этому убывает и потенциал частицы, падая на границе дифузного слоя до нуля. Таким образом, мицелла всегда электронейтральна.
Если переместить в адсорбционный слой большое количество противоионов, например 95%, электрокинетический (ζ -потенциал), измеряемый на поверхности гранулы, уменьшится до 5% от величины Е -потенциала. Величина Е -потенциала, зависящая от потенциал-определяющих ионов меняться не будет.
Устойчивость коллоидных растворов обусловлена присутствием стабилизатора, т.е. электролита и зависит от величины заряда гранулы (ζ -потенциала). Чем выше этот потенциал, тем сильнее оказываются силы взаимного отталкивания частиц, препятствующие их объединению при столкновениях, наблюдающихся в результате броуновского движения.
Коагуляция коллоидных растворов.
Коагуляция
Коллоидные системы обладают различной устойчивостью. Все они стремятся к уменьшению свободной поверхностной энергии за счёт сокращения удельной поверхности коллоидных частиц, что происходит при их стремлении к объединению.
Удельная поверхность этих частиц очень велика, поэтому они и обладают большим избытком поверхностной энергии, что, в свою очередь, ведёт к термодинамической неустойчивости коллоидных систем.
Процесс объединения коллоидных частиц в более крупные агрегаты называется коагуляцией.
Расклинивающее давление
По теории коагуляции Б.В. Дерягина и Л.Д. Ландау, при Броуновском движении коллоидные частицы свободно сближаются на расстояние до примерно 10-5 см, однако дальнейшему их сближению препятствует, так называемое, расклинивающее давление, возникающее в тонких слоях воды, находящихся между двумя поверхностями.
Расклинивающим давлением называют избыточное (по сравнению с гидростатическим) давление, действующее со стороны тонкого слоя жидкости на ограничивающие поверхности.
В золях оно обусловлено в основном взаимным отталкиванием противоионов диффузного слоя сблизившихся частиц и, кроме того, силами молекулярного взаимодействия между поверхностями этих частиц и молекулами воды.






