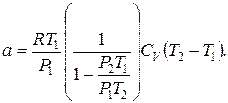Лабораторная работа №20
«Эффект Джоуля-Томсона»
Цель работы: Целью работы является экспериментальное определение изменения температуры воздуха в процессе адиабатного дросселирования при перепаде давления на дросселе до 12 атмосфер, а также определение константы Ван-дер-Ваальса, применяя для воздуха модель реального газа Ван-дер-Ваальса.
Задачи работы:
1) закрепление теоретических знаний по основным свойствам реального газа и отличие их от идеального газа;
2) снятие опытных характеристик воздуха в процессе адиабатного дросселирования, проведение обработки экспериментальных данных.
В данной лабораторной работе рассматриваются процессы, проис-ходящие в жестком замкнутом баллоне при его заполнение воздухом и при выпуске воздуха из него.
Основные теоретические сведения
В 1852-1862 гг. совместно Джоулем и Томсоном был проведен целый ряд экспериментальных работ по исследованию термодинамических свойств газов.
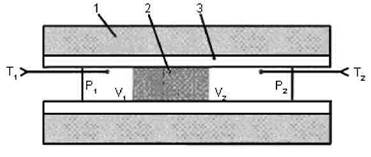
Рисунок 1- Схематическое изображение опыта Джоуля-Томсона:
1 – теплоизолирующая оболочка; 2 – пористая перегородка;
3 – цилиндрическая труба
В опыте Джоуля и Томсона цилиндрическая трубка, окруженная теплоизолирующим веществом, разделяется на две части с помощью пробки из плотного материала (вата или очесы щелка). Схема опыта представлена на рисунке 1. Исследуемый газ под действием разности давлений медленно перетекает через пробку. Благодаря наличию пробки газ течет без турбулентности. Это позволяет пренебречь кинетической энергией газа как величиной, пропорциональной квадрату скорости. Наличие тепловой защиты делает процесс адиабатическим. Давление газа Р 1 и P 2 по обе стороны от пробки поддерживается постоянным. Пробка и газ обмениваются теплом до тех пор, пока процесс не становится стационарным, после этого физическое состояние пробки, а значит и ее внутренняя энергия, остается неизменным. При стационарном течении газа по одну сторону пробки устанавливалась температура t 1, по другую - температура t 2. Стационарное течение газа через пробку называется процессом Джоуля-Томсона, а изменение температур при таком течении эффектом Джоуля-Томсона.
Применим к эффекту Джоуля-Томсона первое начало термодинамики. Для адиабатического процесса
 (1)
(1)
 Заметим, что из уравнения (1) следует постоянство энтальпии (H=U+РТ) в процессе Джоуля-Томсона. Используем это свойство для определения разности температур Δ T в процессе Джоуля-Томсона при разности давлений Δ P:
Заметим, что из уравнения (1) следует постоянство энтальпии (H=U+РТ) в процессе Джоуля-Томсона. Используем это свойство для определения разности температур Δ T в процессе Джоуля-Томсона при разности давлений Δ P:
 , (2)
, (2)
где 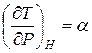 – коэффициент, учитывающий изменение температуры при адиабатном дросселировании, называемый коэффициент адиабатного дросселирования или дифферинциальный дроссель-эффект.
– коэффициент, учитывающий изменение температуры при адиабатном дросселировании, называемый коэффициент адиабатного дросселирования или дифферинциальный дроссель-эффект.
Для дальнейшего использования формулы (2) необходимо определить уравнение состояния. Для идеального газа числитель выражения в правой части (2) обращается в ноль.
Как известно, неточность законов идеального газа объясняется существованием межмолекулярных сил, которыми пренебрегают в модели идеального газа. Из опыта мы знаем, что потенциальную энергию межмолекулярного взаимодействия можно приближенно представить в виде потенциала Ленарда-Джонса:
 ,
,
где a 1 и a2 ‒ положительные константы.
Отсюда видно, что на малых расстояниях межмолекулярные силы носят резко отталкивающий характер, а на больших расстояниях - притягивающий. Для учета этих особенностей молекулярного взаимодействия в модели газа Ван-дер-Ваальса вводят две поправки. Первая поправка связана с взаимодействием молекул на малых расстояниях, где оно заменяется взаимодействием абсолютно твердых шаров некоторого радиуса r 0, так что W (r< r0) = ∞. Это приводит к тому, что при столкновении центры молекул не могут сблизиться на расстояние меньшее 2 r 0. Если в сосуде имеется N одинаковых молекул, то такую ситуацию можно представить как, если бы половина из этих молекул была заменена неподвижными сферами радиуса 2 r 0, а молекулы другой половины были бы точечными и двигались с удвоенной кинетической энергией.
Тогда мы бы имели идеальный газ, состоящий из N/ 2молекул, находящийся в объеме (V-b). Величина b и есть искомая поправка. Уравнение состояния одного моля такого газа можно записать в виде:
 , (3)
, (3)
где суммарный недоступный объём газа:
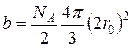 (4)
(4)
Вторая поправка связана с притягивающим взаимодействием молекул на больших расстояниях, которое приводит к появлению так называемого внутреннего давления газа Р'. Можно показать, что величина Р' будет пропорциональна квадрату концентрации молекул газа (чем больше молекул газа в объеме, тем больше суммарная сила «самопритяжения»). Поэтому уравнение состояния моля такого газа можно записать в виде:
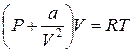 (5)
(5)
где a – вторая поправочная величина, представляющая собой некоторую константу, характерную для данного газа.
Объединяя формулы (3) и (5), получим уравнение состояния газа Ван-дер-Ваальса:
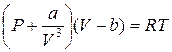 (6)
(6) 
Ян Дидерик Ван-дер-Ваальс родился в Лейдене. Окончил начальную и среднюю школу в Лейдене. С 1862 по 1865 г. он посещал Лейденский университет как вольнослушатель. Его докторская диссертация, посвященная непрерывности газообразного и жидкого состояний, получила горячее одобрение Дж. К. Максвелла. Через четыре года после получения докторской степени он стал первым профессором физики во вновь организованном Амстердамском университете, где и оставался вплоть до самого ухода в отставку в 1908 г., передав свое дело сыну. Ван-дер-Ваальс получил в 1910 г. Нобелевскую премию по физике «за работу над уравнением состояния газов и жидкостей».
Хотя уравнение Ван-дер-Ваальса и не удовлетворяло полностью экспериментальным данным, оно явилось существенным улучшением более простого закона и обладало важными следствиями.
Определить зависимость внутренней энергии газа Ван-дер-Ваальса от объема и температуры можно на основании соотношения для газа в состоянии термодинамического равновесия:
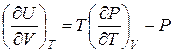
откуда с учетом (6) получим: 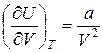 , (7)
, (7)
откуда 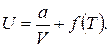
Тогда для газа Ван-дер-Ваальса получим
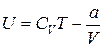 (8)
(8)
Используем выражения (1) и (8) для определения константы Ван-дер-Ваальса для воздуха:
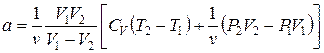 , (9)
, (9)
Группируя слагаемые в последнем выражении, получим:
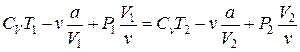 ,
,
где 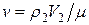 – количество молей воздуха в объёме;
– количество молей воздуха в объёме;
V 2, V 1 – объём того же количества молей v воздуха после перетекания через пористую перегородку.
Вычисления параметра а можно упростить, для чего в выражении (9) пренебрегаем вторыми слагаемыми в квадратных скобках:
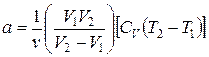 ,
,
где CV =20,786 Дж /(моль ∙ К).
Затем зная, что 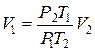 и, проведя не сложные алгебраические преобразования, окончательно получим:
и, проведя не сложные алгебраические преобразования, окончательно получим: