ЛАБОРАТОРНАЯ РАБОТА № 18
ИЗУЧЕНИЕ СПЕКТРА АТОМА ВОДОРОДА
Цель работы: изучение действия видимого, инфракрасного и ультрафиолетового излучения на организм; ознакомление с методикой измерения длин волн спектральных линий с помощью спектроскопа; исследование спектра атома водорода.
Задачи работы: 1)градуировка спектроскопа по известному спектру ртутной лампы; 2) измерение длин волн линий серии Бальмера атома водорода; 3) вычисление постоянной Ридберга и первого боровского радиуса.
Обеспечивающие средства: спектроскоп, ртутная и водородная лампы.
ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
Основы теории излучения
В результате углубления представлений о природе света, выяснилось, что свет обладает двойственной природой, получившей название корпускулярно-волнового дуализма света. С некоторыми объектами свет взаимодействует как электромагнитная волна, с другими - подобно потоку особых частиц (световых квантов или фотонов). То есть свет - это материальный объект, обладающий как волновыми, так и корпускулярными свойствами. В различных физических процессах эти свойства могут проявляться в различной степени. При определенных условиях, то есть в ряде оптических явлений свет проявляет свои волновые свойства (например, при интерференции и дифракции). В этих случаях необходимо рассматривать свет как электромагнитные волны. В других оптических явлениях (фотоэффект, эффект Комптона и т.д.) свет проявляет свои корпускулярные свойства, и тогда его следует представлять как поток фотонов. Иногда, оптический эксперимент можно организовать так, что свет будет проявлять в нем как волновые, так и корпускулярные свойства. Раздел физики, занимающийся изучением природы света, законов его распространения и взаимодействия с веществом, называется оптикой.
Свет - в узком смысле то же, что и видимое излучение, т. е. электромагнитные волны в интервале частот, воспринимаемых человеческим глазом (7,5-1014-4,3-1014 гц, что соответствует длинам волн λ в вакууме от 400 до 760 нм). Внутри данного интервала чувствительность глаза неодинакова, она изменяется в зависимости от воспринимаемой длины волны излучения. Наибольшей чувствительностью глаз обладает в зеленой области, что соответствует длине волны около 550 нм. Свет - в широком смысле – синоним оптического излучения, включающего, кроме видимого, излучение ультрафиолетовой УФ (10 нм < λ < 400 нм) и инфракрасной ИК областей спектра (760 нм < λ < 1 мм). Именно в оптическом диапазоне начинают отчётливо проявляться одновременно и волновые и корпускулярные свойства электромагнитного излучения.
Естественными источниками света являются Солнце, Луна, звёзды, атмосферные электрические разряды и т.д.; искусственными - устройства, превращающие энергию любого вида в энергию видимых (или оптических) излучений. Из искусственных источников света различают тепловые источники, в которых свет возникает при нагревании тел до высокой температуры, и люминесцентные, в которых свет возникает в результате превращения тех или иных видов энергии непосредственно в оптическое излучение, независимо от теплового состояния излучающего тела. Совершенно новый тип источников света представляют собой лазеры (оптические квантовые генераторы), которые дают когерентные световые пучки высоких интенсивностей, исключительной однородности по частоте и острой направленности.
Вопрос об излучении и поглощении света веществом относится не только к оптике, но и к учению о строении самого вещества (атомов и молекул).
В опытах Резерфорда (1911 год) было установлено, что атом любого химического элемента состоит из положительно заряженного ядра, вокруг которого расположены отрицательно заряженные электроны. В целом атом нейтрален. Совокупность электронов составляет электронную оболочку атома. Ядро, в котором сосредоточена почти вся масса атома, занимает ничтожно малую часть всего его объема. Диаметр ядра порядка 10-12-10-13 см. При этом размер самого атома, который определяется размерами его электронной оболочки, около 10-8 см. Опыты Резерфорда наводили на мысль о планетарной модели атома, в которой электроны (планеты) движутся вокруг ядра (Солнца) по замкнутым (например, в первом приближении по круговым) орбитам. Но в этом случае электроны будут двигаться с ускорением, и в соответствии с классической электродинамикой они должны непрерывно излучать электромагнитные (световые) волны. Процесс излучения сопровождается потерей энергии, поэтому в конечном счете электроны должны упасть на ядро, а атом прекратить свое существование. Таким образом, вопросы об устойчивости атомов и закономерностях в атомных спектрах оставались открытыми. (Cпектром излучения или поглощения называется зависимость интенсивности излучения или поглощения от частоты или длины волны света.)
Проанализировав всю совокупность опытных фактов, в 1913 году датский физик Нильс Бор пришел к выводу, что при описании атома, то есть устойчивого образования из ядра и электронов, следует отказаться от многих представлений классической физики. Он сформулировал постулаты, которым должна удовлетворять теория о строении атома.
Первый постулат: атом (электрон в атоме) может находиться только в особых стационарных или квантовых состояниях, каждому из которых соответствует определенное значение энергии (Е1, Е2,…, Еn,….). Таким образом, энергия атома (электрона в атоме) принимает только дискретные значения, или квантуется. В стационарных состояниях атом не излучает.
Второй постулат (правило частот Бора): при переходе атома (электрона в атоме) из одного стационарного состояния с энергией En в другое стационарное состояние с энергией Em излучается или поглощается квант света (фотон), энергия которого равна разности энергий стационарных состояний:
Ефотона = hνnm = En - Em, (1)
где h = 6,62·10-34 Дж×с – постоянная Планка, νnm - частота излучения (поглощения). Если En > Em, то происходит испускание света; если En < Em - поглощение. Формула (1) представляет собой закон сохранения энергии.
Зная частоту νnm можно найти длину волны  испущенной (поглощенной) электромагнитной волны:
испущенной (поглощенной) электромагнитной волны:

 , (2)
, (2)
где с = 3·108 м/с – скорость света в вакууме.
Энергетические уровни атома и условное изображение процессов испускания и поглощения света (переходы Е3 → Е2 и Е1 → Е2 , соответственно) приведены на рис.1.
На основе предложенных постулатов Бор создал теорию простейшего атома водорода и объяснил его линейчатый спектр. Выводы в теории Бора атома водорода полностью совпадают с выводами современной квантовой физики, которая строго и адекватно описывает строение и спектры атомных систем.
В своей теории, имеющей на данный момент только историческое значение, Бор рассматривал движение электрона вокруг ядра по круговым орбитам. Им было установлено, что соответствующие стационарным состояниям атома радиусы круговых орбит rn принимают дискретные значения (в системе СГСэ):
 , (3)
, (3)
здесь me – масса электрона; e – его заряд; n – номер орбиты (квантовое число), которое принимает значения 1, 2, 3… и т.д.
Формулу (3) можно записать в следующем виде:
 =
=  , (4)
, (4)
где
 - первый (n = 1) боровский радиус, (5)
- первый (n = 1) боровский радиус, (5)
 - постоянная Ридберга,
- постоянная Ридберга, 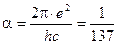 - постоянная тонкой структуры.
- постоянная тонкой структуры.

Рис. 1
Длины волн спектральных линий, испускаемых при квантовых переходах электрона в атоме водорода, определяются формулой Бальмера:
 =
=  (6)
(6)
Эта формула была предложена изучавшим атомные спектры Бальмером задолго до создания квантовой механики, а впоследствии получена теоретически Бором. Здесь n и m –квантовые числа (порядковые номера) верхнего и нижнего энергетических уровней, между которыми происходит квантовый переход. Формула (6) является одной из наиболее точных формул физики. Из нее следует, что все линии спектра испускания (поглощения) атома водорода могут быть объединены в серии. Серией называется совокупность линий, испускаемых при переходах электрона с вышележащих уровней с квантовыми числами n = m+1, m+2, m+3 и т.д. на уровень с квантовым числом m = const.
На рисунке 2 представлены энеpгетические уpовни и спектральные серии атома водоpода. Слева от уровней приведены соответствующие их порядковому номеру квантовые числа. В результате pазличных пеpеходов атома водоpода с более высоких уpовней на нижние образуются серии: Лаймана (m = 1, n = 2,3,4..); Бальмера (m = 2, n = 3,4,5..); Пашена (m = 3, n = 4,5,6..); Брэккета (m = 4, n = 5,6,7..); Пфунда (m = 5, n = 6,7,8..) и т.д. Согласно формуле (1) частоты спектральных линий пpопоpциональны длинам стpелок между уровнями энергии рассматриваемых квантовых пеpеходов. Видно, что самые большие частоты (малые длины волн) соответствуют линиям сеpии Лаймана. Сеpия Лаймана целиком лежит в ультpафиолетовой области спектра электромагнитных волн. Следующая сеpия - сеpия Бальмеpа (меньшие частоты или бόльшие длины волн) попадает уже в ближнюю ультрафиолетовую и видимую область спектра. Следующая сеpия - сеpия Пашена (еще меньшие частоты) находится в ближней инфpакpасной области, а линии остальных серий - в далеком инфракрасном диапазоне.
Видимая часть линейчатого спектра атома водорода (серия Бальмера) состоит из ряда линий, наиболее яркими из которых являются следующие три: красная - Ha (n = 3), голубая - Hb (n = 4), фиолетовая - Hg (n = 5).

Рис. 2.
Измерив длины волн этих линий с учетом формулы (6) можно экспериментально найти значение постоянной Ридберга R:
R =  (7)
(7)
Полученное значение R позволяет по формуле (5) вычислить первый боровский радиус и оценить линейные размеры атома водорода (l ~ 2· r 1 ).
Теория Бора при описании поведения атомных систем не отвергала полностью законы классической физики. В ней сохранились представления об орбитальном движении электронов в кулоновском поле ядра (в случае атома водорода - электрон вокруг ядра движется по круговым стационарным орбитам). Поэтому теорию Бора иногда называют полуклассической. Тем не менее, она сыграла огромную роль в создании атомной физики. В период ее развития (1913 - 1925 г.) были сделаны важные открытия, например, в области атомной спектроскопии. Однако, несмотря на удачное объяснение спектральных закономерностей водородоподобных атомов, которое совпадает с выводами из квантовой физики, теория Бора обладает рядом недостатков. В частности, она не может объяснить спектры излучения более сложных атомов и различную интенсивность спектральных линий. Эти трудности могут быть преодолены только квантовой теорией, учитывающей неприменимость классических представлений к микрообъектам. В то же время, постулаты Бора в приведенной выше формулировке (без указания на вращение электрона вокруг ядра по определенным орбитам) не противоречат представлениям современной физики и точно описывают стационарные состояния и квантовые переходы в атомах.
ПРАКТИЧЕСКАЯ ЧАСТЬ
Градуировка спектроскопа
Простейшим оптическим прибором, предназначенным для разложения света на спектральные составляющие и визуального наблюдения спектра, является спектроскоп. Современные спектроскопы, снабженные устройствами для измерения длин волн, называются спектрометрами.
Используемый в настоящей работе спектроскоп (рис.3) состоит из коллиматорной (1) и зрительной (4) труб, укрепленных на подставке (2); стеклянной призмы (3) под крышкой и микрометрического винта (5). Наблюдение спектральных линий ведется через расположенный на конце зрительной трубы окуляр.
Принципиальная схема призменного спектроскопа приведена на рис.4. Освещаемая светом исследуемого источника входная щель О коллиматорной трубы выделяет узкий пучок света. Входная щель находится в фокусе коллиматорной линзы O1, которая формирует параллельный пучок лучей, падающих на диспергирующий элемент - призму. Проходя через призму, лучи света дважды преломляются, в результате чего отклоняются от своего первоначального направления. Вследствие зависимости показателя преломления призмы от длины волны падающего излучения (это явление называется дисперсией), свет сложного спектрального состава разлагается призмой на несколько идущих по разным направлениям лучей с различными длинами волн. При этом лучи с меньшей длиной волны (фиолетовые) отклоняются призмой от своего первоначального направления сильнее, чем лучи с большей длиной волны (красные). Линза 02 зрительной трубы фокусирует эти пучки света и создает в разных точках фокальной плоскости цветные линии - изображения входной щели. Эти линии образуют линейчатый спектр испускания атомов, входящих в состав изучаемого источника света. Измерив длины волн этих линий и сравнив найденные значения с табличными данными о спектрах различных химических элементов, можно узнать, какому элементу принадлежит исследуемый спектр. Эта методика лежит в основе эмиссионного спектрального анализа.

Рис. 3

Рис.4
Работа со спектроскопом начинается с его градуировки. Градуировкой спектроскопа называют процесс, с помощью которого устанавливается связь между отсчетом по шкале микрометрического винта и длиной волны спектральной линии, расположенной против нити (визира) в зрительной трубе. Для градуировки используется эталонный источник света, у которого имеются линии во всех областях спектра. Длины волн этих линий должны быть известны с высокой точностью. Результаты градуировки представляются в виде графиков, таблиц или в виде новой шкалы.
В настоящей работе в качестве эталонного источника света используется ртутная лампа сверхвысокого давления типа СВД-125 или ДРШ. Изготовленная из специального кварцевого стекла и заполненная парами ртути трубка лампы пропускает свет в очень широком диапазоне (включая видимую и ультрафиолетовую области спектра). Трубка лампы (для защиты глаз от ультрафиолетовых лучей) помещена в светонепроницаемый корпус с небольшим окном для выхода излучения. Запрещается смотреть непосредственно на выходное окно ртутной лампы, т.к. при прямом попадании света в глаза возможен ожог сетчатки глаза.
Включите ртутную лампу с помощью тумблера, расположенного на задней панели светонепроницаемого корпуса. Лампа должна прогреться в течение 10 минут. Выходное окно включенной ртутной лампы необходимо расположить напротив входной щели коллиматорной трубы спектроскопа. Обычные стеклянные линзы и призма спектроскопа задерживают ультрафиолетовое излучение, поэтому в окуляре зрительной трубы будут видны только отдельные спектральные линии различного цвета и интенсивности, принадлежащие видимому спектру ртути. Наблюдая спектр в окуляр, перемещением ртутной лампы добейтесь максимальной яркости спектральных линий. Вращение микрометрического винта приводит к повороту зрительной трубы в горизонтальной плоскости вокруг вертикальной оси, и расположенная в окуляре нить (визир) будет перемещаться по спектру. Измерения рекомендуется проводить при перемещениях нити от желтой к фиолетовым линиям. Совместите визир со спектральной линией ртути. Перемещая окуляр вдоль зрительной трубы, получите наиболее четкое изображение этой линии. При необходимости дополнительно поверните микрометрический винт и снова совместите визир с линией. (Для получения наиболее точных измерений визир всегда должен приближаться к линии только с одной стороны, в нашем случае - с правой.) Занесите показания шкалы микрометрического винта для соответствующего цвета в таблицу 1. (Один полный оборот винта соответствует 50 малым делениям на барабане. Если у вас получилось 5 полных оборотов и 7 малых делений - всего малых делений будет 257.) Длина волны спектральных линий ртути в таблице приведена в нанометрах (1нм = 10-9 м). Проведите измерения для других линий и заполните таблицу 1. Выключите ртутную лампу.
Таблица 1
| Спектральные линии Hg | желтая | зелёная | голубая | сине-голубая | фиоле-товая | фиоле-товая |
| Длина волны, 10-9 м | 579,0 | 546,1 | 491,6 | 435,8 | 407,8 | 404,7 |
| Показания шкалы микро-винта в малых делениях |
По данным таблицы 1 на миллиметровой бумаге постройте градуировочный график (градуировочную кривую спектроскопа). По оси ординат OY откладываются длины волн спектральных линий ртути, по оси абсцисс OX — соответствующие им показания по шкале микрометрического винта. Градуировочный график должен иметь вид плавной монотонной линии. С его помощью по измеренным значениям положений (делений шкалы микровинта) спектральных линий любого другого излучения можно определить их длины волн.
Изучение спектра атома водорода
В настоящей работе изучаются спектральные линии серии Бальмера атома водорода, так как часть этих линий лежит в видимой области спектра: красная - Ha, голубая - Hb, фиолетовая - Hg. Для экспериментального определения постоянной Ридберга, необходимо измерить длины волн этих спектральных линий.
Включите источник питания водородной лампы. Расположите выходное окно лампы и спектроскоп так, чтобы спектральные линии атома водорода были наиболее яркими. Вращением микрометрического винта совместите визир окуляра с красной линией серии Бальмера. Перемещая окуляр вдоль зрительной трубы, получите наиболее четкое изображение этой спектральной линии. Занесите показания шкалы микрометрического винта в таблицу 2. Проведите измерения для голубой и фиолетовой линий атома водорода. Выключите водородную лампу.
Таблица 2
| Спектральные линии серии Бальмера атома водорода | красная - Ha | голубая - Hb | фиолетовая - Hg | |||
| Квантовые числа | m = | n = | m = | n = | m = | n = |
| Показания шкалы микро-винта в малых делениях | ||||||
| Длина волны, м | ||||||
Впишите в таблицу 2 квантовые числа энергетических уровней, между которыми происходит переход с испусканием соответствующей спектральной линии. Длины волн этих линий определите из градуировочного графика и переведите их в систему СИ (метры).
По формуле (7) найдите величину постоянной Ридберга для каждой длины волны. Вычислите среднее значение постоянной Ридберга  и случайную погрешность
и случайную погрешность  , связанную с разбросом экспериментальных данных:
, связанную с разбросом экспериментальных данных:
 , (8)
, (8)
 . (9)
. (9)
Используя в формуле (5)  рассчитайте первый боровский радиус и оцените линейные размеры атома водорода. Заполните таблицу 3.
рассчитайте первый боровский радиус и оцените линейные размеры атома водорода. Заполните таблицу 3.
Таблица 3
| Постоянная Ридберга, м-1 | случайная погреш-
ность  , м-1 , м-1
| первый боров-ский радиус, м | линейные разме-ры атома H, м | |||

| 
| 
| 
| |||
Сравните полученную величину первого боровского радиуса  с теоретическим значением
с теоретическим значением  = 0,529 · 10-10 м. Рассчитайте относительную погрешность определения первого боровского радиуса
= 0,529 · 10-10 м. Рассчитайте относительную погрешность определения первого боровского радиуса  .
.
ПОРЯДОК ВЫПОЛНЕНИЯ РАБОТЫ
ВНИМАНИЕ! В работе применяется ртутная лампа, являющаяся мощным источником ультрафиолетового излучения. Запрещается смотреть непосредственно на выходное окно ртутной лампы, т.к. при прямом попадании света в глаза возможен ожог сетчатки глаза.
1. Ознакомиться с устройством спектроскопа.
2. Включить ртутную лампу и прогреть ее в течение 10 минут.
3. Установить выходное окно лампы против входного окна коллиматорной трубы спектроскопа.
4. Перемещением ртутной лампы добиться максимальной яркости спектральных линий, наблюдаемых в окуляр зрительной трубы.
5. Вращением микрометрического винта совместить визир окуляра с предварительно сфокусированной желтой линией ртути. Записать показания шкалы микровинта.
6. Провести измерения для других линий ртути и заполнить таблицу 1. Выключить ртутную лампу.
7. По данным таблицы 1 построить градуировочный график - зависимость длины волны спектральных линий ртути от показаний шкалы микрометрического винта.
8. Включить водородную лампу и разместить ее у входного окна спектроскопа.
9. Определить положение спектральных линий серии Бальмера атома водорода. Внести показания шкалы микрометрического винта в таблицу 2. Выключить водородную лампу.
10. С помощью градуировочного графика найти длины волн линий Ha, Hb и Hg атома водорода. Заполнить таблицу 2.
11. По формуле (7) найти величину постоянной Ридберга для каждой измеренной длины волны.
12. По формулам (8) и (9) соответственно вычислить среднее значение постоянной Ридберга  и случайную погрешность
и случайную погрешность  .
.
13. Используя в формуле (5)  рассчитать первый боровский радиус и оценить линейные размеры атома водорода. Заполнить таблицу 3.
рассчитать первый боровский радиус и оценить линейные размеры атома водорода. Заполнить таблицу 3.
14. Найти относительную погрешность определения первого боровского радиуса  .
.
15. Сделать вывод и оформить отчет.
КОНТРОЛЬНЫЕ ВОПРОСЫ
1. Что такое свет? Какими свойствами он обладает? В каких опытах эти свойства
наблюдаются?
2. Какие области спектра электромагнитных волн включены в понятие оптического излучения? Укажите их диапазоны.
3. Как устроен атом?
4. Сформулируйте постулаты Бора.
5. Чему равна частота испущенного или поглощенного светового кванта?
6. Как найти длину волны света?
7. Запишите формулу Бальмера. Поясните все входящие в нее величины.
8. Что такое первый боровский радиус? Как оценить линейные размеры атома?
ИСПОЛЬЗУЕМАЯ И РЕКОМЕНДУЕМАЯ ЛИТЕРАТУРА
1. Савельев И.В. Курс общей физики. Квантовая оптика. Атомная физика./ М.: Наука, 1998. - 480 с. (§ 3.1 - § 3.6 стр.51-68)






