До окиснювальних методів належать:
Ø Окиснювальні;
Ø Термоокиснювальні;
Ø Електрохімічні;
Ø Радіаційно-окиснювані.
Термоокиснювальні методи окиснення: паро фазне, рідкофазне окиснення, паро фазне каталітичне окиснення. Термоокиснення полягає в окисненні забруднювачів води киснем повітря при високій температурі. Часто виступає єдиним можливим методом знезараження токсичних вод.
Електрохімічні процеси окиснення
Окиснення – процес втрати (передачі) атомом, молекулою, іоном одного або декількох електронів. При відновленні електрони приєднуються. Будь-який процес окиснення завжди зв’язаний з процесом окиснення. Окисно-відновні реакції – процеси переміщення електронів від донора до акцептора.
Загальне число електронів в системі під час такої реакції не змінюється. Як окисники можна використовувати: метали вищого ступення окиснення (Cu2+, Cr6+, Fe3+), неметали 6-ої і 7-ої групи періодичної системи, для яких характерна висока електронегативність (Сl, F, Br), а також такі сполуки: Н2О2, KClO3, KClO4, KMnO4.
Метали з найбільш низьким ступенем окиснення лише відновні властивості. Неметали з від’ємним ступенем окиснення – відновники (Н2S).
Рушійна сила окисно-відновних реакцій – різниця електродних потенціалів для кожної напівреакції. Загальне рівняння:
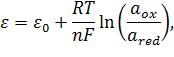
ε – електрохімічний потенціал; ε0 – стандартний електрохімічний потенціал; n – число електронів, що беруть участь в реакції; F – число Фарадея; 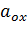 ,
, 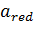 – активності сполук, що беруть участь в реакції.
– активності сполук, що беруть участь в реакції.
Природа речовин, що беруть участь в окисно-відновному перетворенні враховується стандартним елктрохімічним потенціалом. (в стандартих таблицях в порядку зростання – від найбільш негативного, до найбільш позитивного).
Окисно-відновна реакція може проходити лише в напрямку, при якому окисник з позитивним значенням ε0. В процесі окиснення-відновлення (ОВ) потенціали електродні потенціали обох напівреакцій змінюються.
Потенціал окисника більш позитивний, відновника – більш негативний. При їх вирівнюванні наступає рівновага.
Хлор і його сполуки
Газоподібний хлор і його сполуки: діоксид хлору, гіпохлорити, концентрація його оцінюється по величині активного хлору. При розчиненні у воді хлор гідролізує з утворенням HCl і хлорнуватистої кислоти HClO. Ріст рН приводить до зміни форми активного хлоруз утворенням гіпохлорит іонів. Сильнокисле середовище – активний хлор, рН 5 – хлорнуватиста кислота, рН 10 – гіпохлорити.
Сl2 – ε0=1,352 В
HClO − ε0=1,5 В
Гіпохлорит – ε0=0,906 В
Хлорноватиста кислота існує тільки в розчині, розкладається на світлі з виділенням О2, гіпохлорит більш стійкий і використовується частіше. Гіпохлорит більш стійкий – використовується частіше. В водо підготовці використовують хлорне вапно Ca(ClO)2. Дуже сильний окисник СlО2 (ε0=1,5 В), зеленожовтий газ. Порівняно з Сl2 володіє більш високими дезодоруючими і бактерицидними властивостями, не утворює токсичної органіки, але утворю токсичні хлорати і перхлорати. Сl2, хлорноватиста кислота, гіпохлорити легко взаємодіють з аміаком і солями амонію з утворенням хлорамінів.
Пероксид водню Н2О2
Проявляє ОВ властивості як в лужному, так і в кислому середовищі. Окисна функція чіткіше в кислому середовищі, відновна – в лужному. Н2О2 легко переводить неорганічні сполуки в нижчі ступені окиснення: NO‾2 → NO‾3, SO‾3 → SO‾4, Fe (ІІ) → Fe (ІІІ). В лужному середовищі (рН 9-13) окисляє ціаніди до ціанатів. Дія Н2О2 посилюється при наявності каталізатора – іонів металів змінної валентності (Cu, Cr, Fe, Mn, Ag і т. д.). Н2О2 використовується в системі Фентона, реакція в якій обумовлена утворенням високоактивних гідроксильних радикалів, утворення яких прискорюється в присутності світла.
Н2О2 достаньо легко окиснює ПАВ, алкілбензилсульфонати окислюються на 98 % до СО2 та Н2О. В чистому вигляді використовувати Н2О2 занадто дорого.
Озон О3
Окисна здатність висока ε0=2,7 В, але в лужному середовищі менша ε0=1,24 В. при нормальній температурі руйнується велика кількість органічних речовин навіть при низьких дозах. Добре розчиняється у воді, але це залежить від рН і наявності домішок. При наявності кислот і солей – розчинність зростає, в лужному середовищі – знижується. Дисоціює на повітрі і в водному розчині. Швидше дисоціює і розкладається у водному розчині при вищих рН і температурі. Стійкість в нейтральному і кислому середовищі зумовлена утворенням НО3, що має гідратну оболочку, яка захища даний асоціат. Розклад О3 у водіприскорюєнаявність металів змінної валентності. Прискорення окиснення: ВаО2, Р2О5. Пластмаси F, Cl –вмісні, скло – не впливают ь на стабільність озону. Високе значення потенціалу О3 в воді нейтралізується тим, що процес розчинення відбувається в гетерофазній системі, що впливає на швидкість первинного розчинення озону у водію Розчинність О3 підпорядковується закону Генрі, коефіцієнт розчинності при атмосферному тиску становить 0,2-0,4.
Параметри для розрахунку камери знезараження: величина концентрація*температура. Оптимальна доза – 1,6 мг/хв. Для ефективного знезараження необхідно ввести 0,4 мг/дм3 протягом 4 хв. З більшістю органічних сполук реагує до проміжних продуктів: альдегіди, кетони, карбонові кислоти. При взаємодії ароматики з озоном утворюються гліоксаль, гліоксалеві кислоти. Наявність ОН-групи (фенол) збільшує швидкість і ступінь окиснення. Полядерна ароматика руйнується озоном значно легше як похідні С6Н6. О3 використовується для видалення алкенів з стічних вод. Якщо вони містять метильні групи, то вони окиснюються до формальдегіда і мурашиної кислоти. Аміно групи повністю переходять в нітратні. Органічні кислоти легко окиснюються до СО2 і Н2О. У випадку окиснення неорганічних сполук озоном, в окисненні приймає участь тільки 1 атом О, і виділяється О2: Mn → MnO4, N → N2O5, NH3→ NH4NO3. Галогени утворюють вищі оксиди, ціаніди – карбонат амонію і карбамід. Озон чинить дуже сильну бактерицидну дію, і на відміну від хлору руйнує цитоплазму клітин бактерій, коли хлор діє тільки на ферменти, а віруси не мають ферментної системи.
О2 повітря
Молекулярний кисень ε0=1,229 В. Легко окиснеює фенол С6Н5ОН, утворюючи аніони карбонових кислот, а при великих дозах СО2 і Н2О.Застосовується для очистки нафтовмісних СВ (стічних вод), особливо в окисних баштах.
Сполуки Mn
В технології використовується KMnO4, MnO2. KMnO4 – потужний окисник органічних сполук. Напрямок реакції залежить від рН середовища: в кислому – реакція з приєднанням 5 електронів, в слабко лужному – 3 електрони, в сильно лужному – 1 електрон. Взаємодія перманганату і органічних сполук може здійснюватись по 2 механізмах:
1. Пряма взаємодія KMnO4 з органічною речовиною;
2. Дія проявляється лише після накопичення в розчині проміжних сполук, які збільшують швидкість реакції. Такий процес називається автокаталітичним.
Крім KMnO4 використовується MnO2, не дивлячись на малу розчинність у воді при наявності невеликих концентрацій кислот MnO2 легко вступає в реакції з відновниками, переходячи в Mn (ІІ).
Солі Mn2+ в результаті обробки лугом і киснем повітря знову переходять MnO2 (режим фільтрації через завантаження Mn-руди). MnO2 є не тільки окисником, але і каталізатором окиснення, якщо використовується О2, О3, Н2О2. В такій комбінації ці системи легко окиснюють сірковмісні сполуки, сприяють окисненню формальдегіду киснем до СО2 і Н2О.
АОР процеси
АОР процеси – окисні процеси підвищеної ефективності, які включають деяку групу технологій, до яких відносяться:
- Пряме озонування;
- О3 + Н2О2;
- О3 + Н2О2 + УФ;
- Напівпровідникові каталізатори + УФ;
- Системи Фентона;
- Системи Раффа;
- Ультразвукова обробка;
- Рідкофазне окиснення.
В загальному процеси АОР можуть бути визначенні як окисні методи, що базуються на використанні високоактивних радикалів – гідроксильних ‾ОН та ін.
Переваги АОР:
- Швидкість реакції;
- Неселективне окиснення – обробка різномаїття забруднювачів одночасно.
Різні варіанти складу АОР процесів дозволяють у всіх випадках досягнути необхідну глибину очистки від всіх органічних сполук.
О3/Н2О2 – пероксон процес, використовується для видалення мікродомішок СВ і усуває запахи і присмаки, видаляє органіку, знижує концентрацію бромат-іонів. Спільне використання покращує масоперенос О3 з газової фази в рідку. Ефективність використання залежить від:
1. Природи і концентрації окиснюваних сполук і наявності відповідних домішок.
2. Від точки введення і способу дозування Н2О2.
3. Співвідношення доз реагентів.
4. рН середовища.
Різні супутні сполуки (гумінові і фульвокислоти) при підвищених концентраціях знижують ступінь деструкції цільового продукту, знижують ступінь дисоціації Н2О2 у воді на радикали. Підвищений вміст гумінових і фульвокислот приводит до підвищення дози окисника. При низьких концентраціях цих кислот відбувається більш інтенсивний розклад озону і генерування активних радикалів. При низьких концентраціях ці кислоти ініціюють вільно радикальне окиснення.
Точка вводу окисника в систему обирається там, де максимально знижено концентрацію супутних домішок (гумінових і фульвокислот).
Оптимальний діапазон співвідношення дозованих Н2О2 до О3: від 0,5 до 0,7 моль/моль. Надлишок Н2О2 понижує ступінь очистки і збільшує витрату О3.
При рН>5 спостерігається значне пришвидшення розкладу Н2 і Н2О2 з утворенням вільних радикалів. Відомо, що при певних умовах сам О3 або УФ приводить до утворення у воді Н2О2. Якщо правильно підібрати технологічні умови, то можна не вводити Н2О2. В даному випадку реакція окиснення може успішно проходити при високих концентраціях гумінових і фульвокислот.
УФ опромінення
УФ опромінення покриває область довжини хвиль від 1 до 350 нм. Цю область розділяють на декілька різних областей:
УФ-А – λ= 350-315 нм
УФ-Б – λ= 315-280 нм
УФ-А – λ= 280-200 нм
УФ-вакуумний – λ= 200-100 нм
Екстримальний УФ – λ= 100-1 нм
Спільне джерело УФ: ртутні лампи низького тиску, парціальний тиск Hg – 1 Па. Цей тиск відповідає тиску пари Hg на стінку лампи. Ближній УФ – до 200 нм, дальній (вакуум) – 200-10 нм. Вакуумний інтенсивно поглинає атмосферою і розповсюджується тільки у вакуумних камерах.
Головними резонансними лініями є довжини хвиль 253,7 нм і 184,9 нм. Найбільш інтенсивною емісією для Hg-лампи низького тиску є 254 нм. Ця емісія найбільш ефективна для знезаражування і використання в процесах АОР.
Вакуум УФ приводить до фотолізу води з утворенням гідроксильних радикалів. Вакуум УФ фотоліз – ефективний метод окиснення, внаслідок великої швидкості гідроксильних радикалів.
При УФ опроміненні розчин О3 дисоціює з утворенням молекули О2 і атомарного кисню, який взаємодіє з водою з утворенням Н2О2.
Крім комбінації УФ з О3 і О3 з Н2О2 в АОР існує інший варіант розкладу О3 з генерацією оксидних і гідроксид них радикалів: О3 + УЗ, О3 + γ-випромінювання. Останнім часом з’являються нові підходи до УФ опроміненя для процесів окиснення – імпульсне випромінювання. Імпульсне УФ має великий спектр інтенсивностей в діапазоні 90-300 нм і забезпечує глибоку деструкцію органіки. Джерело: імпульсні розряди в інертних газах або в їх сумішах з галогенами (ексимерні суміші). Використовуються ксенонові лампи. Їх основна перевага: велика пікова потужність імпульсу в 5-10 МВт при тривалості імпульсу в декілька сотень мкс. На діапазоні довжин хвиль200-300 нм відбувається 25-30 % всього випромінення з урахуванням втрат при пропусканні бактерицидних ефектів від тієї енергії, що вкладається при отриманні. Для ксенонових імпульсних ламп характерні високі затрати енергії.
Даний процес імпульсного опромінення називається фотолізом. УФ знезаражує шляхом розриву клітини.
Первинний процес в імпульсному УФ – фото дисоціація хімічних зв’язків органічних сполук. Продукти фоторозкладу можуть дооокиснятись О2, О3 та Н2О2. Спільне використання імпульсного УФ випромінення і окисників підвищує ефективність деструкції органічних сполук і знижує тривалість процесу. Досягають швидкості деструкції органічних домішок 1 мг/дм3 за 1 с. Це дозволяє знизити час обробки води до 1 хв.
Системи Фентона і Раффа
Це гомогенно-каталітичні системи Н2О2 з іонами Fe (II) - Фентон або з Fe (IІI) – Раффа.Вони засновані на генерації вільних радикалів при каталізаторі – іон Fe.
Система Фентона реалізується в слабкокислому середовищі при рН < 2 і при умові, що співвідношення концентрацій Н2О2 до концентрації Fe (II) знаходиться в межах > 0,5 але <200. При зростанні даного співвідношення >200 Н2О2 розкладається з виділенням кисню.
Система Раффа реалізується більш ефективно вже при більш високих рН 3 і при значному надлишку Н2О2 над вмістом Fe (ІII). Загальна схема утворення радикалів однакова, але початкова швидкість розкладу Н2О2 в присутності Fe (ІII) значно нижче, ніж при Fe (II).






