Опытные газовые законы. Уравнение состояния идеального газа.
Газовые законы были установлены в 17–18 веках экспериментально. Однако, их можно получить, используя основные положения молекулярно-кинетической теории идеальных газов.
Закон Бойля–Мариотта. Утверждение закона Бойля — Мариотта состоит в следующем[3][4][5]:
При постоянных температуре и массе газа произведение давления газа на его объём постоянно.
В математической форме это утверждение записывается в виде формулы

где 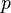 — давление газа;
— давление газа;  — объём газа, а
— объём газа, а  — постоянная в оговоренных условиях величина. В общем случае значение
— постоянная в оговоренных условиях величина. В общем случае значение  определяется химической природой, массой и температурой газа.
определяется химической природой, массой и температурой газа.
. Закон Гей-Люссака. — при постоянном давлении объём постоянной массы газа пропорционален абсолютной температуре


Объем V данной массы газа при постоянном давлении газа прямо пропорционален изменению температуры

Закон Гей-Люссака справедлив только для идеальных газов, реальные газы подчиняются ему при температурах и давлениях, далеких от критических значений. Является частным случаем уравнения Клайперона.
Уравнение состояния идеального газа (иногда уравнение Клапейрона или уравнение Менделеева — Клапейрона) — формула, устанавливающая зависимость между давлением, молярным объёмом и абсолютной температурой идеального газа. Уравнение имеет вид:
 ,
,
где
· 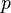 — давление,
— давление,
·  — молярный объём,
— молярный объём,
·  — универсальная газовая постоянная
— универсальная газовая постоянная
·  — абсолютная температура, К.
— абсолютная температура, К.
Так как 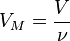 , где
, где  — количество вещества, а
— количество вещества, а  , где
, где  — масса,
— масса,  — молярная масса, уравнение состояния можно записать:
— молярная масса, уравнение состояния можно записать:

Уравнение молекулярно-кинетической теории для давления (уравнение Клаузиуса).
Уравнение Клапейрона — Клаузиуса — термодинамическое уравнение, относящееся к квазистатическим (равновесным) процессам перехода вещества из одной фазы в другую (испарение, плавление, сублимация, полиморфное превращение и др.). Согласно уравнению, теплота фазового перехода (например, теплота испарения, теплота плавления) при квазистатическом процессе определяется выражением

где  — удельная теплота фазового перехода,
— удельная теплота фазового перехода,  — изменение удельного объёма тела при фазовом переходе.
— изменение удельного объёма тела при фазовом переходе.
уравнение - клапейрона-клаузиуса обычно используют для изучения влияния температуры на равновесное давление пара над жидкостью или твердым веществом (определяют dp/dT); обратная величина dT/dp описывает влияние давления на температуру кипения или сублимации.
К. — К. у. может служить для расчёта любой из величин, входящих в уравнение, если остальные известны. В частности, с его помощью рассчитывают теплоты испарения, экспериментальное определение которых сопряжено со значительными трудностями






