В тканях обычно присутсвуют следовые каличества многих Me. Живые организмы нуждаются в катионах Ме, обеспечивающих протекание многих жизненно важных процессов: а) тяж. Ме (Co, Cu. Fe, Mn. Mo, Zn, Ni, Pb, V) б) легкие Ме (Ca, K, Na, Mg)
1) Токсическое действие чужеродных Ме обусловлено антагонизмом катионов.(вытеснение одним Ме другого,пример Pb выталк.Са)
2)Cинергического действия Ме
Реакция (ρ) организма на тяжелые Ме является двухфазной.
1) мало Ме в организме – тяжелый ущерб
2) много Ме – токсическое действие
Много веществ способно связываться с Ме с образованием хелатных соединений. Образование хелатных связей O и N происходит,когда получаются 5 и 6 – член. циклы.
Константа устойчивости- мера прочности связей и характеризует равновесие м/у лигандами и ионом Ме. Для комплекса в соотношении 1:1 константу устойчивости обычно определяют потенциометрическим титрованием лигандов в присутствии или отсутствии Ме и обработкой результатов сложных вычислений. Понятие «лиганд» относится к молекулам органического соединения,находящейся в соответствующей форме, способна связывать катион металла. Ме по своему сродству к большинству хелатирующих агентов располагаются в след порядке (от наибольшего к наименьшему):
Fe3+, Hg2+, Cu2+, Al3+, Ni2+, Pb2+, Co2+, Zn2+, Fe2+, Cd2+, Mn2+, Mg2+, Ca2+, Li+, Na+, K+.
Повышение сродства к хелатирующим агентам является следствием уменьшения ионного радиуса и увеличения валентности Ме. Хелатообразование зависит от степени ионизации хелатообразующих агентов. Вещества, обладающие меньшим сродством к Ме способны образовывать значительно больше анионов.
Большинство Ме легче соединяются с лигандами, содержащими кислород, чем серу. Ме может изменять избирательность органического лиганда:
а) влияя на распределение электронов в лиганде;
б) повышая реакционную способность активного центра лиганда;
в) вызывая изменение конформации лиганда;
г) обеспечивая возможность присоединения или отрыва электрона;
д) увеличивая липофильность лиганда иего способность проникать в клетку.
Нельзя также не считаться и с тем фактом, что многие металлы способны образовывать с органическими веществами хелатные соединения и другие комплексы. Эти комплексы, как правило, являются для организма чужеродными, хотя бы на первом этапе их поступления. Не исключено, что при последующем распаде хелатобразованного комплекса составляющие его агенты окажутся также ксенобиотиком для определенных организмов.
В последнем случае эти чужеродные соединения подвергнутся метаболическим превращениям (в случае органических ксенобиотиков). Рассмотрим примеры трансформации неорганических соединений.
Металлы в живой клетке
Живые организмы нуждаются в катионах металлов, обеспечивающих протекание многих жизненно важных процессов. Более того, многие из этих металлов необходимы для всех форм жизни. К ним относятся:
а) тяжелые металлы (кобальт, медь, железо, марганец, молибден, цинк и в меньших количествах хром, ванадий, никель и свинец);
б) легкие металлы, обычно встречающиеся в большом количестве (кальций, магний, калий и натрий).
Медь, железо, молибден, кобальт и иногда марганец принимают участие в окислительно-восстановительных процессах; действие цинка, магния и марганца связано с процессами гидролиза и переноса групп; кальций играет наиболее важную роль при создании гибких или жестких структур, а также может инициировать реакцию, вызывая по-видимому, структурные изменения (подобное действие иногда проявляет и магний), является вторичным мессенджером. Натрий и калий, благодаря их распространенности, служат переносчиками заряда; они очень слабо связываются и поэтому могут быстро обмениваться. Когда речь идет о тяжелых металлах, то многие из них необходимы в следовых количествах. Повышенные же их концентрации в организме вызывают токсические эффекты.
Токсическое действие чужеродных металлов часто обусловлено антагонизмом катионов. Так, например, свинец — известный нейротоксин, вытесняет кальций из некоторых отделов нервной системы и тем самым препятствует выделению нейромедиаторов. С другой стороны, известны случаи синергического действия металлов. Например, показано, что внесение отдельных металлов в концентрациях, соответствующих предельно-допустимым (Канада, США), в культуру водорослей хлорелла, сценедесмус и других не влияло на рост клеток, тогда как их смесь сильно подавляла рост, даже при более низких концентрациях. Число таких примеров достаточно велико.
Относительно концентрационных эффектов металлов следует подчеркнуть, что реакция (р) организма на тяжелые металлы является двухфазной (рис 7.1).
Если организм получает слишком мало металлов, ему наносится тяжелый ущерб. Это объясняется тем, что в организме содержится множество ферментов, которые могут функционировать только в присутствии тяжелых металлов, хотя бы в следовых количествах. Однако если организм получает слишком много металла, то наступает вторая фаза, связанная с токсическим действием избыточного количества.
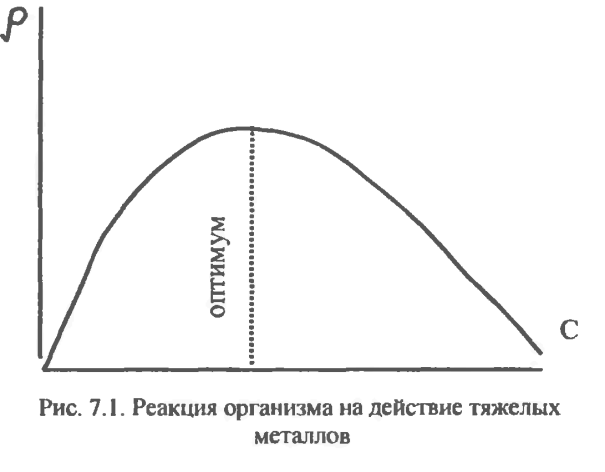
Примером такой двухфазной реакции может служить действие меди на овес: как избыточное, так и недостаточное количество этого металла наносит вред процессам его роста и развития (см. рис. 7.1).
Рост микроорганизмов также часто зависит от концентрации одного или нескольких катионов металлов в питательной среде: следует избегать как избыточных, так и недостаточных концентраций, так как в любом случае рост будет заторможен.






