| Способы разделения смесей | |
| Однородные (гомогенные) | Неоднородные (гетерогенные) |
| Дистилляция (вода-поваренная соль) | Фильтрование (вода-песок) |
| Кристаллизация (вода-сахар) | Отстаивание (вода-мел) |
| Выпаривание (вода-поваренная соль) | Центрифугирование (вода-мел) |
| Перегонка (нефть) | Магнитная сепарация (железо-медь) |
Каждый компонент смеси сохраняет набор своих характеристик, поэтому разные вещества можно выделить из смеси.
Отстаивание – это способ, основанный на различной плотности веществ.
Например, смесь растительного масла и воды можно разделить на масло и воду, дав смеси просто отстояться.
Фильтрование – это способ, основанный на различной способности фильтра пропускать вещества, из которых состоит смесь. Например, с помощь фильтра можно отделить твердые примеси от жидкости.
Выпаривание– это выделение нелетучих твердых веществ из раствора в летучем растворителе – в частности в воде. Например, чтобы выделить соль, растворенную в воде, надо просто выпарить воду. Вода испарится, а соль останется.
Приготовление растворов.
Химическое загрязнение окружающей среды и его последствия.
А14. Качественные реакции, индикаторы, газы.
А14. Определение характера среды раствора кислот и щелочей с помощью индикаторов. Качественные реакции на ионы в растворе (хлорид-, сульфат-, карбонат-ионы, ион аммония). Получение газообразных веществ. Качественные реакции на газообразные вещества (кислород, водород, углекислый газ, аммиак).
1) Таблица изменения окраски индикаторов в различных средах:
| Индикатор | Лакмус | Метилоранж | Фенолфталеин | Универсальный |
| Кислая среда | Красный | Розовый | Бесцветный | Красно-фиолетовый |
| Нейтральная | Фиолетовый | Оранжевый | Бесцветный | Жёлтый |
| Щелочная | Синий | Желтый | Малиновый | Фиолетовый |
2) Качественные реакции на ионы в растворе.
На катионы:
| Катион | Реактив | Наблюдаемая реакция |
| Li+ | пламя | Карминово-красное окрашивание |
| Na+ | пламя | Желтое окрашивание |
| К+ | пламя | Фиолетовое окрашивание |
| Са2+ | пламя | Кирпично-красное окрашивание |
| Sr2+ | пламя | Карминово-красное окрашивание |
| Ва2+ | пламя SО42- | Желто-зеленое окрашивание Выпадение белого осадка, не растворимого в кислотах: Ва2+ + SО42- → BaSО4 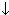
|
| Сu2+ | ОН- | Выпадение осадка синего цвета: Сu2+ + 2ОН- → Сu(ОН)2 |
| РЬ2+ | S2- | Выпадение черного осадка: Pb2+ + S2- → PbS 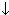
|
| Аg+ | Cl- | Выпадение белого осадка; не растворимого в HNO3, но растворимого в конц. NH3 • Н2О: Аg+ +Cl- →AgCl 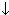
|
| Fe2+ | 1) ОН- 2) гексациано-феррат (III) калия (красная кровяная соль), K3[Fe(CN)6] | 1) Выпадение светло-зелёного осадка: Fe2++ 2ОН- → Fe (ОН)2 2) Выпадение синего осадка: К++ Fe2+ + [Fe(CN)6]3-→ KFe[Fe(CN)6]4 |
| Fe3+ | 1) ОН- 2) гексацианоферрат (II) калия (желтая кровяная соль) K4[Fe(CN)6] 3) роданид-ион SCN- | 1) Выпадение бурого осадка:
Fe3+ + 3ОН- → Fe (ОН)3
2) Выпадение синего осадка:
К+ + Fe3+ + [Fe(CN)6]4- → KFe[Fe(CN)6] 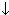 3) Появление ярко-красного окрашивания за счет образования комплексных ионов Fe(SCN)2+, Fe(SCN)+2
3) Появление ярко-красного окрашивания за счет образования комплексных ионов Fe(SCN)2+, Fe(SCN)+2
|
| Al3+ | щелочь (амфотерные свойства гидроксида) | Выпадение осадка гидроксида алюминия при приливании первых порций щелочи и его растворение при дальнейшем приливании |
| NH4+ | щелочь, нагревание | Запах аммиака: NH4+ + ОН-→ NH3  + Н2О + Н2О
|
| Н+ (кислая среда) | индикаторы: лакмус, метиловый оранжевый | красное окрашивание красное окрашивание |
На анионы:
| Анион | Реактив | Наблюдаемая реакция |
| SО42- | Ва2+ | Выпадение белого осадка, нерастворимого в кислотах: Ва2+ + SО42- 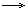 BaSО4 BaSО4 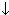
|
| NО3- | Добавить конц. H2SO4 и Си, нагреть | Образование голубого раствора, содержащего ионы Сu2+, выделение газа бурого цвета (NO2) |
| РО43- | ионы Ag+ | Выпадение светло-желтого осадка в нейтральной среде: ЗАg+ + РО43- 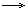 Аg3РО4 Аg3РО4 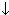
|
| S2- | ионы РЬ2+ | Выпадение черного осадка: Pb2+ + S2- 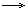 PbS PbS 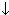
|
| СО32- | ионы Са2+ | Выпадение белого осадка, растворимого в кислотах: Са2+ + СО32- = СаСОз 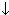
|
| CO2 | известковая вода Са(ОН)2 | Са(ОН)2 + СО2 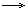 СаСО3 СаСО3 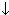 + Н2О,
СаСО3 + СО2 + Н2О + Н2О,
СаСО3 + СО2 + Н2О 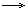 Са(НСО3)2
Выпадение белого осадка и его растворение при пропускании СО2 Са(НСО3)2
Выпадение белого осадка и его растворение при пропускании СО2
|
| SO32- | ионы Н+ | Появление характерного запаха SО2:
2Н+ + SO32- 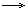 Н2О + SО2 Н2О + SО2
|
| F- | ионы Са2+ | Выпадение белого осадка: Са2+ + 2F- 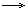 CaF2 CaF2
|
| Cl- | ионы Аg+ | Выпадение белого осадка, не растворимого в HNО3, но растворимого в конц. NH3 • Н2О:
Аg+ +CI- 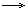 AgCl AgCl 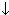 AgCI + 2(NH3• Н2О) AgCI + 2(NH3• Н2О) 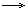 [Ag(NH3)2]+ + CI- +2Н2О [Ag(NH3)2]+ + CI- +2Н2О
|
| Br- | ионы Аg+ | Выпадение светло-желтого осадка, не растворимого в HNО3:
Ag+ + Br- = AgBr 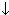 осадок темнеет на свету осадок темнеет на свету
|
| I- | ионы Аg+ | Выпадение желтого осадка, не растворимого в HNO3 и NH3 конц.: Аg+ + I- 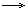 АgI АgI 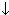 осадок темнеет на свету осадок темнеет на свету
|
| ОН- (щелочная среда) | индикаторы: лакмус фенолфталеин | синее окрашивание малиновое окрашивание |
3) Получение газообразных веществ. Качественные реакции на газообразные вещества (кислород, водород, углекислый газ, аммиак).
| Газ (краткая характеристика) | Получение (уравнения реакций) | Собирание | Распознавание |
| Водород (Н2) – самый легкий, бесцветный, не имеет запаха. | Вытеснением водорода металлами из растворов кислот: Zn + 2HCl = ZnCl2 + H2 ↑. | В перевернутую вверх дном пробирку. | При поднесении к пламени раздается «хлопок» или «лающий» звук. |
| Кислород (О2) без запаха и цвета, тяжелее воздуха, мало растворим в воде. | 1.Разложением перманганата калия: 2KMnO4 = K2MnO4 + MnO2 + О2 2.Разложением пероксида водорода (катализатор MnO2): 2H2O2 = 2Н2О + О2 | 1.Вытеснением воздуха. 2.Вытеснением воды. | Вспыхивание тлеющей лучинки, внесенной в сосуд с кислородом. |
| Углекислый газ – оксид углерода (IV) – СО2. Бесцветный, не имеет запаха, не поддерживает горение, тяжелее воздуха. Растворим в воде. | 1.В промышленности: CaCO3 = СаО + СО2 2.В лаборатории: CaCO3 + 2HCl = CaCl2 + H2O + CO2↑ | Вытеснением воздуха. | 1.Горящая лучина гаснет в сосуде с СО2. 2.По помутнению известковой воды: СО2 + Са(ОН)2 = СаСО3 + Н2О |
| Аммиак (NН3) имеет резкий характерный запах, без цвета, хорошо растворим в воде, легче воздуха. | 1.В промышленности: 3H2 + N2 = 2NH3 2.В лаборатории: NH4Cl + NaOH = NaCl + H2O + NH3↑ | В перевернутую вверх дном пробирку. | 1.По запаху. 2.По изменению цвета влажной лакмусовой бумажки (синеет). 3.По появлению дыма при поднесении стеклянной палочки, смоченной в соляной кислоте. |
А15. Вычисления массовой доли химического элемента в веществе.






