Групповой реактив. Его действие.
Качественные(частные) реакции.
5.Анализ смеси катионов I-II аналитической группы».
ВТОРАЯ АНАЛИТИЧЕСКАЯ ГРУППА КАТИОНОВ
Общая характеристика. Ко второй аналитической группе относятся Ag+, Hg22+, Pb2+. В ходе анализа для отделения этих катионов пользуются групповым реактивом, которым является двунормальный раствор соляной кислоты, который добавляют в избытке. Катионы Ag+, Pb2+, Hg22+ - бесцветные в своих растворах. При действии щелочи на растворы солей серебра и ртути, образуются гидроксиды, которые разлагаются на оксиды и воду. Гидроксид свинца обладает амфотерными свойствами. Все растворимые соли свинца и ртути ядовиты. Соли свинца вызывают хронические отравления ЖКТ, поражения ЦНС: возникают галлюцинации, судороги, атрофия зрительного нерва. Противоядием является яичный белок и аскорбиновая кислота. После работы с катионами второй группы необходимо тщательно мыть руки, соблюдать меры предосторожности.
Применение. Растворы серебра применяют в глазной практике, как вяжущее и прижигающее средство. Применяются коллоидные растворы серебра: колларгол и протаргол, как противовоспалительные и антисептические средства. Соли свинца (ацетат свинца) – вяжущее средство, наружно для примочек, компрессов, при воспалительных заболеваниях кожи и слизистых оболочек. Оксид свинца применяют в виде свинцового пластыря: противовоспалительное, дезинфицирующее средство.
Действие группового реактива (HCl).
1.Ag++Cl--=AgCl↓ (белый творожистый осадок растворим в растворе аммиака, Na2S2O3, (NH4)2CO3)
AgCl+2NH4OH=[Ag(NH3)2]Cl+2H2O (если на полученный комплекс подействовать HNO3, то вновь выпадает творожистый осадок)
[Ag(NH3)2]Cl+2HNO3=AgCl↓+2NH4NO3
AgCl+2Na2S2O3=Na3[Ag(S2O3)2]+NaCl
2.Pb2++2Cl--=PbCl2↓ (белый хлопьевидный осадок, растворим в горячей воде, а при охлаждении выпадают серебристые чешуйки).
 |
3.Hg22++2Cl--=Hg2Cl2 (белый осадок, при действии NH4OH выпадает черный осадок).
Hg2Cl2+2NH4OH=[HgNH2]Cl+2H2O+NH4Cl+Hg↓(черный осадок)
Качественные реакции
| Катион | Реактив | Эффект | Уравнение реакции |
| Ag+ | KI | Желтый творожистый осадок, не растворим в NH4OH, но растворяется в Na2S2O3 | AgNO3+KI=AgI↓+KNO3 Ag++I--=AgI↓ AgI+2Na2S2O3= =Na3[Ag(S2O3)2]+NaI AgI+3Na++2S2O32--= =Na3[Ag(S2O3)2]+I-- |
| Ag+ | K2CrO4 | Кирпично-красный осадок растворим в HNO3, NH4OH, трудно-растворим в уксусной кислоте | 2AgNO3+K2CrO4= =Ag2CrO4↓+2KNO3 2Ag++CrO42--=Ag2CrO4↓ |
| NaOH | Черный осадок растворим в HNO3 при нагревании | 2AgNO3+2NaOH= =Ag2O↓+H2O+2NaNO3 2Ag++2OH--=Ag2O↓+H2O | |
| Na2S2O3 | Белый осадок (растворим в избытке реактива) быстро переходящий в желтый, черный осадок | 2AgNO3+Na2S2O3= =Ag2S2O3↓+2NaNO3 Ag2S2O3=Ag2SO3↓+S↓ Ag2SO3+S+H2O= =Ag2S↓+H2SO4 Ag2S2O3+3Na2S2O3(изб)= =2Na3[Ag(S2O3)2] | |
| Реакция се-ребряного зеркала (реакция среды – слабощело-чная) | AgNO3+2NH4OH= =[Ag(NH3)2]NO3+2H2O 2[Ag(NH3)2]NO3+ +H2CO+H2O=2Ag↓+ +NH3↑+HCOONH4+ +NH4NO3 | ||
| KI (реакция среды – слабокис-лая) | Желтый осадок (+уксусная кислота + вода, нагреть до растворения осадка, при резком охлаждении раствора под струей холодной воды выпадает осадок в виде золотых чешуек) | Pb(NO3)2+2KI= =PbI2↓+2KNO3 Pb2+ +2I--=PbI2↓ | |
| K2CrO4 | Желтый осадок ма-лорастворим в HNO3 и уксусной кислоте, но растворяется в щелочах | Pb(NO3)2+K2CrO4= =PbCrO4↓+2KNO3 Pb2+ +CrO42--=PbCrO4↓ | |
| Pb2+ | H2SO4 | Белый осадок, растворим при нагревании в растворе щелочей | Pb(NO3)2+H2SO4= =PbSO4↓+2HNO3 Pb2+ +SO42--=PbSO4↓ PbSO4+4NaOH= =Na2PbO2+H2SO4+2H2O |
| NaOH | Белый осадок растворим в кислотах и щелочах | Pb(NO3)2+2NaOH= =Pb(OH)2↓+2NaNO3 Pb2+ +2OH--=Pb(OH)2↓ | |
| Na2S | Черный осадок растворим в HNO3 | Pb(CH3COO)2+Na2S= =PbS↓+2CH3COONa Pb2+ +S2--=PbS↓ 3PbS+8HNO3= =3Pb(NO3)2+3S↓+ +2NO↑+4H2O | |
| Hg22+ | Раствор дитизона в хлорофор-ме | Слой хлороформа окрашивается в красный цвет | |
| KI | Грязно-зеленый осадок, растворим в избытке реактива | Hg2Cl2+2KI=Hg2I2↓+2KCl Hg22++2I--=Hg2I2↓ Hg2I2+2KI (изб) =K2[HgI4]+Hg↓ | |
| K2CrO4 | Красно-бурый осадок, растворим в концен-трированной HNO3 и не растворим в щелочах | Hg2Cl2+K2CrO4= =Hg2CrO4↓+2KCl Hg22++CrO42--=Hg2CrO4↓ | |
| Hg22+ | NaOH | Черный осадок | Hg2Cl2+2NaOH= =Hg2O↓+2NaCl+H2O Hg22++2OH--=Hg2O↓+H2O |
| Дифенил-карбазид | Синий осадок или синее окрашивание |
Вопросы для самопроверки
1. Назовите катионы, относящиеся ко второй аналитической группе, групповой реактив. Охарактеризуйте растворимость осадков.
2. Какой цвет имеют осадки, образованные катионами второй группы с K2CrO4? KI? NaOH? Напишите уравнения реакций.
3. В какой цвет окрашивается слой хлороформа, при взаимодействии катионов Ag+ и Pb2+ с раствором дитизона в хлороформе?
4. Какой осадок образуется при взаимодействии Hg22+ и дифенилкарбазида?
Сводная таблица на реакции катионов второй аналитической группы
| Реактив | Ag+ | Pb2+ | Hg22+ |
| Cl-- | AgCl – белый творожистый осадок, раство-римый в растворе аммиака, Na2S2O3, (NH4)2CO3 | PbCl2 – белый хлопьевидный осадок, раст-воримый в горячей воде | Hg2Cl2 – белый осадок, при растворении в растворе аммиака выпадает черный осадок |
| I-- | AgI – желтый творожистый осадок, не раст-ворим в растворе аммиака, растворим в Na2S2O3 | PbI2 –желтый осадок | Hg2I2 - зеленоватый осадок, растворимый в избытке реактива |
| K2CrO4 | Ag2CrO4 –кирпично-красный осадок, растворимый в азотной кислоте, растворе аммиака, трудно растворим в уксусной кислоте | PbCrO4 – желтый осадок, мало растворимый в азотной и уксусной кислотах, рас-творимый в щелочах | Hg2CrO4 – красно-бурый осадок, растворимый в концентрированной азотной кислоте, не растворимый в щелочах |
| NaOH | Ag2O – черный осадок, раство-римый в азотной кислоте при наг-ревании | Pb(OH)2 – белый осадок, раство-римый в кислотах и щелочах | Hg2O – черный осадок, растворимый в азотной кислоте |
| Na2S2O3 | Белый осадок (Ag2S2O3), переходящий в желтый (S), а затем в чер-ный(Ag2S) | ||
| KI | AgI – желтый осадок, не раст-воримый в NH4OH, растворимый в Na2S2O3 | PbI2 – золотисто-желтый осадок, растворимый в избытке KI | Hg2I2 –зеленый осадок, растворим в избытке KI |
| H2SO4 | Ag2SO4 – белый осадок, раство-римый в горячей воде | PbSO4 – белый осадок, растворим в щелочах при нагревании | Hg2SO4 – белый осадок, растворимый в царской водке |
| Na2S | ? см. в литературе | PbS – черный осадок, раст-воримый в азотной кислоте | ? см. в литературе |
| Раствор дитизона в хлороформе | Слой хлороформа окрашивается в желтый цвет | Слой хлороформа окрашивается в красный цвет | |
| Дифенилкарбазид | Синий осадок или синее окрашивание |
Схема анализа смеси катионов первой и второй аналитических групп.
 |
 |
+HCl
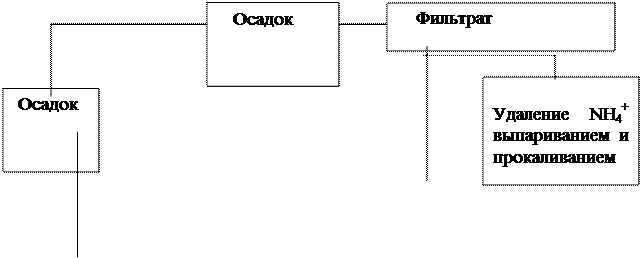

 горячая вода
горячая вода
| |||||||
 | |||||||
|
| ||||||
 |
| |||
 | |||
+NH4OH
| |||||
| |||||
 | |||||
|

+HNO3
|
ВОПРОСЫ ДЛЯ ЗАКРЕПЛЕНИЯ
1) Катионы первой аналитической группы. Свойства катионов. Реактивы. Выполнение качественных реакций. Условие проведения реакций. Растворимость осадков.
2) Анализ смеси катионов.
3) Катионы второй группы. Анализ смеси катионов первой и второй групп.






