ћ≈“ќƒ»„Ќ≤ ¬ ј«≤¬ »
до виконанн€ лабораторноњ та самост≥йноњ роботи з теми
Ђ’≥м≥€ d-елемент≥вї
дл€ студент≥в ≤ курсу
вс≥х спец≥альностей
(денноњ та заочноњ форм навчанн€)

м. ривий –≥г
”кладач≥: канд. х≥м. наук, доц. „асова ≈. ¬.,
канд. б≥ол. наук, доц. ≤вчук ¬. ¬.
¬≥дпов≥дальна за випуск: канд. х≥м. наук, доц. „асова ≈. ¬.
–ецензент: канд. х≥м. наук, доц. ћовчан ¬. ¬.
ћетодичн≥ вказ≥вки до виконанн€ лабораторноњ та самост≥йноњ роботи з теми Ђ’≥м≥€ d-елемент≥вї, м≥ст€ть теоретичну та експериментальну частину, питанн€ дл€ самоконтролю, задач≥ ≥ вправи дл€ самост≥йноњ роботи, список л≥тератури, що рекомендуЇтьс€ дл€ самост≥йного опрацюванн€.
| –озгл€нуто на зас≥данн≥ кафедри х≥м≥њ ѕротокол є_____ в≥д Ђ___ї_________2014 р. | —хвалено на вчен≥й рад≥ факультету рудоп≥дготовки та обробки метал≥в ѕротокол є_____ в≥д Ђ___ї_________2014 р. |
“≈ќ–≈“»„Ќј „ј—“»Ќј
«агальна характеристика d-елемент≥в
d-≈лементами пер≥одичноњ системи ƒ. ≤. ћенделЇЇва називають елементи, в атомах €ких валентними електронами Ї електрони зовн≥шнього ns- та передостаннього (n-1) d-п≥др≥вн€. ¬они складають ≤ ¬ Ц VII B групи. d-≈лементи називають також перех≥дними, оск≥льки вони розташован≥ в пер≥одичн≥й систем≥ у великих пер≥одах м≥ж s- та p-елементами.
Ќа ф≥зичн≥ та х≥м≥чн≥ властивост≥ d-елемент≥в суттЇво впливають особливост≥ њх електронноњ будови. « одного боку, (n-1) d-п≥др≥вень в м≥ру заповненн€ електронами спри€Ї екрануванню зовн≥шн≥х ns-електрон≥в, що мусить послабити њх зв'€зок з €дром, з ≥ншого Ц зростанн€ к≥лькост≥ електрон≥в на передостанньому р≥вн≥ приводить до зменшенн€ атомних рад≥ус≥в. ÷е €вище, €ке маЇ назву d-стисканн€, переважаЇ, тому, хоча d-елементи ≥ мають метал≥чн≥ властивост≥, вони менш виражен≥, н≥ж у s- та p-метал≥в.
«верху вниз у групах спостер≥гають зростанн€ атомних рад≥ус≥в при переход≥ в≥д 3d- до 4d-елемент≥в ≥ зменшенн€ в≥д 4d- до 5d-елемент≥в. «меншенн€ атомних рад≥ус≥в 5d-елемент≥в обумовлено лантаноњдним стисканн€м ≥ приводить до зб≥льшенн€ енерг≥њ ≥он≥зац≥њ Au та Hg у пор≥вн€нн≥ з Ag та Cd ≥ в≥дпов≥дно до зменшенн€ њх метал≥чних властивостей.
«агальна характеристика елемент≥в VIII ¬ групи
VIII ¬ група пер≥одичноњ системи Ї особливою. Ќа в≥дм≥ну в≥д ≥нших груп вона м≥стить по три елементи у кожному пер≥од≥. ÷е метали, €к≥, по-перше, не мають типових аналог≥в, а, по-друге, не утворюють сполук, ступ≥нь окисненн€ в €ких в≥дпов≥дав би повному числу валентних електрон≥в, а саме Ц восьми.
ƒо складу VIII ¬ групи вход€ть девТ€ть d-елемент≥в, що обТЇднуютьс€ у тр≥аду (родину) ‘еруму Fe, Co, Ni та платинов≥ метали, €к≥ м≥ст€ть вс≥ ≥нш≥ елементи групи.
Ќайб≥льше значенн€ мають метали родини зал≥за. «овн≥шн≥ електрони њх ≥зольованих атом≥в мають однакову будову 4s2. ѕри зб≥льшенн≥ зар€ду €дра атома у цих елемент≥в добудовуЇтьс€ 3d-п≥др≥вень, ступ≥нь заповненн€ €кого майже не впливаЇ на розм≥ри атом≥в та ≥он≥в.
|
|
|
‘≥зичн≥ властивост≥ простих речовин
” компактному кристал≥чному стан≥ зал≥зо, кобальт ≥ н≥кель Ц це ср≥бл€сто-б≥л≥ метали, ст≥йк≥ на пов≥тр≥ внасл≥док утворенн€ захисноњ оксидноњ пл≥вки. ” др≥бнодисперсному стан≥ ц≥ метали п≥рофорн≥ Ц самозаймаютьс€ на пов≥тр≥.
ћетали родини зал≥за схож≥ за властивост€ми. ¬с≥ ц≥ метали мають велику м≥цн≥сть, пластичн≥сть, ковк≥сть. ¬с≥ три метали Ц феромагнетики, вони прит€гуютьс€ магн≥том.
Ќа механ≥чн≥ та ф≥зико-х≥м≥чн≥ властивост≥ Fe, Co ≥ Ni значний вплив мають дом≥шки ≥нших елемент≥в. “ому при розгл€д≥ њх х≥м≥чних властивостей мають на уваз≥ властивост≥ чистих метал≥в.
’≥м≥чн≥ властивост≥ метал≥в родини ‘еруму
јтом Fe Ц валентн≥ електрони Е3d64s2, ступен≥ окисненн€ +2, +3 (+6 Ц р≥дко). јтом Co Ц валентн≥ електрони Е3d74s2, ступен≥ окисненн€ +2, +3 (+4 Ц р≥дко). јтом Ni Ц валентн≥ електрони Е3d84s2, найб≥льш характерна ступ≥нь окисненн€ +2 (+3 Ц нест≥йка).
ат≥они Fe2+ та Fe3+ Ц активн≥ комплексоутворювач≥ з координац≥йним числом 6. ¬ €кост≥ л≥ганд≥в можуть бути: орган≥чн≥ сполуки (б≥лки), CN-, NH3, CO.
ат≥они Co2+, Co3+, Ni2+ теж можуть бути комплексоутворювачами. оординац≥йне число 6. ѕричому б≥льш ст≥йк≥ комплексн≥ сполуки кобальту (≤≤≤). Ћ≥гандами част≥ше можуть бути: H2O, NH3, CN-, NO2-, CO.
ѕ≥д час нагр≥ванн€ метали родини ‘еруму здатн≥ безпосередньо сполучатис€ з с≥ркою, галогенами, киснем, фосфором. —ухий хлор ≥з зал≥зом не взаЇмод≥Ї, тому його збер≥гають у стальних балонах. «а на€вност≥ вологи метали родини ‘еруму енерг≥йно взаЇмод≥ють з хлором:
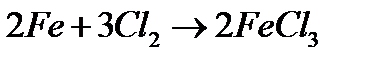

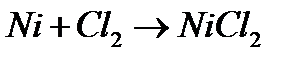
« с≥ркою зал≥зо, кобальт ≥ н≥кель утворюють сульф≥ди MeS, що мають чорне забарвленн€.
” водному середовищ≥ метали родини ‘еруму майже не кородують. Ќайст≥йк≥ший проти короз≥њ Ц н≥кель. —т≥йк≥сть зал≥за проти короз≥њ залежить в≥д ступен€ його чистоти. «ал≥зо з високим ступенем чистоти не п≥ддаЇтьс€ короз≥њ. “ехн≥чне зал≥зо у вологому пов≥тр≥ легко окиснюЇтьс€ ≥ вкриваЇтьс€ ≥ржею.
” електрох≥м≥чному р€д≥ напруг зал≥зо, кобальт та н≥кель розташован≥ л≥воруч в≥д водню (м≥ж Zn та Sn), тобто це метали середньоњ х≥м≥чноњ активност≥.
¬они легко взаЇмод≥ють з розчинами кислот, в €ких г≥дроген виступаЇ окисником, з вид≥ленн€м водню:

онцентрован≥ H2SO4 та HNO3 пасивують поверхню метал≥в, що даЇ змогу збер≥гати ≥ перевозити ц≥ кислоти у зал≥зн≥й тар≥.
ѕри нагр≥ванн≥ у концентрован≥й сульфатн≥й кислот≥, зал≥зо розчин€Їтьс€ ≥ утворюЇ сполуки з≥ ступенем окисненн€ +3:

–озведена та пом≥рно концентрована н≥тратна кислота розчин€Ї зал≥зо:

онцентрована HNO3 пасивуЇ зал≥зо.
«ал≥зо, кобальт ≥ особливо н≥кель належать до небагатьох метал≥в, ст≥йких до розчин≥в ≥ розплав≥в луг≥в.
„ист≥ метали в компактному стан≥ при к≥мнатн≥й температур≥ ст≥йк≥ по в≥дношенню до води, але у вологому пов≥тр≥ в нейтральному середовищ≥ в≥дбуваютьс€ реакц≥њ:


¬насл≥док короз≥њ щор≥чно втрачаЇтьс€ до 20 % отриманого зал≥за.
—полуки феруму (≤≤)
Ќайб≥льш важливими сполуками феруму (≤≤) Ї його сол≥.
—ол≥ феруму (≤≤) одержують д≥Їю на метал розчинами кислот, в €ких водень виступаЇ в рол≥ окисника або розбавлених розчин≥в кислот, в €ких окисником виступаЇ неметал у вищому ступен≥ окисненн€. ѕри випарюванн≥ з водних розчин≥в зазвичай утворюЇтьс€ кристалог≥драти зеленого кольору, наприклад: FeSO4Ј7H2O, Fe(ClO4)2Ј6H2O, Fe(NO3)2Ј6H2O, (NH4)2Fe(SO4)2Ј6H2O (с≥ль ћора). —≥ль ћора найст≥йк≥ша на пов≥тр≥.
|
|
|
ќксид феруму (≤≤) FeO Ц кристал≥чна сполука чорного кольору, нерозчинна у вод≥. ќксид Fe (II) одержують в≥дновленн€м оксиду (≤≤, ≤≤≤) оксидом карбону (≤≤):
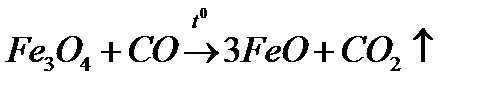
ќксид зал≥за (≤≤) Ц основний оксид, €кий легко реагуЇ з кислотами, при цьому утворюютьс€ сол≥ феруму (≤≤):

√≥дроксид феруму (≤≤) Fe(OH)2 Ц порошок б≥лого кольору з зеленуватим в≥дт≥нком, нерозчинний у вод≥. ÷е основа середньоњ сили, €ка маЇ ознаки амфотерност≥. —полуки Fe (II) ЦЇ сильними в≥дновниками. “ак, наприклад Fe(ќЌ)2 на пов≥тр≥ швидко зм≥нюЇ кол≥р Ц бур≥Ї. «м≥на кольору обумовлена окисненн€м Fe(OH)2 у Fe(OH)3 киснем пов≥тр€:

—полуки феруму (≤≤≤)
—полуки феруму (≤≤≤) одержують д≥Їю окисник≥в на метал≥чне зал≥зо або окисненн€м сполук феруму (≤≤).
Ќайб≥льш поширеними сполуками феруму (≤≤≤) Ї: Fe2O3, г≥драт оксиду Fe2O3ЈхЈЌ2ќ; сол≥ FeCl3Ј6H2O, Fe2(SO4)3Ј10H2O, Fe(NO3)3Ј9H2O, NH4Fe(SO4)2Ј12H2O Ц ферум-амон≥йн≥ галуни.
—полуки Fe (≤≤≤) мають окисн≥ властивост≥:  .
.
ќксид Fe (≤≤≤) Ц червоно-коричневого кольору.
√≥дроксид Fe (III) одержують д≥Їю лугу на розчини солей феруму (≤≤≤):

√≥дроксид феруму (≤≤≤) Ц слабка основа. јле в звТ€зку з тим, що ан≥онн≥ комплекси Fe(III) ст≥йк≥ш≥ ≥ легше утворюютьс€, н≥ж аналог≥чн≥ комплекси Fe(II), св≥жоприготований Fe(OH)3 розчин€Їтьс€ у концентрованих лугах, ви€вл€ючи тим самим амфотерн≥ властивост≥:
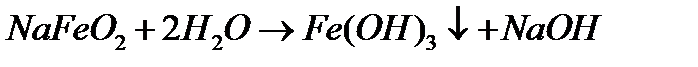
ѕри сплавленн≥ Fe2O3 або Fe(OH)3 з лугами чи карбонатами лужних метал≥в утворюютьс€ ферити:


ƒ≥Їю води ферити повн≥стю г≥дрол≥зуютьс€:

—ол≥ феруму (≤≤≤). ” водному розчин≥ сол≥ феруму (≤≤≤) утворюють гексааквакомплекс  червоно-бурого кольору. ≤нтенсивн≥сть забарвленн€ зм≥нюЇтьс€ в залежност≥ в≥д ступен€ г≥дрол≥зу.
червоно-бурого кольору. ≤нтенсивн≥сть забарвленн€ зм≥нюЇтьс€ в залежност≥ в≥д ступен€ г≥дрол≥зу.
—ол≥ феруму (≤≤≤) г≥дрол≥зован≥ сильн≥ше, н≥ж сол≥ феруму (≤≤). ѕо-перше, це повТ€зано з тим, що г≥дроксид феруму (≤≤≤), €кому в≥дпов≥даЇ с≥ль, Ї б≥льш слабкою основою, н≥ж Fe(OH)2, а значить його с≥ль сильн≥ше г≥дрол≥зуЇтьс€, по-друге, кат≥он Fe3+ сильн≥ше пол€ризуЇ молекули води, що його оточують, н≥ж кат≥он Fe2+.
¬насл≥док г≥дрол≥зу водн≥ розчини солей Fe(III) мають сильно кислу реакц≥ю. ћехан≥зм г≥дрол≥зу солей феруму (≤≤≤) Ц дуже складний. “≥льки у сильно кислих розчинах (pH < 1) г≥дрол≥з солей феруму (≤≤≤) пригн≥чуЇтьс€. ƒодаванн€м лугу чи тривалим кипТ€т≥нн€м водних розчин≥в г≥дрол≥з можна довести до к≥нц€. ¬насл≥док пол≥меризац≥њ продукт≥в г≥дрол≥зу утворюютьс€ багато€дерн≥ комплекси, €к≥ вид≥л€ютьс€ з розчин≥в у вигл€д≥ червоно-коричневоњ колоњдноњ маси, €к≥й в≥дпов≥даЇ формула Fe2O3Јх Ќ2ќ.
ат≥они Fe2+ та Fe3+ це активн≥ комплексоутворювач≥. оординац≥йн≥ числа Fe (≤≤) та Fe (≤≤≤) дор≥внюють 6, р≥дше Ц 4. ” €кост≥ л≥ганд≥в виступають: орган≥чн≥ сполуки (наприклад б≥лки), CN-, SCN-, NH3, H2O, CO.
’≥м≥чн≥ властивост≥ сполук феруму (VI). Ќа в≥дм≥ну в≥д кобальту та н≥келю, дл€ феруму в≥дом≥ сполуки з≥ ступенем окисненн€ +6. ÷е головним чином сол≥ г≥потетичноњ зал≥зноњ кислоти H2FeO4 Ц ферати складу  . ≤снуЇ дек≥лька способ≥в њх одержанн€. ќск≥льки ≥он
. ≤снуЇ дек≥лька способ≥в њх одержанн€. ќск≥льки ≥он  досить ст≥йкий т≥льки у лужних розчинах, а в нейтральному чи кислому середовищ≥ розкладаЇтьс€, одержанн€ ферату натр≥ю або кал≥ю в≥дбуваЇтьс€ у лужному середовищ≥ окисненн€м сполук феруму (≤≤≤) хлором чи бромом:
досить ст≥йкий т≥льки у лужних розчинах, а в нейтральному чи кислому середовищ≥ розкладаЇтьс€, одержанн€ ферату натр≥ю або кал≥ю в≥дбуваЇтьс€ у лужному середовищ≥ окисненн€м сполук феруму (≤≤≤) хлором чи бромом:
 ,
,
або внасл≥док сплавленн€ твердих реагент≥в:
 .
.
‘ерати Ц це червоно-ф≥олетов≥ кристал≥чн≥ речовини. ¬они мають сильн≥ окиснювальн≥ властивост≥, €к≥ перевершують такий сильний окисник, €к перманганат кал≥ю:
 .
.
¬ажлив≥ сполуки кобальту та н≥келю. ƒл€ кобальту та н≥келю найб≥льш характерний ступ≥нь окисненн€ +2. √оловними представниками цього р€ду сполук Ї: оксиди CoO ≥ NiO, в≥дпов≥дн≥ њм г≥дроксиди Co(OH)2 ≥ Ni(OH)2 та сол≥ типу CoCl2, Co(NO3)2, CoSO4, NiCl2, NiSO4.
ќксиди кобальту (≤≤) CoO (с≥ро-зелен≥ кристали) та н≥келю (≤≤) NiO (зелен≥ кристали) одержують взаЇмод≥Їю простих речовин або терм≥чним розкладом г≥дроксид≥в Co(OH)2 ≥ Ni(OH)2, наприклад:

” звТ€зку з тим, що оксиди кобальту (≤≤) ≥ н≥келю (≤≤) малорозчинн≥ у вод≥, в≥дпов≥дн≥ њм г≥дроксиди утворюютьс€ д≥Їю луг≥в на розчини њх солей:
|
|
|


ѕох≥дн≥ кобальту (≤≤≤) та н≥келю (≤≤≤) одержують ≥з сполук Co (≤≤) ≥ Ni (≤≤). “ак, г≥дроксид кобальту (≤≤≤) утворюЇтьс€ при окисненн≥ Co(OH)2 пероксидом г≥дрогену:

√≥дроксид н≥келю (≤≤) можна окиснити лише такими сильними окисниками, €к Br2 чи KBrO:

√≥дроксиди Co(OH)3 та Ni(OH)3 мають сильн≥ окиснювальн≥ властивост≥.






