Цель работы: изучить зависимость броуновского движения от размера частиц и температуры жидкости.
Оборудование: микроскоп, бюретка, сосуды с горячей и холодной водой, мелкодисперсная и крупнодисперсная краска; либо средства ИКТ: ноутбук, проектор, https://www.youtube.com/watch?v=OCcvDbPMNF8, https://www.youtube.com/watch?v=7wi51mQ7XUU, https://www.youtube.com/watch?v=CfcYqFnlolo – ссылки для наблюдения броуновского движения.
Теория:
Броуновским движением называют беспорядочное движение малых частиц, взвешенных в жидкости или газе, происходящее под действием ударов молекул окружающей среды. Это явление было открыто в 1827 г. английским ботаником Р. Броуном, который с помощью ахроматического объектива наблюдал движение цветочной пыльцы, взвешенной в воде. Броун обнаружил, что взвешенные в жидкости частицы находятся в непрерывном беспорядочном движении. Поскольку первые наблюдения проводились на объектах органического происхождения (спорах растений), то исследователи сначала предположили, что частицы движутся за счет собственной "жизненной силы". Однако повторение опытов Броуна на неорганических частицах показало, что и в этом случае наблюдается хаотическое движение, что позволило сделать вывод об универсальности данного явления.
Сразу после своего открытия, броуновское движение не получило удовлетворительного объяснения. Лишь во второй половине 19 века его стали связывать с ударами молекул жидкости о поверхность взвешенных в жидкости малых частиц. Первая теория броуновского движения появилась в начале 20 века. Ее автором был Альберт Эйнштейн, который в мае 1905 г. в немецком журнале Annalen der Physik опубликовал статью «О движении взвешенных в покоящейся жидкости частиц, требуемом молекулярно-кинетической теорией теплоты». В своей работе Эйнштейн показал, что броуновские частицы участвуют в тепловом движении вместе с молекулами жидкости, но с гораздо меньшей скоростью из-за своей сравнительно большой массы. Эйнштейн не знал о броуновском движении и его открытие было чисто теоретическим: "не зная, что наблюдения над "броуновским движением" давно известны, я открыл, что атомистическая теория приводит к существованию доступного наблюдению движения микроскопических взвешенных частиц". Независимо от Эйнштейна, в 1905–1906 гг. количественная теория броуновского движения была также разработана польском физиком М. Смолуховским.

Ход работы:
1. Наблюдать броуновское движение мелкодисперсной краски сначала в горячей, потом в холодной воде. Сделать вывод о зависимости интенсивности броуновского движения от температуры жидкости.
2. Повторить с крупнодисперсной краской. Сделать вывод о зависимости интенсивности броуновского движения от размера броуновской частицы.
Контрольные вопросы:
1. Каковы основные постулаты молекулярно-кинетической теории?
2. Дайте определение броуновского движения. Объясните, почему оно наблюдается только в случае малых частиц.
3. Можно ли остановить броуновское движение частиц?
4. Существуют ли другие виды броуновского движения, помимо поступательного?
5. Как броуновское движение зависит от массы частицы? от температуры?
6. Чему равна средняя кинетическая энергия движения броуновской частицы? Сравните это выражение со средней кинетическая энергией молекулы.
7. Приведите выражение для средней кинетической энергии идеального одноатомного, двухатомного и многоатомного газа.
8. Опишите опыты Ж. Перрена. Какую роль они сыграли для обоснования молекулярно-кинетической теории?
9. Как зависит концентрация броуновских частиц от высоты?
Лабораторная работа №6.
ИЗУЧЕНИЕ ИЗОБАРНОГО ПРОЦЕССА
Цель работы: проверка соотношения между изменением объема и температуры определенного количества газа при его изобарном охлаждении.
Оборудование: прозрачная трубка с двумя кранами на концах, лабораторный термометр, линейка, внешний стакан калориметра, сосуд с теплой водой, сосуд с холодной водой.
Теория: Давление (p), объем (V) и температура (T) являются основными параметрами состояния газа. Всякое изменение состояния газа называется термодинамическим процессом. Термодинамические процессы, протекающие в газе постоянной массы при неизменном значении одного из параметров состояния газа, называются изопроцессами.Изопроцессы являются идеализированной моделью реального процесса в газе. Изопроцессы подчиняются газовым законам. Газовые законы определяют количественные зависимости между двумя параметрами газа при неизменном значении третьего. Газовые законы справедливы для любых газов и газовых смесей.
Изобарным процессом называются изменения состояния газа, протекающие при постоянном давлении (p = const).
Данный процесс в идеальном газе подчиняется закону Гей-Люсака:

Для газа данной массы отношение объема газа к его температуре постоянно, если давление газа не меняется.
Формулу закона можно записать иначе

где V1,V2,T1,T2– параметры газа в разные моменты времени.
Графическое представление изобарного процесса:
V=f(T) - график, отражающий изобарный процесс, называется изобарой.
(математически – это линейная зависимость)

На графиках представлены изобары для разных давлений газа.
Ход работы:
1. Трубку плотно, виток к витку, уложить внутрь стакана калориметра. Кран, который расположится при этом вблизи дна, предварительно закрыть. Верхний кран оставить открытым.
2. Налить в калориметр нагретую до 55 – 60°С воду так, чтобы открытый кран оказался погруженным в нее не более чем на 5-10 мм.
3. Когда температура воздуха сравняется с температурой теплой воды, выделение пузырьков прекратится. Это состояние воздуха в трубке принимают за исходное. Температуру воздуха в исходном состоянии T1 можно определить, если измерить температуру воды в стакане.
4. Затем открытый конец трубки закрыть и перенести трубку в холодную воду. Газ охлаждается и сжимается, и под действием атмосферного давления вода поступает в трубку. Таким образом, условия изобарного процесса выполнены: m=const и p=const. Определить T2 в холодной воде.
5. Поскольку V=S∙l, S-сечение трубки, l-высота столба воздуха в ней, то  , где l1-начальная высота столба воздуха(равная длине трубки); l2- конечная (меньше длины трубки на длину столба залившейся воды).
, где l1-начальная высота столба воздуха(равная длине трубки); l2- конечная (меньше длины трубки на длину столба залившейся воды).
6. Измерить линейкой длину столба воздуха l1 и l2.
7. Рассчитать соотношения:

2. Полученные результаты занести в таблицу:
| Номер опыта | t1, ºC | t2, ºC | l1, м | l2, м | T1, K | T2, K | Cl | CT | ε,% |
3. Вычислить относительную погрешность по формуле:

Контрольные вопросы:
1. Что называют идеальным газом?
2. Каков простейший механический аналог модели «идеальный газ»?
3. Что характеризуют микропараметры и макропараметры идеального газа? Приведите примеры параметров.
4. Какие процессы называют изопроцессами?
5. Охарактеризуйте изопроцессы по плану: а) какой параметр процесса постоянен; б) формула (закон) процесса; в) формулировка закона; г)график процесса д) как на опыте осуществить процесс?
Лабораторная работа №7
ОПРЕДЕЛЕНИЕ ОТНОСИТЕЛЬНОЙ И АБСОЛЮТНОЙ ВЛАЖНОСТИ ВОЗДУХА
Цель работы: определить абсолютную и относительную влажность воздуха.
Оборудование: два термометра на подставке и (или) психрометр, дистиллированная вода, психрометрическая таблица.
Теория:
Плотность водяного пара  , находящегося в воздухе, или давление пара
, находящегося в воздухе, или давление пара  - называют абсолютной влажностью воздуха.
- называют абсолютной влажностью воздуха.
Но степень влажности чаще оценивается относительной влажностью  . Относительную влажность измеряют числом, показывающим, сколько процентов составляет абсолютная влажность
. Относительную влажность измеряют числом, показывающим, сколько процентов составляет абсолютная влажность  от плотности водяного пара
от плотности водяного пара  , нужной для насыщения воздуха при имеющейся у него температуры:
, нужной для насыщения воздуха при имеющейся у него температуры:
 (1), или
(1), или  (2)
(2)
Или, относительная влажность измеряется числом, показывающим, сколько процентов составляет абсолютная влажность  от давления водяного пара
от давления водяного пара  насыщающего воздух при имеющейся у него температуре:
насыщающего воздух при имеющейся у него температуре:

Санитарные требования температуры и влажности:
в классе - 18-20оС, 40-60%; в жилой комнате - зимой 20-22оС (оптимальная), 45-30%, (допустимая 60%); летом – температура 22-25оС и допустимая влажность 65%.
Ход работы
1. Конец термометра 2 обернуть марлей, смоченной в дистиллированной воде.
2. Когда температура смоченного термометра перестанет изменяться, запишите показания обоих термометров в таблицу.
3. Пользуясь психрометрической таблицей определить относительную влажность воздуха.
4. Выразить из формулы (1) и (2) абсолютные влажности  и
и  .
.
5. Пользуясь таблицей, определить давление и плотность насыщенного водяного пара при температуре сухого термометра 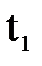 .
.
6. Определить относительную погрешность измерения  .
.
7. Определить абсолютную погрешность  ,
,  .
.
8. Записать окончательный результат. Сделать вывод.
Показания сухого термометра

| Показания влажного термометра

| Разность показаний

| Относительная
влажность
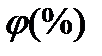
| Абсолютная влажность ρа (кг/м3) |
Контрольные вопросы:
1. Что называют относительной и абсолютной влажностью воздуха?
2. Какие приборы используются для определения влажности?
3. Температура смоченного термометра понижается. Находится ли степень понижения в зависимости от влажности воздуха?
4. В каком случае разность показаний сухого и смоченного термометров больше: когда воздух суше или когда он более влажен?
5. Что называется точкой росы?
6. Почему абсолютную влажность можно измерять двумя величинами?
7. Сравните полученные результаты с санитарными требованиями температуры и влажности.
Лабораторная работа №8.






