

Поиск: Рекомендуем:  Почему я выбрал профессую экономиста
Почему я выбрал профессую экономиста
 Почему одни успешнее, чем другие
Почему одни успешнее, чем другие
 Периферийные устройства ЭВМ Периферийные устройства ЭВМ
 Нейроглия (или проще глия, глиальные клетки) Нейроглия (или проще глия, глиальные клетки)
Категории:
|
Окислительное дезаминирование
| Источники и пути использования аминокислот
 Количество белка в некоторых пищевых продуктах
Количество белка в некоторых пищевых продуктах
 Компоненты желудочного сока в норме и при патологических состояниях
Компоненты желудочного сока в норме и при патологических состояниях
 Протеасо́ма (от англ. protease – протеиназа и лат. soma – тело) – очень крупная мультисубъединичная протеаза, присутствующая в клетках эукариот, архей и некоторых бактерий. В эукариотических клетках протеасомы содержатся и в ядре, и в цитоплазме. Основная функция протеасомы – протеолитическая деградация ненужных и повреждённых белков до коротких пептидов (4-25 аминокислотных остатков), которые затем могут быть расщеплены до отдельных аминокислот. Деградация 80-90 % внутриклеточных белков происходит при участии протеасомы. Для того чтобы белок-мишень расщепился протеасомой, он должен быть помечен путём присоединения к нему маленького белка убиквитина. Реакция присоединения убиквитина катализируется ферментами убиквитин-лигазами. Присоединение первой молекулы убиквитина к белку служит для лигаз сигналом для дальнейшего присоединения молекул убиквитина. В результате к белку оказывается присоединена полиубиквитиновая цепь, которая связывается с протеасомой и обеспечивает расщепление белка-мишени. В целом вся эта система получила название убиквитин-зависимой деградации белка.
Катепсины (от греч. kathepso-перевариваю), ферменты класса гидролаз, катализирующие гидролиз пептидной связи. Содержатся в тканях животных и человека (главным образом в печени, почках и селезенке). По строению активного центра различают три основных группы катепсинов. В группу катепсинов, содержащих в активном центре остаток серина (т.н. сериновые амидгидролазы), входят катепсин А (сериновая карбоксипептидаза A1; для фермента из лизосомы печени крысы молекулярной массой 100 тыс.) и катепсин G (для ферментов из гранулоцитов человека молекулярной массой 22,3 тыс.). Эти ферменты катализируют также гидролиз эфиров и амидов N-ациламинокислот. Оптимальная каталитическая активность катепсина А при рН 5,0-6,0, катепсина G – при рН 7,5. Ингибируются диизо-пропилфторфосфатом и алкилбромметилкетонами. К катепсинам, содержащим в активном центре остаток аспарагиновой кислоты (т.н. карбоксильные амидгидролазы), относятся катепсин D (для фермента из селезенки лошади молекулярной массой 42,5 тыс.) и катепсин Е (для фермента из костного мозга кролика молекулярной массой 100 тыс.). Оптимальная каталитическая активность обоих ферментов находится в интервале рН 2,5-5,0. Ингибируются в присутствии Сu2+ диазосоединениями типа CH3C(O)NHCHRC(O)CHN2. Наиболее обширную группу составляют катепсины, содержащие в активном центре цистеин (тиоловые амидгидролазы). В эту группу входят катепсины В и С (дипептидилпептидаза), Н, L, N и S. Они имеют молекулярную массу от 25 тыс. до 35 тыс.; некоторые из них гликопротеины. Оптимальная каталитическая активность катепсинов В, С, Н и L при рН 4,0-6,0, катепсинов N и S при рН 3,5. Катепсины этой группы катализируют наряду с гидролизом пептидов гидролиз амидов аминокислот. Катепсин С обладает также сильно выраженной транспептидазной активностью – катализирует перенос олигопептидов на пептиды или аминокислоты. Известен также катепсин F (фермент из ушного хряща кролика имеет молекулярную массу 50-70 тыс.), который катализирует расщепление протеогликанов хрящей. Он ингибируется некоторыми иммуноглобулинами, не чувствителен к действию диизопропилфторфосфата, пепстатина и реагентов, взаимодействующих с группой SH.
Аминотрансферазы (трансаминазы) сыворотки
Норма (варьирует в зависимости от метода): аспартатная трансаминаза (AсАT) – 6-25 МЕ/л при 30°С; аланиновая трансаминаза (АлАТ) – 3-26 МЕ/л при 30°С.
A. Предосторожности.Избегать гемолиза, быстро отделять сыворотку от сгустка.
Б. Физиологическая основа. Аспартатная аминотрансфераза (AсАT), аланиновая трансаминаза (АлАТ) и лактатдегидрогеназа – это внутриклеточные ферменты, участвующие в обмене аминокислот и углеводов. В высокой концентрации содержатся в мышцах, печени, мозге. Повышение концентрации этих ферментов в крови свидетельствует о некрозе или поражении прежде всего этих тканей.
B. Интерпретация. 1. Повышение показателяимеет место при инфаркте миокарда (особенно AсАT); при остром инфекционном гепатите (АлАТ обычно повышена больше, чем AсАT); циррозе печени (AсАT повышена больше, чем АлАТ); при метастазах в печень или первичной опухоли печени. При поражении опухолевым процессом серозных полостей уровень ферментов повышается в транссудатах. AсАT повышается при мышечной дистрофии, дерматомиозите и пароксизмальной миоглобинурии.
2. Снижение показателя имеет место при недостаточности пиридоксина (витамина В6), часто в результате повторных процедур гемодиализа; при почечной недостаточности, при беременности.
Непрямое дезаминирование (трансдезаминирование) – основной способ дезаминирования большинства аминокислот
Протеасо́ма (от англ. protease – протеиназа и лат. soma – тело) – очень крупная мультисубъединичная протеаза, присутствующая в клетках эукариот, архей и некоторых бактерий. В эукариотических клетках протеасомы содержатся и в ядре, и в цитоплазме. Основная функция протеасомы – протеолитическая деградация ненужных и повреждённых белков до коротких пептидов (4-25 аминокислотных остатков), которые затем могут быть расщеплены до отдельных аминокислот. Деградация 80-90 % внутриклеточных белков происходит при участии протеасомы. Для того чтобы белок-мишень расщепился протеасомой, он должен быть помечен путём присоединения к нему маленького белка убиквитина. Реакция присоединения убиквитина катализируется ферментами убиквитин-лигазами. Присоединение первой молекулы убиквитина к белку служит для лигаз сигналом для дальнейшего присоединения молекул убиквитина. В результате к белку оказывается присоединена полиубиквитиновая цепь, которая связывается с протеасомой и обеспечивает расщепление белка-мишени. В целом вся эта система получила название убиквитин-зависимой деградации белка.
Катепсины (от греч. kathepso-перевариваю), ферменты класса гидролаз, катализирующие гидролиз пептидной связи. Содержатся в тканях животных и человека (главным образом в печени, почках и селезенке). По строению активного центра различают три основных группы катепсинов. В группу катепсинов, содержащих в активном центре остаток серина (т.н. сериновые амидгидролазы), входят катепсин А (сериновая карбоксипептидаза A1; для фермента из лизосомы печени крысы молекулярной массой 100 тыс.) и катепсин G (для ферментов из гранулоцитов человека молекулярной массой 22,3 тыс.). Эти ферменты катализируют также гидролиз эфиров и амидов N-ациламинокислот. Оптимальная каталитическая активность катепсина А при рН 5,0-6,0, катепсина G – при рН 7,5. Ингибируются диизо-пропилфторфосфатом и алкилбромметилкетонами. К катепсинам, содержащим в активном центре остаток аспарагиновой кислоты (т.н. карбоксильные амидгидролазы), относятся катепсин D (для фермента из селезенки лошади молекулярной массой 42,5 тыс.) и катепсин Е (для фермента из костного мозга кролика молекулярной массой 100 тыс.). Оптимальная каталитическая активность обоих ферментов находится в интервале рН 2,5-5,0. Ингибируются в присутствии Сu2+ диазосоединениями типа CH3C(O)NHCHRC(O)CHN2. Наиболее обширную группу составляют катепсины, содержащие в активном центре цистеин (тиоловые амидгидролазы). В эту группу входят катепсины В и С (дипептидилпептидаза), Н, L, N и S. Они имеют молекулярную массу от 25 тыс. до 35 тыс.; некоторые из них гликопротеины. Оптимальная каталитическая активность катепсинов В, С, Н и L при рН 4,0-6,0, катепсинов N и S при рН 3,5. Катепсины этой группы катализируют наряду с гидролизом пептидов гидролиз амидов аминокислот. Катепсин С обладает также сильно выраженной транспептидазной активностью – катализирует перенос олигопептидов на пептиды или аминокислоты. Известен также катепсин F (фермент из ушного хряща кролика имеет молекулярную массу 50-70 тыс.), который катализирует расщепление протеогликанов хрящей. Он ингибируется некоторыми иммуноглобулинами, не чувствителен к действию диизопропилфторфосфата, пепстатина и реагентов, взаимодействующих с группой SH.
Аминотрансферазы (трансаминазы) сыворотки
Норма (варьирует в зависимости от метода): аспартатная трансаминаза (AсАT) – 6-25 МЕ/л при 30°С; аланиновая трансаминаза (АлАТ) – 3-26 МЕ/л при 30°С.
A. Предосторожности.Избегать гемолиза, быстро отделять сыворотку от сгустка.
Б. Физиологическая основа. Аспартатная аминотрансфераза (AсАT), аланиновая трансаминаза (АлАТ) и лактатдегидрогеназа – это внутриклеточные ферменты, участвующие в обмене аминокислот и углеводов. В высокой концентрации содержатся в мышцах, печени, мозге. Повышение концентрации этих ферментов в крови свидетельствует о некрозе или поражении прежде всего этих тканей.
B. Интерпретация. 1. Повышение показателяимеет место при инфаркте миокарда (особенно AсАT); при остром инфекционном гепатите (АлАТ обычно повышена больше, чем AсАT); циррозе печени (AсАT повышена больше, чем АлАТ); при метастазах в печень или первичной опухоли печени. При поражении опухолевым процессом серозных полостей уровень ферментов повышается в транссудатах. AсАT повышается при мышечной дистрофии, дерматомиозите и пароксизмальной миоглобинурии.
2. Снижение показателя имеет место при недостаточности пиридоксина (витамина В6), часто в результате повторных процедур гемодиализа; при почечной недостаточности, при беременности.
Непрямое дезаминирование (трансдезаминирование) – основной способ дезаминирования большинства аминокислот

| ||
| 2. Обезвреживание аммиака: восстановительное аминирование 2-оксоглутарата и синтез глутамина. Орнитиновый цикл синтеза мочевины. Транспорт аммиака. Глюкозо-аланиновый цикл и транспорт глутамина. Гипераммониемии. Глутаминаза почек, компенсация ацидоза | ||||
Обмен аммиака
Катаболизм аминокислот в тканях происходит постоянно со скоростью примерно 100 г/сут. При этом в результате дезаминирования аминокислот освобождается большое количество аммиака. Значительно меньшие количества его образуются при дезаминировании биогенных аминов и нуклеотидов.
Основные источники аммиака в клетке: аминокислоты, биогенные амины, АМФ.
Аммиак – токсичное для организма вещество!
Основной реакцией связывание аммиака, протекающей во всех тканях организма, является синтез глутамина под действием глутаминсинтетазы:
 В клетках кишечника под действием фермента глутаминазы происходит гидролитическое освобождение амидного азота в виде аммиака:
В клетках кишечника под действием фермента глутаминазы происходит гидролитическое освобождение амидного азота в виде аммиака:
 Метаболизм азота глутамина в кишечнике
Метаболизм азота глутамина в кишечнике
 Метаболизм амидного азота глутамина в почках
Метаболизм амидного азота глутамина в почках
 Пути использования глутамина в организме
Пути использования глутамина в организме
 Ещё одной реакцией обезвреживания аммиака в тканях можно считать синтез аспарагина под действием аспарагинсинтетазы:
Ещё одной реакцией обезвреживания аммиака в тканях можно считать синтез аспарагина под действием аспарагинсинтетазы:
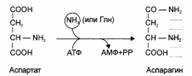 В мозге и некоторых других органах может протекать восстановительное аминирование α-кетоглутарата под действием глутаматдегидрогеназы, катализирующей обратимую реакцию. Однако этот путь обезвреживания аммиака в тканях используется слабо, т.к. глутаматдегидрогеназа катализирует преимущественно реакцию дезаминирования глутамата. Хотя, если учитывать последующее образование глутамина, реакция выгодна для клеток, т.к. способствует связыванию сразу 2 молекул NH3:
В мозге и некоторых других органах может протекать восстановительное аминирование α-кетоглутарата под действием глутаматдегидрогеназы, катализирующей обратимую реакцию. Однако этот путь обезвреживания аммиака в тканях используется слабо, т.к. глутаматдегидрогеназа катализирует преимущественно реакцию дезаминирования глутамата. Хотя, если учитывать последующее образование глутамина, реакция выгодна для клеток, т.к. способствует связыванию сразу 2 молекул NH3:
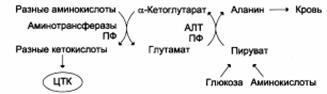
 Из мышц и кишечника избыток аммиака выводится преимущественно в виде аланина. Этот механизм необходим, т.к. активность глутаматдегидрогеназы в мышцах невелика и непрямое дезаминирование аминокислот малоэффективно. Поэтому в мышцах существует ещё один путь выведения азота. Образование аланина в этих органах можно представить следующей схемой:
Из мышц и кишечника избыток аммиака выводится преимущественно в виде аланина. Этот механизм необходим, т.к. активность глутаматдегидрогеназы в мышцах невелика и непрямое дезаминирование аминокислот малоэффективно. Поэтому в мышцах существует ещё один путь выведения азота. Образование аланина в этих органах можно представить следующей схемой:
 Основной источник аммиака – аминокислоты. Большая часть образовавшегося аммиака обезвреживается в орнитиновом цикле в печени и выделяется в виде мочевины. Основной реакцией обезвреживания аммиака в тканях является синтез глутамина, который затем используется в анаболических процессах и для обезвреживания веществ в печени.
Ферменты глутаматдегидрогеназа и глутаминсинтетаза являются регуляторными и обусловливают скорость процессов образования и обезвреживания аммиака.
Основной источник аммиака – аминокислоты. Большая часть образовавшегося аммиака обезвреживается в орнитиновом цикле в печени и выделяется в виде мочевины. Основной реакцией обезвреживания аммиака в тканях является синтез глутамина, который затем используется в анаболических процессах и для обезвреживания веществ в печени.
Ферменты глутаматдегидрогеназа и глутаминсинтетаза являются регуляторными и обусловливают скорость процессов образования и обезвреживания аммиака.
 Мочевина (карбамид) – полный амид угольной кислоты – содержит 2 атома азота:
NH2―C―NH2. ║ O
Источником одного из них является аммиак, который в печени связывается с диоксидом углерода с образованием карбамоилфосфата под действием карбамоилфосфатсинтетазы I:
Мочевина (карбамид) – полный амид угольной кислоты – содержит 2 атома азота:
NH2―C―NH2. ║ O
Источником одного из них является аммиак, который в печени связывается с диоксидом углерода с образованием карбамоилфосфата под действием карбамоилфосфатсинтетазы I:
 Далее под действием орнитин-карбомоилтрансферазы карбамоильная группа карбамоилфосфата переносится на α-аминокислоту орнитин, и образуется другая α-аминокислота – цитруллин:
Далее под действием орнитин-карбомоилтрансферазы карбамоильная группа карбамоилфосфата переносится на α-аминокислоту орнитин, и образуется другая α-аминокислота – цитруллин:
 В следующей реакции аргининосукцинатсинтетаза связывает цитруллин с аспартатом и образует аргининосукцинат. Этот фермент нуждается в ионах Mg2+. В реакции затрачивается 1 моль АТФ, но используется энергия двух макроэргических связей.
Аспартат – источник второго атома азота мочевины:
В следующей реакции аргининосукцинатсинтетаза связывает цитруллин с аспартатом и образует аргининосукцинат. Этот фермент нуждается в ионах Mg2+. В реакции затрачивается 1 моль АТФ, но используется энергия двух макроэргических связей.
Аспартат – источник второго атома азота мочевины:
 Далее фермент аргининосукцинатлиаза расщепляет аргининосукцинат на аргинин и фумарат, при этом аминогруппа аспартата оказывается в молекуле аргинина:
Далее фермент аргининосукцинатлиаза расщепляет аргининосукцинат на аргинин и фумарат, при этом аминогруппа аспартата оказывается в молекуле аргинина:
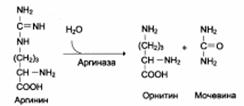
 Аргинин подвергается гидролизу под действием аргиназы, при этом образуется орнитин и мочевина.
Кофакторами аргиназы являются ионы Са2+ и Mn2+. Высокие концентрации орнитина и лизина, являющихся структурными аналогами аргинина, подавляют активность этого фермента:
Аргинин подвергается гидролизу под действием аргиназы, при этом образуется орнитин и мочевина.
Кофакторами аргиназы являются ионы Са2+ и Mn2+. Высокие концентрации орнитина и лизина, являющихся структурными аналогами аргинина, подавляют активность этого фермента:
 Суммарное уравнение синтеза мочевины:
СО2 + NH3 + Аспартат + 3 АТФ + 2Н2О →
→ Мочевина + Фумарат + 2 (АДФ + Н3РО4) + АМФ + Н4Р2О3
Орнитиновый цикл в печени выполняет 2 функции:
• превращение азота аминокислот в мочевину, которая экскретируется и предотвращает накопление токсических продуктов, главным образом амиака;
• синтез аргинина и пополнение его фонда в организме.
Регуляторные стадии процесса – синтез карбамоилфосфата, синтез цитруллина и заключительная стадия, катализируемая аргиназой.
Суммарное уравнение синтеза мочевины:
СО2 + NH3 + Аспартат + 3 АТФ + 2Н2О →
→ Мочевина + Фумарат + 2 (АДФ + Н3РО4) + АМФ + Н4Р2О3
Орнитиновый цикл в печени выполняет 2 функции:
• превращение азота аминокислот в мочевину, которая экскретируется и предотвращает накопление токсических продуктов, главным образом амиака;
• синтез аргинина и пополнение его фонда в организме.
Регуляторные стадии процесса – синтез карбамоилфосфата, синтез цитруллина и заключительная стадия, катализируемая аргиназой.
|
Основные источники аммиака
 Глюкозо-аланиновый цикл
Глюкозо-аланиновый цикл
 Окислительное дезаминирование глутамата происходит в митохондриях. Ферменты орнитинового цикла распределены между митохондриями и цитозолем. Поэтому необходим трансмембранный перенос глутамата и орнитина с помощью специфических транслоказ.
Орнитиновый цикл Кребса-Гензелейта
Окислительное дезаминирование глутамата происходит в митохондриях. Ферменты орнитинового цикла распределены между митохондриями и цитозолем. Поэтому необходим трансмембранный перенос глутамата и орнитина с помощью специфических транслоказ.
Орнитиновый цикл Кребса-Гензелейта
 На схеме показаны пути включения азота двух разных аминокислот (аминокислота 1 и аминокислота 2) в молекулу мочевины: * одна аминогруппа – в виде аммиака в матриксе митохондрии; * вторую поставляет аспартат цитозоля.
На схеме показаны пути включения азота двух разных аминокислот (аминокислота 1 и аминокислота 2) в молекулу мочевины: * одна аминогруппа – в виде аммиака в матриксе митохондрии; * вторую поставляет аспартат цитозоля.
| |||
| 3. Введение аминокислот в общий путь катаболизма и глюконеогенез. Декарбоксилирование аминокислот. Биогенные амины: образование, биологическая роль и инактивация. Полиамины: биологическая роль | ||||
В ходе катаболизма аминокислот происходит отщепление аминогруппы и выделение аммиака. Другим продуктом дезаминирования аминокислот служит их безазотистый остаток в виде α-кетокислот. Катаболизм аминокислот происходит практически постоянно. За сутки в норме в организме человека распадается примерно 100 г аминокислот, и такое же количество должно поступать в составе белков пищи.
Большая часть безазотистых остатков аминокислот превращается в пируват либо непосредственно (Ала, Сер), либо в результате более сложного пути, превращаясь вначале в один из метаболитов ЦТК.
Гликогенные и кетогенные аминокислоты
Катаболизм всех аминокислот сводится к образованию шести веществ, вступающих в общий путь катаболизма:
• пируват;
• ацетил-КоА;
• α-кетоглутарат;
• сукцинил-КоА;
• фумарат;
• оксалоацетат.
Включение безазотистого остатка аминокислот в общий путь катаболизма
 Аминокислоты, которые превращаются в пируват и промежуточные продукты ЦТК (α-кетоглутарат, сукцинил-КоА, фумарат) и образуют в конечном итоге оксалоацетат, могут использоваться в процессе глюконеогенеза. Такие аминокислоты относят к группе гликогенных аминокислот. Некоторые аминокислоты в процессе катаболизма превращаются в ацетоацетат (Лиз, Лей) или ацетил-КоА (Лей) и могут использоваться в синтезе кетоновых тел. Такие аминокислоты называют кетогенными.
Ряд аминокислот используются и для синтеза глюкозы, и для синтеза кетоновых тел, т.к. в процессе их катаболизма образуются 2 продукта – определённый метаболит цитратного цикла и ацетоацетат (Три, Фен, Тир) или ацетил-КоА (Иле). Такие аминокислоты называют глико-кетогеннымиили смешанными.
Декарбоксилирование аминокислот
Процесс отщепления карбоксильной группы аминокислот в виде СО2 получил название декарбоксилирования.Несмотря на ограниченный круг аминокислот и их производных, подвергающихся декарбоксилированию в животных тканях, образующиеся продукты реакции – биогенные амины – оказывают сильное фармакологическое действие на множество физиологических функций человека и животных. В животных тканях установлено декарбоксилирование следующих аминокислот и их производных: тирозина, триптофана, 5-окситриптофана, валина, серина, гистидина, глутаминовой и γ-оксиглутаминовой кислот, 3,4-диоксифенилаланина, цистеина, аргинина, орнитина, S-аденозилметионина и α-аминомалоновой кислоты. Помимо этого, у микроорганизмов и растений открыто декарбоксилирование ряда других аминокислот.
В живых организмах открыты 4 типа декарбоксилирования аминокислот:
1. α-Декарбоксилирование, характерное для тканей животных, при котором от аминокислот отщепляется карбоксильная группа, стоящая по соседству с α-углеродным атомом. Продуктами реакции являются СО2 и биогенные амины:
R-СН(NH2)-COOH → R-CH2-NH2 + CO2
2. ω-Декарбоксилирование, свойственное микроорганизмам. Например, из аспарагиновой кислоты этим путем образуется α-аланин:
HOOC-CH2-CH(NH2)-COOH → CH3-CH(NH2)-COOH + CO2
3. Декарбоксилирование, связанное с реакцией трансаминирования:
Аминокислоты, которые превращаются в пируват и промежуточные продукты ЦТК (α-кетоглутарат, сукцинил-КоА, фумарат) и образуют в конечном итоге оксалоацетат, могут использоваться в процессе глюконеогенеза. Такие аминокислоты относят к группе гликогенных аминокислот. Некоторые аминокислоты в процессе катаболизма превращаются в ацетоацетат (Лиз, Лей) или ацетил-КоА (Лей) и могут использоваться в синтезе кетоновых тел. Такие аминокислоты называют кетогенными.
Ряд аминокислот используются и для синтеза глюкозы, и для синтеза кетоновых тел, т.к. в процессе их катаболизма образуются 2 продукта – определённый метаболит цитратного цикла и ацетоацетат (Три, Фен, Тир) или ацетил-КоА (Иле). Такие аминокислоты называют глико-кетогеннымиили смешанными.
Декарбоксилирование аминокислот
Процесс отщепления карбоксильной группы аминокислот в виде СО2 получил название декарбоксилирования.Несмотря на ограниченный круг аминокислот и их производных, подвергающихся декарбоксилированию в животных тканях, образующиеся продукты реакции – биогенные амины – оказывают сильное фармакологическое действие на множество физиологических функций человека и животных. В животных тканях установлено декарбоксилирование следующих аминокислот и их производных: тирозина, триптофана, 5-окситриптофана, валина, серина, гистидина, глутаминовой и γ-оксиглутаминовой кислот, 3,4-диоксифенилаланина, цистеина, аргинина, орнитина, S-аденозилметионина и α-аминомалоновой кислоты. Помимо этого, у микроорганизмов и растений открыто декарбоксилирование ряда других аминокислот.
В живых организмах открыты 4 типа декарбоксилирования аминокислот:
1. α-Декарбоксилирование, характерное для тканей животных, при котором от аминокислот отщепляется карбоксильная группа, стоящая по соседству с α-углеродным атомом. Продуктами реакции являются СО2 и биогенные амины:
R-СН(NH2)-COOH → R-CH2-NH2 + CO2
2. ω-Декарбоксилирование, свойственное микроорганизмам. Например, из аспарагиновой кислоты этим путем образуется α-аланин:
HOOC-CH2-CH(NH2)-COOH → CH3-CH(NH2)-COOH + CO2
3. Декарбоксилирование, связанное с реакцией трансаминирования:
 В этой реакции образуются альдегид и новая аминокислота, соответствующая исходной кетокислоте.
4. Декарбоксилирование, связанное с реакцией конденсации двух молекул:
В этой реакции образуются альдегид и новая аминокислота, соответствующая исходной кетокислоте.
4. Декарбоксилирование, связанное с реакцией конденсации двух молекул:
 Эта реакция в тканях животных осуществляется при синтезе δ-аминолевулиновой кислоты из глицина и сукцинил-КоА и при синтезе сфинголипидов, а также у растений при синтезе биотина.
Далее представлены отдельные примеры декарбоксилирования аминокислот, в частности тех, продукты реакции которых оказывают сильное фармакологическое действие. Одним из хорошо изученных ферментов является декарбоксилаза ароматических аминокислот. Она не обладает строгой субстратной специфичностью и катализирует декарбоксилирование L-изомеров триптофана, 5-окситриптофана и 3,4-диоксифенилаланина (ДОФА); продуктами реакций, помимо СО2, являются соответственно триптамин, серотонин и диоксифенилэтиламин (дофамин).
Декарбоксилаза ароматических аминокислот получена в чистом виде (мол. масса 112000), кофермент – ПФ. В больших количествах она содержится в надпочечниках и ЦНС, играет важную роль в регуляции содержания биогенных аминов. Образующийся из 5-окситриптофана серотонин оказался высокоактивным биогенным амином сосудосуживающего действия. Серотонин регулирует артериальное давление, температуру тела, дыхание, почечную фильтрацию и является медиатором нервных процессов в ЦНС. Некоторые авторы считают серотонин причастным к развитию аллергии, демпинг-синдрома, токсикоза беременных, карциноидного синдрома и геморрагических диатезов.
Продукт декарбоксилазной реакции дофамин является предшественником катехоламинов (норадреналина и адреналина). Источником ДОФА в организме является тирозин, который под действием специфической гидроксилазы превращается в 3,4-диоксифенилаланин. Тирозин-3-монооксигеназа открыта в надпочечниках, ткани мозга и периферической нервной системы. Простетической группой тирозин-монооксигеназы, как и дофамин-монооксигеназы (последняя катализирует превращение дофамина в норадреналин) является тетрагидробиоптерин, имеющий следующее строение:
Эта реакция в тканях животных осуществляется при синтезе δ-аминолевулиновой кислоты из глицина и сукцинил-КоА и при синтезе сфинголипидов, а также у растений при синтезе биотина.
Далее представлены отдельные примеры декарбоксилирования аминокислот, в частности тех, продукты реакции которых оказывают сильное фармакологическое действие. Одним из хорошо изученных ферментов является декарбоксилаза ароматических аминокислот. Она не обладает строгой субстратной специфичностью и катализирует декарбоксилирование L-изомеров триптофана, 5-окситриптофана и 3,4-диоксифенилаланина (ДОФА); продуктами реакций, помимо СО2, являются соответственно триптамин, серотонин и диоксифенилэтиламин (дофамин).
Декарбоксилаза ароматических аминокислот получена в чистом виде (мол. масса 112000), кофермент – ПФ. В больших количествах она содержится в надпочечниках и ЦНС, играет важную роль в регуляции содержания биогенных аминов. Образующийся из 5-окситриптофана серотонин оказался высокоактивным биогенным амином сосудосуживающего действия. Серотонин регулирует артериальное давление, температуру тела, дыхание, почечную фильтрацию и является медиатором нервных процессов в ЦНС. Некоторые авторы считают серотонин причастным к развитию аллергии, демпинг-синдрома, токсикоза беременных, карциноидного синдрома и геморрагических диатезов.
Продукт декарбоксилазной реакции дофамин является предшественником катехоламинов (норадреналина и адреналина). Источником ДОФА в организме является тирозин, который под действием специфической гидроксилазы превращается в 3,4-диоксифенилаланин. Тирозин-3-монооксигеназа открыта в надпочечниках, ткани мозга и периферической нервной системы. Простетической группой тирозин-монооксигеназы, как и дофамин-монооксигеназы (последняя катализирует превращение дофамина в норадреналин) является тетрагидробиоптерин, имеющий следующее строение:
 Физиологическая роль тирозин-3-монооксигеназы чрезвычайно велика, поскольку катализируемая этим ферментом реакция определяет скорость биосинтеза катехоламинов, регулирующих деятельность сердечно-сосудистой системы. В медицинской практике широко используются ингибиторы декарбоксилазы ароматических аминокислот, в частности α-метилдофа (альдомет), вызывающий снижение артериального давления.
В животных тканях с высокой скоростью протекает декарбоксилирование гистидина под действием специфической декарбоксилазы.
СО2
Физиологическая роль тирозин-3-монооксигеназы чрезвычайно велика, поскольку катализируемая этим ферментом реакция определяет скорость биосинтеза катехоламинов, регулирующих деятельность сердечно-сосудистой системы. В медицинской практике широко используются ингибиторы декарбоксилазы ароматических аминокислот, в частности α-метилдофа (альдомет), вызывающий снижение артериального давления.
В животных тканях с высокой скоростью протекает декарбоксилирование гистидина под действием специфической декарбоксилазы.
СО2
 Гистидин Гистамин
Гистамин оказывает широкий спектр биологического действия. По механизму действия на кровеносные сосуды он резко отличается от других биогенных аминов, так как обладает сосудорасширяющим свойством.
Большое количество гистамина образуется в области воспаления, что имеет определенный биологический смысл. Вызывая расширение сосудов в очаге воспаления, гистамин тем самым ускоряет приток лейкоцитов, способствуя активации защитных сил организма. Кроме того, гистамин участвует в секреции соляной кислоты в желудке, что широко используется в клинике при изучении секреторной деятельности желудка (гистаминовая проба). Он имеет прямое отношение к явлениям сенсибилизации и десенсибилизации.
При повышенной чувствительности к гистамину в клинике используют антигистаминные препараты (санорин, димедрол и др.), оказывающие влияние на рецепторы сосудов. Гистамину приписывают также роль медиатора боли. Болевой синдром – сложный процесс, детали которого пока не выяснены, но участие в нем гистамина не подлежит сомнению.
В клинической практике широко используется, кроме того, продукт α-декарбоксилирования глутаминовой кислоты – γ-аминомасляная кислота (ГАМК). Фермент, катализирующий эту реакцию (глутаматдекарбоксилаза), является высокоспецифичным.
α β γ γ β α
HOOC-CH(NH2)-CH2-CH2-COOH → CH2(NH2)-CH2-CH2-COOH + CO2
Интерес к ГАМК объясняется ее тормозящим действием на деятельность ЦНС. Больше всего ГАМК и глутаматдекарбоксилазы обнаружено в сером веществе коры большого мозга, в то время как белое вещество мозга и периферическая нервная система их почти не содержат. Введение ГАМК в организм вызывает разлитой тормозной процесс в коре (центральное торможение) и у животных приводит к утрате условных рефлексов.
ГАМК используется в клинике как лекарственное средство при некоторых заболеваниях ЦНС, связанных с резким возбуждением коры большого мозга. Так, при эпилепсии хороший эффект (резкое сокращение частоты эпилептических припадков) дает введение глутаминовой кислоты. Как оказалось, лечебный эффект обусловлен не самой глутаминовой кислотой, а продуктом ее декарбоксилирования – ГАМК.
В животных тканях с высокой скоростью декарбоксилируются также два производных цистеина – цистеиновая и цистеинсульфиновая кислоты. В процессе этих специфических ферментативных реакций образуется таурин, который используется в организме для синтеза парных желчных кислот.
Гистидин Гистамин
Гистамин оказывает широкий спектр биологического действия. По механизму действия на кровеносные сосуды он резко отличается от других биогенных аминов, так как обладает сосудорасширяющим свойством.
Большое количество гистамина образуется в области воспаления, что имеет определенный биологический смысл. Вызывая расширение сосудов в очаге воспаления, гистамин тем самым ускоряет приток лейкоцитов, способствуя активации защитных сил организма. Кроме того, гистамин участвует в секреции соляной кислоты в желудке, что широко используется в клинике при изучении секреторной деятельности желудка (гистаминовая проба). Он имеет прямое отношение к явлениям сенсибилизации и десенсибилизации.
При повышенной чувствительности к гистамину в клинике используют антигистаминные препараты (санорин, димедрол и др.), оказывающие влияние на рецепторы сосудов. Гистамину приписывают также роль медиатора боли. Болевой синдром – сложный процесс, детали которого пока не выяснены, но участие в нем гистамина не подлежит сомнению.
В клинической практике широко используется, кроме того, продукт α-декарбоксилирования глутаминовой кислоты – γ-аминомасляная кислота (ГАМК). Фермент, катализирующий эту реакцию (глутаматдекарбоксилаза), является высокоспецифичным.
α β γ γ β α
HOOC-CH(NH2)-CH2-CH2-COOH → CH2(NH2)-CH2-CH2-COOH + CO2
Интерес к ГАМК объясняется ее тормозящим действием на деятельность ЦНС. Больше всего ГАМК и глутаматдекарбоксилазы обнаружено в сером веществе коры большого мозга, в то время как белое вещество мозга и периферическая нервная система их почти не содержат. Введение ГАМК в организм вызывает разлитой тормозной процесс в коре (центральное торможение) и у животных приводит к утрате условных рефлексов.
ГАМК используется в клинике как лекарственное средство при некоторых заболеваниях ЦНС, связанных с резким возбуждением коры большого мозга. Так, при эпилепсии хороший эффект (резкое сокращение частоты эпилептических припадков) дает введение глутаминовой кислоты. Как оказалось, лечебный эффект обусловлен не самой глутаминовой кислотой, а продуктом ее декарбоксилирования – ГАМК.
В животных тканях с высокой скоростью декарбоксилируются также два производных цистеина – цистеиновая и цистеинсульфиновая кислоты. В процессе этих специфических ферментативных реакций образуется таурин, который используется в организме для синтеза парных желчных кислот.
| Классификация аминокислот по судьбе безазотистого остатка
 Реакции декарбоксилирования в отличие от других процессов промежуточного обмена аминокислот являются необратимыми. Они катализируются специфическими ферментами – декарбоксилазами аминокислот, отличающимися от декарбоксилаз α-кетокислот как белковым компонентом, так и природой кофермента. Декарбоксилазы аминокислот состоят из белковой части, обеспечивающей специфичность действия, и простетической группы, представленной пиридоксальфосфатом (ПФ), как и у трансаминаз.
Помимо роли орнитина в биосинтезе мочевины, он (вместе с метионином) служит предшественником широко распространенных у млекопитающих (и бактерий)полиаминовспермина и спермидина (рис.).
Реакции декарбоксилирования в отличие от других процессов промежуточного обмена аминокислот являются необратимыми. Они катализируются специфическими ферментами – декарбоксилазами аминокислот, отличающимися от декарбоксилаз α-кетокислот как белковым компонентом, так и природой кофермента. Декарбоксилазы аминокислот состоят из белковой части, обеспечивающей специфичность действия, и простетической группы, представленной пиридоксальфосфатом (ПФ), как и у трансаминаз.
Помимо роли орнитина в биосинтезе мочевины, он (вместе с метионином) служит предшественником широко распространенных у млекопитающих (и бактерий)полиаминовспермина и спермидина (рис.).
 В организме здорового человека синтезируется приблизительно 0,5 ммоль спермина в день. Фармакологические дозы полиаминов вызывают понижение температуры и снижение кровяного давления. Спермидин и спермин участвуют в различных физиологических процессах, общим признаком которых является связь с процессами пролиферации и роста клеток. Они являются факторами роста для культур клеток млекопитающих и бактерий и играют определенную роль в стабилизации интактных клеток, субклеточных органелл и мембран. Благодаря тому что молекулы полиаминов несут большое число положительных зарядов, они легко ассоциируют с полианионами, такими, как ДНК и РНК, и участвуют в таких фундаментальных процессах, как стимуляция биосинтеза ДНК и РНК, стабилизация ДНК и упаковка ДНК в бактериофагах. Полиамины оказывают влияние на синтез белка и являются ингибиторами ряда ферментов, включая протеинкиназы.
Таким образом, биогенные амины являются сильными фармакологически активными веществами, оказывающими разностороннее влияние на физиологические функции организма. Некоторые биогенные амины нашли широкое применение в качестве лекарственных препаратов.
В организме здорового человека синтезируется приблизительно 0,5 ммоль спермина в день. Фармакологические дозы полиаминов вызывают понижение температуры и снижение кровяного давления. Спермидин и спермин участвуют в различных физиологических процессах, общим признаком которых является связь с процессами пролиферации и роста клеток. Они являются факторами роста для культур клеток млекопитающих и бактерий и играют определенную роль в стабилизации интактных клеток, субклеточных органелл и мембран. Благодаря тому что молекулы полиаминов несут большое число положительных зарядов, они легко ассоциируют с полианионами, такими, как ДНК и РНК, и участвуют в таких фундаментальных процессах, как стимуляция биосинтеза ДНК и РНК, стабилизация ДНК и упаковка ДНК в бактериофагах. Полиамины оказывают влияние на синтез белка и являются ингибиторами ряда ферментов, включая протеинкиназы.
Таким образом, биогенные амины являются сильными фармакологически активными веществами, оказывающими разностороннее влияние на физиологические функции организма. Некоторые биогенные амины нашли широкое применение в качестве лекарственных препаратов.
| |||
| 4. Распад глицина и метаболизм одноуглеродных групп. Обмен серина и треонина. S-аденозилметионин, реакции метилирования. Синтез креатина: биологическая роль, клиническое значение определения в моче и плазме крови креатина и креатинина | ||||
Биосинтез заменимых аминокислот
Из 12 заменимых аминокислот (таблица) 9 образуются из амфиболических метаболитов, а три (Цис, Тир и Гидроксилизин) - из незаменимых аминокислот. Центральное место в биосинтезе аминокислот занимают глутаматдегидрогеназа, глутаминсинтаза и трансаминазы. Благодаря совместному действию этих ферментов катализируется включение неорганического иона аммония в а-аминогруппу аминокислот.
Особое значение реакций катаболизма серина и глицина заключается в том, что они сопровождаются образованием одноуглеродного метиленового фрагмента (-СН2-). Метиленовая группа в молекуле метилен-Н4-фолата может превращаться в другие одноуглеродные группы (фрагменты): метильную (-СН=), формильную (-НС=О), метильную (-СН3) и формиминогруппу (-СН=NН).
Глицин
Глицин является единственной из всех входящих в состав белков аминокислот, в молекуле которой отсутствует асимметричный атом углерода. Тем не менее метаболически он связан с химическими компонентами организма в большей степени, чем любая другая аминокислота.
Основной путь катаболизма глицина у человека и других позвоночных связан с использованием Н4-фолата:
 Эта реакция обратима и катализируется ферментом глицинсинтазой.
Синтез глицина в тканях млекопитающих осуществляется несколькими путями. В цитозоле печени содержится глицинтрансаминаза, катализирующая синтез глицина из глиоксилата и глутамата (или аланина). В отличие от большинства реакций переаминирования равновесие этой реакций сильно смещено в направлении синтеза глицина. Два важных дополнительных пути, функционирующие у млекопитающих, используют для образования глицина холин и серии; в последнем случае катализ осуществляется серингидроксиметилтрансферазой.
Реакция, катализируемая серингидроксиметилтрансферазой
Эта реакция обратима и катализируется ферментом глицинсинтазой.
Синтез глицина в тканях млекопитающих осуществляется несколькими путями. В цитозоле печени содержится глицинтрансаминаза, катализирующая синтез глицина из глиоксилата и глутамата (или аланина). В отличие от большинства реакций переаминирования равновесие этой реакций сильно смещено в направлении синтеза глицина. Два важных дополнительных пути, функционирующие у млекопитающих, используют для образования глицина холин и серии; в последнем случае катализ осуществляется серингидроксиметилтрансферазой.
Реакция, катализируемая серингидроксиметилтрансферазой
 Реакция легко обратима. Н4 фолат – тетрагидрофолат.
Серин
Серии образуется из гликолитического промежуточного продукта D-3-фосфоглицерата. α-Гидроксильная группа при участии NAD+ окисляется в оксогруппу; далее в результате переаминирования образуется фосфосерин, который затем дефосфорилируется, образуя серин.
Биосинтез серина
Реакция легко обратима. Н4 фолат – тетрагидрофолат.
Серин
Серии образуется из гликолитического промежуточного продукта D-3-фосфоглицерата. α-Гидроксильная группа при участии NAD+ окисляется в оксогруппу; далее в результате переаминирования образуется фосфосерин, который затем дефосфорилируется, образуя серин.
Биосинтез серина
 α-АК – α-аминокислота, α-КК – α-кетокислота.
Треонин
Треонин расщепляется треонинальдолазой на ацетальдегид и глицин, из ацетальдегида затем образуется ацетил-СоА. Треонин в реакциях переаминирования не участвует; его D-изомер и соответствующая α-кетокислота млекопитающими не усваиваются. В ряде белков треонин находится в форме О-фосфотреонина.
Креатин
Креатин – важный компонент мышц, мозга, крови; в форме креатинфосфата он служит высокоэнергетическим фосфатом. В норме небольшие количества креатина экскретируются мочой, уровень экскреции повышается при усилении катаболизма и при мышечной дистрофии.
Интерпретация
1. Повышение показателя имеет место при мышечных дистрофиях (прогрессирующая мышечная дистрофия, атрофическая миотония, миастения гравис), мышечной гипотрофии (острый полиомиелит, боковой амиотрофический склероз, миозит, проявляющийся в гипотрофии мышц), при голодании и кахексии, гипертиреозе и лихорадочных состояниях.
2. Снижение показателя имеет место при гипотиреозе, врожденной амиотонии, почечной недостаточности.
Креатинин в сыворотке или плазме
Норма: 0,7-1,5 мг% (СИ: 60-132 мкмоль/л).
Физиологическая основа.Эндогенный креатинин экскретируется путем фильтрации в клубочках и путем секреции в канальцах; в результате его клиренс выше, чем у инулина примерно на 20%. Реакция Яффе определяет все хромогены плазмы, а не только креатинин. Поскольку хромогены в мочу не переходят, при определении креатинина в моче получают величину на 20% меньше суммарного количества креатинина + хромогена в плазме; это различие однако, компенсируется количеством креатинина, секретируемого в канальцах. Таким образом, клиренс креатинина – общепринятый метод оценки клубочковой фильтрации, кроме случаев прогрессирующей почечной недостаточности, при которой клиренс креатинина превышает клиренс инулина благодаря секреции креатинина оставшимися почечными канальцами.
Интерпретация. Повышение показателя имеет место при острой или хронической почечной недостаточности, закупорке мочевыводящих путей и нарушении функции почек, вызванном некоторыми лекарственными препаратами. Кроме креатинина, другие вещества могут реагировать с пикриновой кислотой в щелочной среде (реакция Яффе), давая ложно завышенные результаты: ацетоацетат, ацетон, β-оксибутират, α-кетоглутарат, пируват, глюкоза, билирубин, гемоглобин, мочевина и мочевая кикислота. Значения показателя ниже 0,7 мг% пока не получили объяснения.
α-АК – α-аминокислота, α-КК – α-кетокислота.
Треонин
Треонин расщепляется треонинальдолазой на ацетальдегид и глицин, из ацетальдегида затем образуется ацетил-СоА. Треонин в реакциях переаминирования не участвует; его D-изомер и соответствующая α-кетокислота млекопитающими не усваиваются. В ряде белков треонин находится в форме О-фосфотреонина.
Креатин
Креатин – важный компонент мышц, мозга, крови; в форме креатинфосфата он служит высокоэнергетическим фосфатом. В норме небольшие количества креатина экскретируются мочой, уровень экскреции повышается при усилении катаболизма и при мышечной дистрофии.
Интерпретация
1. Повышение показателя имеет место при мышечных дистрофиях (прогрессирующая мышечная дистрофия, атрофическая миотония, миастения гравис), мышечной гипотрофии (острый полиомиелит, боковой амиотрофический склероз, миозит, проявляющийся в гипотрофии мышц), при голодании и кахексии, гипертиреозе и лихорадочных состояниях.
2. Снижение показателя имеет место при гипотиреозе, врожденной амиотонии, почечной недостаточности.
Креатинин в сыворотке или плазме
Норма: 0,7-1,5 мг% (СИ: 60-132 мкмоль/л).
Физиологическая основа.Эндогенный креатинин экскретируется путем фильтрации в клубочках и путем секреции в канальцах; в результате его клиренс выше, чем у инулина примерно на 20%. Реакция Яффе определяет все хромогены плазмы, а не только креатинин. Поскольку хромогены в мочу не переходят, при определении креатинина в моче получают величину на 20% меньше суммарного количества креатинина + хромогена в плазме; это различие однако, компенсируется количеством креатинина, секретируемого в канальцах. Таким образом, клиренс креатинина – общепринятый метод оценки клубочковой фильтрации, кроме случаев прогрессирующей почечной недостаточности, при которой клиренс креатинина превышает клиренс инулина благодаря секреции креатинина оставшимися почечными канальцами.
Интерпретация. Повышение показателя имеет место при острой или хронической почечной недостаточности, закупорке мочевыводящих путей и нарушении функции почек, вызванном некоторыми лекарственными препаратами. Кроме креатинина, другие вещества могут реагировать с пикриновой кислотой в щелочной среде (реакция Яффе), давая ложно завышенные результаты: ацетоацетат, ацетон, β-оксибутират, α-кетоглутарат, пируват, глюкоза, билирубин, гемоглобин, мочевина и мочевая кикислота. Значения показателя ниже 0,7 мг% пока не получили объяснения.
|
Потребности человека в аминокислотах
 1) – Фактически это «полузаменимая» аминокислота, поскольку она синтезируется в организме, однако, скорость синтеза недостаточна для того, чтобы обеспечить рост организма в детском возрасте.
2) – Не используется в процессе синтеза белка и образуется в ходе посттрансляционного процессинга коллагена.
Биологическая роль глицина и серина
1) – Фактически это «полузаменимая» аминокислота, поскольку она синтезируется в организме, однако, скорость синтеза недостаточна для того, чтобы обеспечить рост организма в детском возрасте.
2) – Не используется в процессе синтеза белка и образуется в ходе посттрансляционного процессинга коллагена.
Биологическая роль глицина и серина
 На схеме видно, что глицин в некоторых синтезах играет незаменимую роль, в частности в образовании белков, пуриновых нуклеотидов, гемма гемоглобина, парных желчных кислот, креатина, глутатиона и др. Большинство этих реакций представлено в соответствующих разделах учебника. Здесь укажем на реакции, при помощи которых осуществляются взаимопревращения глицина, серина и треонина, а также на реакции катаболизма глицина. Показано, что в реакции взаимопревращения глицина и серина участвует тетрагидрофолиевая кислота; эту реакцию катализирует пиридоксалевый фермент серин-оксиметилтрансфераза. Имеются также доказательства взаимопревращения треонина и глицина в треонинальдолазной реакции. Основным путем катаболизма глицина в животных тканях, однако, считается распад его на СО2, NH3 и N5,N10-метилентетрагидрофолиевую кислоту.
Серин легко превращается в пируват под действием сериндегидратазы. В связи с этим в тканях имеются условия для превращения глицина (через серин) в пируват. Этим путем осуществляется участие глицина в обмене углеводов. Важную роль играет серин в биосинтезе сложных белков – фосфопротеинов, а также фосфоглицеридов. Помимо фосфатидилсерина, углеродный скелет и азот серина используются в биосинтезе фосфатидилэтаноламина и фосфатидилхолина. Ряд других эссенциальных функций глицина, в частности участие в образовании δ-аминолевулиновой кислоты при синтезе порфиринов (гема) и пуриновых нуклеотидов, рассматривается далее.
Синтез креатина
Креатин необходим для образования в мышцах высокоэнергетического соединения – креатинфосфата.
На схеме видно, что глицин в некоторых синтезах играет незаменимую роль, в частности в образовании белков, пуриновых нуклеотидов, гемма гемоглобина, парных желчных кислот, креатина, глутатиона и др. Большинство этих реакций представлено в соответствующих разделах учебника. Здесь укажем на реакции, при помощи которых осуществляются взаимопревращения глицина, серина и треонина, а также на реакции катаболизма глицина. Показано, что в реакции взаимопревращения глицина и серина участвует тетрагидрофолиевая кислота; эту реакцию катализирует пиридоксалевый фермент серин-оксиметилтрансфераза. Имеются также доказательства взаимопревращения треонина и глицина в треонинальдолазной реакции. Основным путем катаболизма глицина в животных тканях, однако, считается распад его на СО2, NH3 и N5,N10-метилентетрагидрофолиевую кислоту.
Серин легко превращается в пируват под действием сериндегидратазы. В связи с этим в тканях имеются условия для превращения глицина (через серин) в пируват. Этим путем осуществляется участие глицина в обмене углеводов. Важную роль играет серин в биосинтезе сложных белков – фосфопротеинов, а также фосфоглицеридов. Помимо фосфатидилсерина, углеродный скелет и азот серина используются в биосинтезе фосфатидилэтаноламина и фосфатидилхолина. Ряд других эссенциальных функций глицина, в частности участие в образовании δ-аминолевулиновой кислоты при синтезе порфиринов (гема) и пуриновых нуклеотидов, рассматривается далее.
Синтез креатина
Креатин необходим для образования в мышцах высокоэнергетического соединения – креатинфосфата.
 В биосинтезе креатина принимают участие три аминокислоты: аргинин, глицин и метионин. Реакция синтеза протекает в две стадии. Первая стадия – биосинтез гуанидинацетата – осуществляется в почках при участии глицинамидинотрансферазы (КФ 2.1.4.1).
В биосинтезе креатина принимают участие три аминокислоты: аргинин, глицин и метионин. Реакция синтеза протекает в две стадии. Первая стадия – биосинтез гуанидинацетата – осуществляется в почках при участии глицинамидинотрансферазы (КФ 2.1.4.1).
 Вторая стадия синтеза креатина протекает в печени при участии гуанидинацетатметилтрансферазы (КФ 2.1.1.2).
Вторая стадия синтеза креатина протекает в печени при участии гуанидинацетатметилтрансферазы (КФ 2.1.1.2).
 (SAM – S-аденозилметионин; SAГ – S-аденозилгомоцистеин).
Креатин подвергается фосфорилированию с образованием креатинфосфата, который после дефосфорилирования (необратимая реакция) превращается в креатинин, выделяющийся с мочой.
Креатин и креатинин в моче. Нормальные значения (24 ч)
(SAM – S-аденозилметионин; SAГ – S-аденозилгомоцистеин).
Креатин подвергается фосфорилированию с образованием креатинфосфата, который после дефосфорилирования (необратимая реакция) превращается в креатинин, выделяющийся с мочой.
Креатин и креатинин в моче. Нормальные значения (24 ч)

| |||
| 5. b-аланиновые дипептиды: карнозин и анзерин, их биологическая роль. Обмен фенилаланина и тирозина. Фенилкетонурия, алкаптонурия, альбинизм. Обмен триптофана | ||||
β-Аланиновые дипептиды
Основная часть β-аланина в организме человека находится в скелетных мышцах в-составе дипептида карнозина. Сходный по строению β-аланиновый дипептид ансерин (N-метилкарнозин или β-аланил-1-метил- L-гистидин) в мышцах человека отсутствует, но имеется в скелетных мышцах тех видов, у которых мышцы способны к быстрым сокращениям (мышцы конечностей кролика, грудная мышца птиц). Таким образом, ансерин может выполнять функции, отличные от функций карнозина.
Физиологические функции β-аланил-имидазольных дипептидов не вполне ясны. Возможно, они выполняют буферные функции и поддерживают рН в скелетной мышце, сокращающейся в анаэробных условиях. Карнозин и ансерин стимулируют АТР-азную активность миозина in vitro. Оба дипептида образуют хелатные комплексы с медью и способствуют поглощению этого металла. Они, следовательно, могут участвовать в патологическом процессе при болезни Вильсона.
Биосинтез.Карнозин образуется из β-аланина и L-гистидина в результате реакции с участием АТФ, катализируемой карнозинсинтетазой:
АТФ + L-Гистидин + β-Аланин → АМФ + ФФн + Карнозин
Ансерин образуется из карнозина (донором метильной группы служит S-аденозилметионин) в результате реакции, катализируемой N-метилтрансферазой:
S-Аденозилметионин + Карнозин → S-Аденозилгомоцистеин +
+ Ансерин
В ткань почек и энтероциты кишечника карнозин и β-аланин поступают при участии мембранных переносчиков, которые отличают один субстрат от другого и оба субстрата от других дипептидов. Способность переносчиков отличать C-аланин от карнозина используется при диагностике болезни Хартнупа – наследственного нарушения транспорта некоторых нейтральных а-аминокислот. У пациентов с болезнью Хартнупа содержание в крови гистидина соответствует норме после приема с пищей карнозина, но оказывается ниже нормы после приема L-гистидина.
Катаболизм.Карнозин гидролизуется с образованием β-аланина и L-гистидина содержащимся в сыворотке цинксодержащим металлоферментом карнозиназой (карнозин-гидролазой). В сыворотке имеются две формы карнозиназы.
Тирозин
Тирозин образуется из фенилаланина в реакции, катализируемой фенилаланингидроксилазой, поэтому фенилаланин относится к незаменимым аминокислотам, а тирозин – нет (при условии, что диета содержит достаточное количество фенилаланина). Реакция необратима, и поэтому тирозин не может заменить пищевой фенилаланин. Фенилаланингидроксилазный комплекс является оксигеназой со смешанной функцией, она имеется в печени млекопитающих и отсутствует в других тканях. В результате реакции один атом молекулярного кислорода включается в пара-положение фенилаланина, а другой восстанавливается, образуя воду. Восстановительные эквиваленты, первоначально поставляемые NADPH, затем передаются непосредственно участвующему в реакции тетрагидробиоптерину – птеридину, подобному по структуре фрагменту фолиевой кислоты.
Реакция, катализируемая фенилаланингидроксилазой
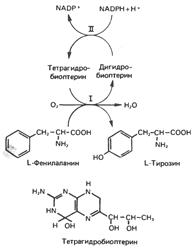 Она осуществляется с участием двух типов активности. Активность II катализирует восстановление дигидробиоптерина за счет NADPH, активность I – восстановление О2 в Н2О и превращение фенилаланина в тирозин. Нарушения хода этой реакции лежат в основе нарушений метаболизма фенилаланина.
Нарушения катаболизма тирозина.
Тяжелые нарушения катаболизма приводят к тирозинемии, тирозинурии и фенолацидурии.
А. Тнрозинемня типа I (тирозиноз). Тирозиноз характеризуется накоплением метаболитов, снижающих активность ряда ферментов и транспортных систем. Патофизиология этого нарушения является, следовательно, весьма сложной. Дефектными ферментами являются, вероятно, фумарилацетоацетатгидролаза и малеилацетоацетатгидролаза. Известны острая и хроническая формы тирозиноза. Острая форма характерна для младенческого возраста, ее признаками являются понос, рвота, «капустный» запах, задержка в развитии. Если не проводится лечение, летальный исход наступает в возрасте 6-8 месяцев из-за недостаточности печени. Хроническая тирозинемия характеризуется сходными, но более умеренно выраженными симптомами; летальный исход наступает в возрасте примерно 10 лет. Содержание тирозина в плазме повышается до 6-12 мг/100 мл, повышено содержание и некоторых других аминокислот, особенно метионина. Лечение включает диету с пониженным содержанием тирозина и фенилаланина, а в ряде случаев также и метионина.
Б. Тирозинемия типа II (синдром Рихнера-Ханхарта).Предполагаемой причиной метаболических нарушений при тирозинемии типа II является недостаточность тирозин-трансаминазы печени. Клинические проявления включают повышение содержания тирозина в плазме (4-5 мг/100 мл), характерные поражения глаз и кожи и умеренную умственную отсталость. Отмечались также случаи членовредительства, нарушения тонкой координации движений. Тирозин является единственной аминокислотой, концентрация которой в моче повышена. Тем не менее клубочковая фильтрация и обратное всасывание тирозина остаются в пределах нормы. В число метаболитов, экскретируемых с мочой, входят /7-гидроксифенилпируват, w-гидроксифениллактат, w-гидроксифенилацетат, N-ацетилтирозин и тирамин.
В. Тирозинемия новорожденных. Причиной болезни считается недостаточность «-гидроксифенилпируват-гидроксилазы. Повышено содержание в крови тирозина и фенилаланина, а в моче содержание тирозина, w-гидроксифенилацетата, N-ацетилтирозина и тирамина. При лечении назначают бедную белком диету.
Г. Алкаптонурия.Это наследственное метаболическое нарушение описано в медицинской литературе еще в XVI в., оно было охарактеризовано в 1859 г. Болезнь представляет значительный исторический интерес, поскольку именно на основе ее изучения Гаррод выдвинул идею о наследственных метаболических нарушениях. Наиболее ярким клиническим проявлением этой болезни является потемнение мочи при условиях доступа воздуха. На более поздних стадиях заболевания наблюдается общая пигментация соединительной ткани (охроноз) и развивается артрит. Причиной болезни является недостаточность гомогентизат-оксидазы. Субстрат фермента, гомогентизат, экскретируется с мочой; при окислении на воздухе он образует темно-коричневый пигмент. Зарегистрировано свыше 600 случаев заболевания, частота заболевания оценивается в 2-5 случаев на миллион новорожденных. Алкаптонурия наследуется по аутосомно-рецессивному типу. В настоящее время не найдено диагностических методов выявления гетерозигот. Хотя механизм охроноза не установлен, полагают, что он обусловлен окислением гомогентизата полифенолоксидазой, приводящим к образованию бензохиноацетата, который далее полимеризуется и связывается с макромолекулами соединительной ткани.
Феннлаланин
Фенилаланин сначала превращается в тирозин при участии фенилаланингидроксилазы. Распределение изотопной метки в амфиболических продуктах фумарате и ацетоацетате такое же, как и в соответствующих продуктах катаболизма тирозина. Метаболические нарушения катаболизма фенилаланина. Главные метаболические нарушения состоят в блокировании превращения фенилаланина в тирозин. Можно выделить три причины нарушений: недостаточность фенилаланингидроксилазы (гиперфенилаланинемия типа I, или классическая фенилкетонурия), недостаточность дигидробиоптеринредуктазы (гиперфенилаланинемия типов II и III) и нарушения биосинтеза дигидробиоптерина (гиперфенилаланинемия типов IV и V). Были также зарегистрированы нарушения других типов.
Главным последствием гиперфенилаланинемии типа 1 (классическая фенилкетонурия, ФКУ) при отсутствии лечения является умственная отсталость (ниже 70 баллов по стандартному тесту для детей старшего возраста). Дополнительными клиническими симптомами являются припадки, психозы, экзема и «мышиный» запах. При раннем диагнозе и своевременном лечении эти симптомы могут не развиться. В связи с наличием экспериментальных моделей заболевания, а также благодаря возможности путем регулирования диеты предотвращать неизбежное в другом случае состояние, характеризующееся умственной отсталостью, ФКУ служит моделью для изучения этого состояния при других метаболических нарушениях. При классической ФКУ, которая является наследственным нарушением, встречающимся с частотой 1 на 10000 новорожденных, содержание в печени компонента 1 фенилаланингидроксилазы составляет около 25% от нормы; при этом фермент оказывается нечувствительным к регуляторному действию фенилаланина.
Организм пациента оказывается не способным превращать фенилаланин в тирозин, в результате образуются альтернативные катаболиты фенилаланина. В их число входят фенилпировиноградная кислота (продукт дезаминирования фенилаланина), фенилмолочная кислота (продукт восстановления фенилпировиноградной кислоты) и фенилуксусная кислота, образующаяся путем декарбоксилирования и окисления фенилпировиноградной кислоты. Большая часть фенилацетата в печени конъюгирует с глутамином и экскретируется с мочой в виде конъюгата фенилацетилглутамина. Присутствие в моче кетокислоты фенилпирувата определило и само название болезни – фенилкетонурия.
Она осуществляется с участием двух типов активности. Активность II катализирует восстановление дигидробиоптерина за счет NADPH, активность I – восстановление О2 в Н2О и превращение фенилаланина в тирозин. Нарушения хода этой реакции лежат в основе нарушений метаболизма фенилаланина.
Нарушения катаболизма тирозина.
Тяжелые нарушения катаболизма приводят к тирозинемии, тирозинурии и фенолацидурии.
А. Тнрозинемня типа I (тирозиноз). Тирозиноз характеризуется накоплением метаболитов, снижающих активность ряда ферментов и транспортных систем. Патофизиология этого нарушения является, следовательно, весьма сложной. Дефектными ферментами являются, вероятно, фумарилацетоацетатгидролаза и малеилацетоацетатгидролаза. Известны острая и хроническая формы тирозиноза. Острая форма характерна для младенческого возраста, ее признаками являются понос, рвота, «капустный» запах, задержка в развитии. Если не проводится лечение, летальный исход наступает в возрасте 6-8 месяцев из-за недостаточности печени. Хроническая тирозинемия характеризуется сходными, но более умеренно выраженными симптомами; летальный исход наступает в возрасте примерно 10 лет. Содержание тирозина в плазме повышается до 6-12 мг/100 мл, повышено содержание и некоторых других аминокислот, особенно метионина. Лечение включает диету с пониженным содержанием тирозина и фенилаланина, а в ряде случаев также и метионина.
Б. Тирозинемия типа II (синдром Рихнера-Ханхарта).Предполагаемой причиной метаболических нарушений при тирозинемии типа II является недостаточность тирозин-трансаминазы печени. Клинические проявления включают повышение содержания тирозина в плазме (4-5 мг/100 мл), характерные поражения глаз и кожи и умеренную умственную отсталость. Отмечались также случаи членовредительства, нарушения тонкой координации движений. Тирозин является единственной аминокислотой, концентрация которой в моче повышена. Тем не менее клубочковая фильтрация и обратное всасывание тирозина остаются в пределах нормы. В число метаболитов, экскретируемых с мочой, входят /7-гидроксифенилпируват, w-гидроксифениллактат, w-гидроксифенилацетат, N-ацетилтирозин и тирамин.
В. Тирозинемия новорожденных. Причиной болезни считается недостаточность «-гидроксифенилпируват-гидроксилазы. Повышено содержание в крови тирозина и фенилаланина, а в моче содержание тирозина, w-гидроксифенилацетата, N-ацетилтирозина и тирамина. При лечении назначают бедную белком диету.
Г. Алкаптонурия.Это наследственное метаболическое нарушение описано в медицинской литературе еще в XVI в., оно было охарактеризовано в 1859 г. Болезнь представляет значительный исторический интерес, поскольку именно на основе ее изучения Гаррод выдвинул идею о наследственных метаболических нарушениях. Наиболее ярким клиническим проявлением этой болезни является потемнение мочи при условиях доступа воздуха. На более поздних стадиях заболевания наблюдается общая пигментация соединительной ткани (охроноз) и развивается артрит. Причиной болезни является недостаточность гомогентизат-оксидазы. Субстрат фермента, гомогентизат, экскретируется с мочой; при окислении на воздухе он образует темно-коричневый пигмент. Зарегистрировано свыше 600 случаев заболевания, частота заболевания оценивается в 2-5 случаев на миллион новорожденных. Алкаптонурия наследуется по аутосомно-рецессивному типу. В настоящее время не найдено диагностических методов выявления гетерозигот. Хотя механизм охроноза не установлен, полагают, что он обусловлен окислением гомогентизата полифенолоксидазой, приводящим к образованию бензохиноацетата, который далее полимеризуется и связывается с макромолекулами соединительной ткани.
Феннлаланин
Фенилаланин сначала превращается в тирозин при участии фенилаланингидроксилазы. Распределение изотопной метки в амфиболических продуктах фумарате и ацетоацетате такое же, как и в соответствующих продуктах катаболизма тирозина. Метаболические нарушения катаболизма фенилаланина. Главные метаболические нарушения состоят в блокировании превращения фенилаланина в тирозин. Можно выделить три причины нарушений: недостаточность фенилаланингидроксилазы (гиперфенилаланинемия типа I, или классическая фенилкетонурия), недостаточность дигидробиоптеринредуктазы (гиперфенилаланинемия типов II и III) и нарушения биосинтеза дигидробиоптерина (гиперфенилаланинемия типов IV и V). Были также зарегистрированы нарушения других типов.
Главным последствием гиперфенилаланинемии типа 1 (классическая фенилкетонурия, ФКУ) при отсутствии лечения является умственная отсталость (ниже 70 баллов по стандартному тесту для детей старшего возраста). Дополнительными клиническими симптомами являются припадки, психозы, экзема и «мышиный» запах. При раннем диагнозе и своевременном лечении эти симптомы могут не развиться. В связи с наличием экспериментальных моделей заболевания, а также благодаря возможности путем регулирования диеты предотвращать неизбежное в другом случае состояние, характеризующееся умственной отсталостью, ФКУ служит моделью для изучения этого состояния при других метаболических нарушениях. При классической ФКУ, которая является наследственным нарушением, встречающимся с частотой 1 на 10000 новорожденных, содержание в печени компонента 1 фенилаланингидроксилазы составляет около 25% от нормы; при этом фермент оказывается нечувствительным к регуляторному действию фенилаланина.
Организм пациента оказывается не способным превращать фенилаланин в тирозин, в результате образуются альтернативные катаболиты фенилаланина. В их число входят фенилпировиноградная кислота (продукт дезаминирования фенилаланина), фенилмолочная кислота (продукт восстановления фенилпировиноградной кислоты) и фенилуксусная кислота, образующаяся путем декарбоксилирования и окисления фенилпировиноградной кислоты. Большая часть фенилацетата в печени конъюгирует с глутамином и экскретируется с мочой в виде конъюгата фенилацетилглутамина. Присутствие в моче кетокислоты фенилпирувата определило и само название болезни – фенилкетонурия.
|
Триптофан
Вторичный путь метаболизма триптофана включает его гидроксилирование до 5-гидрокситриптофана. Окисление триптофана путем гидроксилирования аналогично превращению фенилаланина в тирозин (рис.), причем печеночная фенилаланингидроксилаза катализирует также и гидроксилирование триптофана.
Биосинтез и метаболизм мелатонина. [NH4+] - переаминирование; МАО—моноаминоксидаза. В тексте приведены ссылки на номера реакций.
При декарбоксилировании 5-гидрокситриптофана образуется 5-гидрокситриптамин (серотонин) (рис., реакция 1) — мощный сосудосуживающий агент и стимулятор сокращения гладких мышц.
 5-Гидрокситриптофан-декарбоксилаза, образующая серотонин из гидрокситриптофана, находится в почках (свинья, морская свинка), печени и желудке. Однако декарбоксилирование 5-гидрокситриптофана может осуществляться и более широко распространенной декарбоксилазой ароматических L-аминокислот.
Большая часть серотонина подвергается окислительному дезаминированию с образованием 5-гидроксииндолацетата. Ферментом, катализирующим эту реакцию, является моноамнноксидаза (рис., реакция 2). К числу ингибиторов этого фермента относится ипрониазид. Предполагают, что психическая стимуляция, наступающая после приема этого лекарства, обусловлена его способностью пролонгировать действие серотонина благодаря ингибированию моноаминоксидазы. В моче здорового человека в составе суточной порции экскретируется 2-8 мг 5-гидроксииндолацетата.
Образование серотонина значительно увеличивается при злокачественном карциноиде (аргентаффиноме). Это заболевание характеризуется распространением серотонин-образующих опухолевых клеток в аргентаффинной ткани брюшной полости. При карциноиде наблюдается нарушение метаболизма триптофана, в результате которого значительно большая, чем в норме, доля триптофана метаболизирует по пути образования гидроксииндола. В норме в серотонин превращается лишь 1% триптофана, а у пациентов с карциноидом 60%. Такое отклонение метаболизма от основного пути значительно снижает образование из триптофана никотиновой кислоты; в результате могут наблюдаться симптомы пеллагры, а также отрицательный азотистый баланс.
Другими метаболитами серотонина, идентифицированными в моче больных карциноидом, являются 5-гидроксииндолацетурат (конъюгат глицина и 5-гидроксииндолацетата) и конъюгат N-ацетил-серотонина с глюкуроновой кислотой.
Мелатонин
Мелатонин образуется из серотонина путем N-ацетилирования (рис., реакция 3) и последующего метилирования 5-гидроксильной группы (рис., реакция 4). Метилирование происходит в ткани шишковидной железы. Наряду с метилированием N-ацетилсеротонина происходит также прямое метилирование серотонина (рис., реакция 5) и его метаболита 5-гидроксииндолацетата (рис., реакция 6).
Серотонин и 5-метокситриптамин окисляются в соответствующие кислоты моноаминоксидазой. Циркулирующий мелатонин захватывается всеми тканями, включая мозг, однако быстро подвергается гидроксилированию по положению 6 и затем конъюгирует с сульфатом (70%) и глюкуроновой кислотой (6%); часть его превращается в продукты неиндольной природы.
Индольные производные в моче
Триптофан может превращаться в различные индольные производные (рис.). Конечными продуктами этих превращений, экскретируемыми с мочой, являются в основном 5-гидроксииндолацетат, главный продукт гидрокситриптофан-серотонинового пути, и индол-3-ацетат, образующийся путем декарбоксилирования и окисления индолпирувата — кетокислоты, соответствующей триптофану.
Почки и печень млекопитающих, а также бактерии фекалий человека декарбоксилируют триптофан с образованием триптамина, который затем окисляется в индол-3-ацетат. Больные фенилкетонурией экскретируют с мочой повышенные количества индолацетата (а также индоллактата, образующегося в результате восстановления индолпирувата).
При блокировании нормальных путей катаболизма фенилаланина на первый план выходят несколько катаболических реакций, которые протекают в нормальной печени, но обычно имеют второстепенное значение. У больных фенилкетонурией в крови и моче появляются фенилпируват, фениллактат, фенилацетат и фенилацетилглутамин. Хотя присутствие фенилпирувата в моче больных фенилкетонурией может быть установлено путем простого биохимического анализа, для убедительного диагноза необходимо зарегистрировать повышение содержания фенилаланина в плазме крови. Прогрессирующее развитие нарушений умственного развития у детей, больных фенилкетонурией, можно предотвратить путем назначения диеты с очень низким содержанием фенилаланина. По достижении шестилетнего возраста эту диету можно отменить, поскольку к этому времени повышенные концентрации фенилаланина и его производных перестают оказывать неблагоприятное действие на мозг.
Содержание фенилаланина в плазме можно измерить с помощью автоматизированного микрометода, для которого требуются пробы крови не более 20 мкл. Следует отметить, что ненормально высокое содержание фенилаланина у детей, больных фенилкетонурией, обнаруживается лишь на третий или четвертый день жизни, поскольку они потребляют незначительное количество пищевого белка. Далее, у недоношенных детей можно получить ложную положительную реакцию в связи с замедленным образованием ряда ферментов метаболизма фенилаланина. Полезным, но не вполне надежным массовым тестом может служить обнаружение повышенного содержания фенилпирувата с моче с использованием в качестве реагента хлорида железа. После введения фенилаланина пациентам с фенилкетонурией содержание этой аминокислоты в крови долгое время остается высоким, что свидетельствует о снижении толерантности к фенилаланину. Вместе с тем ненормально низкая толерантность к введенному фенилаланину и повышенное содержание последнего в период между приемами пищи характерно также и для родителей, больных фенилкетонурией. Таким образом, дефектный ген, ответственный за фенилкетонурию, может быть выявлен и у фенотипически нормальных гетерозиготных родителей.
5-Гидрокситриптофан-декарбоксилаза, образующая серотонин из гидрокситриптофана, находится в почках (свинья, морская свинка), печени и желудке. Однако декарбоксилирование 5-гидрокситриптофана может осуществляться и более широко распространенной декарбоксилазой ароматических L-аминокислот.
Большая часть серотонина подвергается окислительному дезаминированию с образованием 5-гидроксииндолацетата. Ферментом, катализирующим эту реакцию, является моноамнноксидаза (рис., реакция 2). К числу ингибиторов этого фермента относится ипрониазид. Предполагают, что психическая стимуляция, наступающая после приема этого лекарства, обусловлена его способностью пролонгировать действие серотонина благодаря ингибированию моноаминоксидазы. В моче здорового человека в составе суточной порции экскретируется 2-8 мг 5-гидроксииндолацетата.
Образование серотонина значительно увеличивается при злокачественном карциноиде (аргентаффиноме). Это заболевание характеризуется распространением серотонин-образующих опухолевых клеток в аргентаффинной ткани брюшной полости. При карциноиде наблюдается нарушение метаболизма триптофана, в результате которого значительно большая, чем в норме, доля триптофана метаболизирует по пути образования гидроксииндола. В норме в серотонин превращается лишь 1% триптофана, а у пациентов с карциноидом 60%. Такое отклонение метаболизма от основного пути значительно снижает образование из триптофана никотиновой кислоты; в результате могут наблюдаться симптомы пеллагры, а также отрицательный азотистый баланс.
Другими метаболитами серотонина, идентифицированными в моче больных карциноидом, являются 5-гидроксииндолацетурат (конъюгат глицина и 5-гидроксииндолацетата) и конъюгат N-ацетил-серотонина с глюкуроновой кислотой.
Мелатонин
Мелатонин образуется из серотонина путем N-ацетилирования (рис., реакция 3) и последующего метилирования 5-гидроксильной группы (рис., реакция 4). Метилирование происходит в ткани шишковидной железы. Наряду с метилированием N-ацетилсеротонина происходит также прямое метилирование серотонина (рис., реакция 5) и его метаболита 5-гидроксииндолацетата (рис., реакция 6).
Серотонин и 5-метокситриптамин окисляются в соответствующие кислоты моноаминоксидазой. Циркулирующий мелатонин захватывается всеми тканями, включая мозг, однако быстро подвергается гидроксилированию по положению 6 и затем конъюгирует с сульфатом (70%) и глюкуроновой кислотой (6%); часть его превращается в продукты неиндольной природы.
Индольные производные в моче
Триптофан может превращаться в различные индольные производные (рис.). Конечными продуктами этих превращений, экскретируемыми с мочой, являются в основном 5-гидроксииндолацетат, главный продукт гидрокситриптофан-серотонинового пути, и индол-3-ацетат, образующийся путем декарбоксилирования и окисления индолпирувата — кетокислоты, соответствующей триптофану.
Почки и печень млекопитающих, а также бактерии фекалий человека декарбоксилируют триптофан с образованием триптамина, который затем окисляется в индол-3-ацетат. Больные фенилкетонурией экскретируют с мочой повышенные количества индолацетата (а также индоллактата, образующегося в результате восстановления индолпирувата).
При блокировании нормальных путей катаболизма фенилаланина на первый план выходят несколько катаболических реакций, которые протекают в нормальной печени, но обычно имеют второстепенное значение. У больных фенилкетонурией в крови и моче появляются фенилпируват, фениллактат, фенилацетат и фенилацетилглутамин. Хотя присутствие фенилпирувата в моче больных фенилкетонурией может быть установлено путем простого биохимического анализа, для убедительного диагноза необходимо зарегистрировать повышение содержания фенилаланина в плазме крови. Прогрессирующее развитие нарушений умственного развития у детей, больных фенилкетонурией, можно предотвратить путем назначения диеты с очень низким содержанием фенилаланина. По достижении шестилетнего возраста эту диету можно отменить, поскольку к этому времени повышенные концентрации фенилаланина и его производных перестают оказывать неблагоприятное действие на мозг.
Содержание фенилаланина в плазме можно измерить с помощью автоматизированного микрометода, для которого требуются пробы крови не более 20 мкл. Следует отметить, что ненормально высокое содержание фенилаланина у детей, больных фенилкетонурией, обнаруживается лишь на третий или четвертый день жизни, поскольку они потребляют незначительное количество пищевого белка. Далее, у недоношенных детей можно получить ложную положительную реакцию в связи с замедленным образованием ряда ферментов метаболизма фенилаланина. Полезным, но не вполне надежным массовым тестом может служить обнаружение повышенного содержания фенилпирувата с моче с использованием в качестве реагента хлорида железа. После введения фенилаланина пациентам с фенилкетонурией содержание этой аминокислоты в крови долгое время остается высоким, что свидетельствует о снижении толерантности к фенилаланину. Вместе с тем ненормально низкая толерантность к введенному фенилаланину и повышенное содержание последнего в период между приемами пищи характерно также и для родителей, больных фенилкетонурией. Таким образом, дефектный ген, ответственный за фенилкетонурию, может быть выявлен и у фенотипически нормальных гетерозиготных родителей.
|
|
|
|
|
|
|
Дата добавления: 2016-11-23; Мы поможем в написании ваших работ!; просмотров: 2016 | Нарушение авторских прав
Лучшие изречения: