Н
Н С Н
Сl
Індукційний ефект – взаємний вплив атомів у молекулі, в результаті якого змінюються властивості речовини. Оскільки хлор є більш електронегативним ніж атом карбону то електронна густина зміщується до атома хлору, тому зростає поляризація зв’язків С – Н, тому атоми гідрогену в молекулі хлорметану стають більш рухливими, та легше відриваються, заміщуючись на атоми хлору, ніж у молекулі метану.
Тема 4 Вуглеводні
Заняття 2. Ненасичені вуглеводні: Алкени, дієни, алкіни.
Мета: сформувати поняття про нові класи органічних сполук – ненасичені вуглеводні: алкени, алкіни, дієни; ознайомитись з природою кратних зв’язків та пов’язані з цим хімічними властивостями, продовжувати формувати вміння складати структурні формули за назвами речовин, називати речовини по міжнародній номенклатурі; розглянути нові види гібридизації атомних орбіта лей, будову ненасичених вуглеводнів та пов’язані з цим фізичні та хімічні властивості даних сполук; удосконалювати вміння складати рівняння хімічних реакцій за участі органічних речовин.
Навчальні питання:
1. Алкени,алкіни, дієни. Гомологічний ряд, загальна формула.
2. Будова молекули, фізичні і хімічні властивості. Правило Марковнікова, полімеризація.
3. Ізомерія та номенклатурні назви.
4. Добування та застосування
Полімери та полімеризація. Будова полімерного ланцюга.
5. Застосування та добування полімерів, пластмас.
Навчальна література:
1. Л-3 с.44-60, 63-64, 66-70
2. Л-4 с.61-68
ІІІ. Алкени.
| Визначення | Функціо- нальні групи | Загальна формула | Номенк- латурна назва | Види ізомерії | Будова | Застосування | Добування | Фізичні і Хімічні властивості |
| Ненасичені вуглеводні – вулгеводні в молекулах яких атоми карбону зв’язані між собою кратними (подвійними чи потрійними зв’язками) Алкени– це ненасичені вуглеводні з одним подвійним зв’язком. Полімери – речовини молекули яких (макромолекули) складаються з великої кількості груп атомів (структурних ланок) зв’язаних між собою хімічними зв’язками. | С = С | CnH2n | Нумерація починається з того краю де ближче знаходиться подвійний зв'язок,після кореня пишеться номер карбону з якого починається подвійний зв'язок,в кінці пишеться закінчення ен | 1.ізомерія карбонового ланцюга 2.ізомерія положення подвійного зв’язку 3. просторова ізомерія 4.міжкласова ізомерія з циклоалканами. | Два атоми Карбону, що приймають участь в утворенні подвійного зв’язку знаходяться в стані sр2– гібридизації. Тобто із чотирьох існуючих орбіта лей кожного атома вирівнюють ся лише три (одна s, та дві р орбіта лі), і одна р – орбіталь лишається не гібридизована (має форму гантелі). Три гібридизовані орбіта лі кожного атома карбону розташовуються у вигляді двох рівносторонніх трикутників на площині.
Однією вершиною ці трикутники перекриваються утворюючи δ-зв'язок інші орбіта лі утворюють δ- зв’язки з атомами гідрогенів
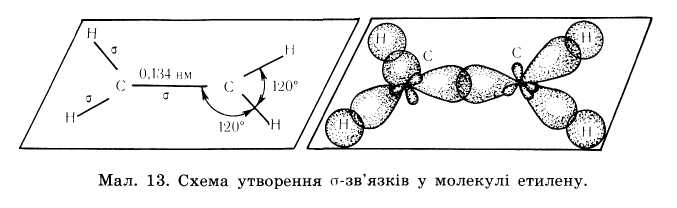 Не гібридизовані р-орбіталі обох атомів карбонів розташовуються перпендикулярно площині δ-звязків, перекриваються над і під площиною, утворюючи π – зв'язок. Отже подвійний зв'язок алкенів містить один δ-зв'язок і один π-зв'язок. δ-зв'язок міцніший ніж π-зв'язок.
Не гібридизовані р-орбіталі обох атомів карбонів розташовуються перпендикулярно площині δ-звязків, перекриваються над і під площиною, утворюючи π – зв'язок. Отже подвійний зв'язок алкенів містить один δ-зв'язок і один π-зв'язок. δ-зв'язок міцніший ніж π-зв'язок.
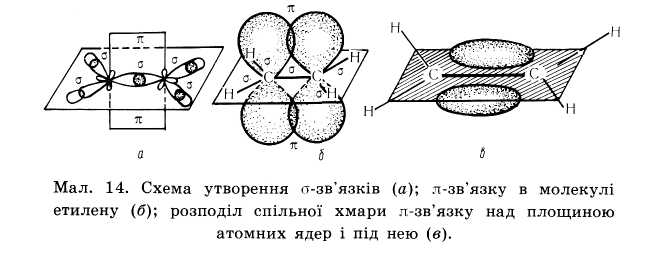
| 1.етилен використовують для органічного синтезу поліетилену, етанолу, хлор етану, вінілхлориду, стиролу. 2.етилен прискорює дозрівання фруктів. | 1. відщеплення галогенів від галогенопохідних алканів СН3-CHBr-CH2Br +Zn→CH3-CH=CH2+ ZnBr2 2.Відщеплення галогеноводнів CH3-CHCl-CH3+ NaOH →CH2=CH-CH3+ NaCl +H2O 3.відщеплення води (дегідратація) CH3-CHOH-CH2-CH3 → CH2=CH-CH2-CH3 +H2O 4.відщеплення водню від алканів (дегідрогенування) CH3-CH2-CH2-CH3 → CH3-CH=CH-CH3 +H2 5. крекінг алканів C8H18 →C4H10+C4H8 6. часткова гідрогенізація алкінів. CHΞCH+H2→CH2=CH2 | C2Н4– С5Н10 -гази, С6Н12 – С14Н28 –рідини, С15Н30 і вище –тверді речовини. Вони практично не розчинні у воді і частково розчинні у спиртах. 1. Реакція приєднання – характерна для всіх ненасичених вуглеводнів А) приєднання водню C2H4+H2→C2H6 Б) приєднання галогенів C2H4+Cl2 →C2H4Cl2 В) приєднання води C2H4+H2O →C2H5OH Г) приєднання галоген оводнів правило Марковнікова: Гідроген приєднується до більш гідрогенізованого атома карбону CH3-CH=CH2 +HCl →CH3-CHCl-CH3 2.окиснення: А) повне окиснення (горіння) C2H4+3O2→2 CO2 +2H2O Б) часткове окиснення – знебарвлення розчину марганцівки – якісна реакція на ненасичені вуглеводні. 3C2H4+2KMnO4+4H2O → 2MnO2+3CH2OH-CH2OH +2KOH 3. полімеризація – послідовне сполучення однакових молекул у більші за розміром (полімери) CH2=CH2+ CH2=CH2 +CH2=CH2→ -CH2-CH2-CH2-CH2-CH2-CH2- → (-CH2-CH2-)n ,n – ступінь полімеризації |
| Гомологічний ряд | ||||||||
| С2Н4 – етен (етилен) С3Н6 – пропен С4Н8 – бутен С5Н10 – пентен С6Н12 – гексен С7Н14 – гептен С8Н16 – октен С9Н18 – нонен С10Н20 - декен |
Будова молекули етилену


|

Приклади назв алкенів по міжнародній номенклатурі
СН3
С6Н3 – С5 – С4Н2 – С3Н = С2Н– С1Н3 С1Н2 = С2Н – С3Н2 – С4Н2 – С5Н – СН3
СН3 С6Н2 – С7Н3
5,5 –диметилгекс-2-ен 5-метилгепт-1-ен.
ІV.Алкіни
| Визначення | Функціо- нальні групи | Загальна формула | Номенк- латурна назва | Види ізомерії | Будова | Застосування | Добування | Фізичні і Хімічні властивості |
| Алкіни– це ненасичені вуглеводні з одним потрійним зв’язком | С Ξ С | СnH2n-2 | Нумерація починається з того краю де ближче знаходиться потрійний зв'язок,після кореня пишеться номер карбону з якого починається потрійно зв'язок,в кінці пишеться закінчення ин | 1.ізомерія карбонового ланцюга 2.ізомерія положення потрійного зв’язку 3.міжкласова ізомерія з дієнами | Два атоми Карбону, що приймають участь в утворенні потрійного зв’язку знаходяться в стані sр– гібридизації. Тобто із чотирьох існуючих орбіта лей кожного атома вирівнюють ся лише дві(одна s, та одна р-орбіта лі), і дві р – орбіталі лишаються не гібридизовані (мають форму гантелі). Дві гібридизовані орбіта лі кожного атома карбону розташовуються у вигляді двох прямих ліній на площині.
Однією вершиною ці лінії перекриваються утворюючи δ-зв'язок інші орбіта лі утворюють δ- зв’язки з атомами гідрогенів
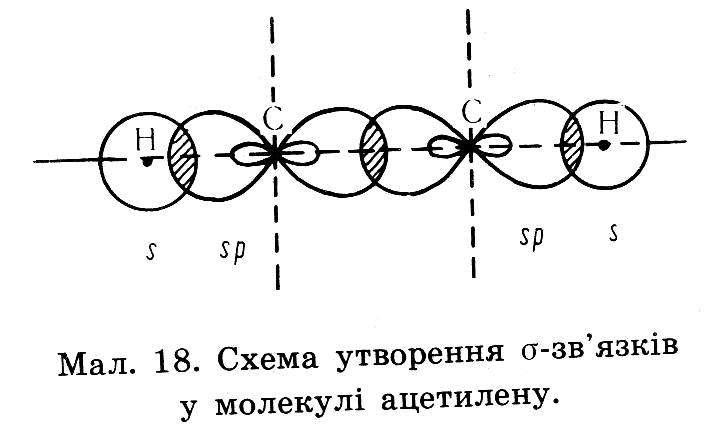 Не гібридизовані р-орбіталі обох атомів карбонів розташовуються перпендикулярно один одному утворюючи два π – зв'язок на двох взаємоперпендикулярних площинах, на перетині цих площин розташовується δ-звязок Отже потрійний зв'язок алкінів містить один δ-зв'язок і два π-зв'язка. δ-зв'язок міцніший ніж π-зв'язок.
Не гібридизовані р-орбіталі обох атомів карбонів розташовуються перпендикулярно один одному утворюючи два π – зв'язок на двох взаємоперпендикулярних площинах, на перетині цих площин розташовується δ-звязок Отже потрійний зв'язок алкінів містить один δ-зв'язок і два π-зв'язка. δ-зв'язок міцніший ніж π-зв'язок.
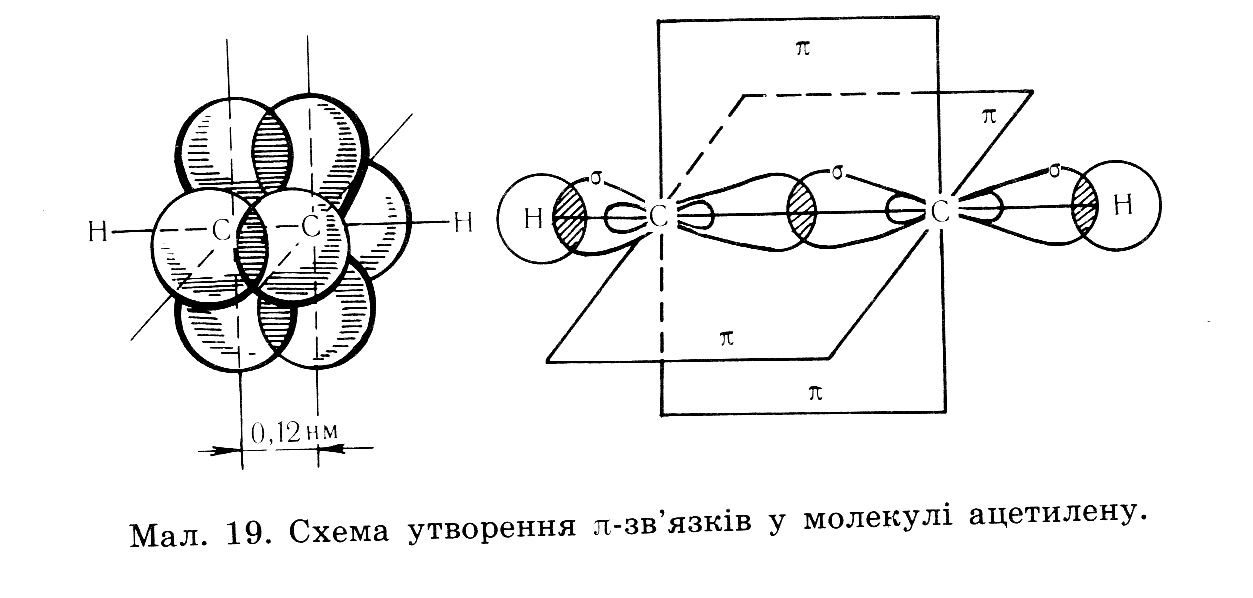
| 1.сировина для синтезу оцтової кислоти, синтетичного каучуку, хлорвінілових і поліхлорвінілових пластмас. 2. виплавляння скла 3.зварювання та різання металів. | 1. крекінг метану, при температурі 1500 0С 2СН4→С2Н2 +3Н2 2.карбідний метод СаС2 +2Н2О → С2Н2+Са(ОН)2 | 1. Реакція приєднання – характерна для всіх ненасичених вуглеводнів А) приєднання водню C2H2+H2→C2H4 C2H2+2H2→C2H6 Б) приєднання галогенів C2H2+2Cl2 →C2H4Cl4 В) приєднання води. Реакція Кучерова, відбувається в присутності каталізатора – солей ртуті C2H2+H2O →СН3СНО Г) приєднання галогеноводнів правило Марковнікова: Гідроген приєднується до більш гідрогенізованого атома карбону CH3-CΞCH +2HCl →CH3-CCl2-CH3 2.окиснення: А) повне окиснення (горіння) 2C2H2+5O2→4CO2 +2H2O Б) часткове окиснення – знебарвлення розчину марганцівки – якісна реакція на ненасичені вуглеводні. 3C2H2+8KMnO4→ 8MnO2+ 3CОOК-CОOК+2KOH +2Н2О 3.димеризація 2С2Н2→ СН2=СН-СΞСН 4.тримеризація |
| Гомологічний ряд | ||||||||
| С2Н2 – етин (ацетилен) С3Н4 – пропин С4Н6– бутин С5Н8 – пентин С6Н10 – гексин С7Н12 – гептин С8Н14 – октин С9Н16 – нонин С10Н18 - декин |






