1. Какие процессы можно выделить при растворении веществ?
2. Какие значения принимает энтальпия растворения вещества? Как изменяется энтальпия при растворении газов? Твердых веществ?
3. Как необходимо изменить температуру, чтобы увеличить растворимость газообразного вещества? твердого вещества?
4. Как изменяется растворимость газов при увеличении давления?
5. Что называют произведением растворимости?
6. Какие вещества относят к растворимым? К малорастворимым?
7. К раствору нитрата серебра одновременно прилили растворы хлорида натрия, иодида натрия и сульфида натрия (ПРАgCl = 1,78·10-10; ПРАgI = 8,3·10-17; ПРАg  S = 2·10-50). В какой последовательности будут выпадать осадки? Какая из образующихся солей менее растворима? Более растворима?
S = 2·10-50). В какой последовательности будут выпадать осадки? Какая из образующихся солей менее растворима? Более растворима?
8. Что произойдет при добавлении к насыщенному водному раствору хлорида серебра раствора нитрата серебра?
9. Выразите произведение растворимости фосфата серебра Аg3РО4. Как связана величина ПР этого вещества с его растворимостью?
Укажите взаимосвязь между произведением растворимости (ПР) и изменением энергии Гиббса (∆G).
11. Растворимость соли А3В2 равна 1·10-3 моль/л. Вычислите ПР.
12. ПР соли АВ3 равно 3·10-26. Вычислите ее растворимость.
13. Чтобы осадить соль АВ (ПРАВ = 2·10-10) из 2·10-4 М раствора соли АС необходимо добавить соль ДВ. Какая концентрация при этом должна быть у раствора соли ДВ, если прилить равные объемы солей АС и ДВ друг к другу?
Гидролиз
- Что называют гидролизом?
- Какие типы гидролиза существуют?
- В каком случае гидролиз протекает по аниону? По катиону? По аниону и по катиону? Не протекает? Какой характер среды будет в растворе в зависимости от типа гидролиза?
- Определите типы гидролиза следующих солей: ZnCl2, CuSO4, Al2S3, CsCl. Какие соли гидролизуются по первой ступени; не гидролизуются; гидролизуются полностью? Напишите молекулярные и ионные уравнения.
- Перечислите количественные характеристики гидролиза.
- Что называют степенью гидролиза? От каких факторов зависит степень гидролиза?
- Как изменится степень гидролиза соли при увеличении ее концентрации в растворе? При повышении температуры?
- В каком случае при смешении перечисленных ниже растворов оснований и кислот в эквивалентных количествах раствор будет иметь нейтральную; кислую; основную реакции: а) Zn(OH)2 + HСl; б) Zn(OH)2 + НСN; в) NaOH + HСl; г) NaOH + НСN?
Диссоциация
- Какие вещества называют электролитами?
- Что называют диссоциацией?
- Напишите уравнения полной диссоциации сернистой кислоты Н2SО3; диссоциации этой кислоты по первой и второй ступеням.
- Напишите уравнения полной диссоциации гидроксида бария Ва(ОН)2; диссоциации этого основания по первой и второй ступеням.
- Что называют степенью диссоциации? Изотоническим коэффициентом? Что показывают это величины? Какая взаимосвязь существует между изотоническим коэффициентом и степенью диссоциации?
- Какие электролиты относят к сильным? Слабым?
- Запишите математические выражения законов Рауля и Вант-Гоффа для растворов электролитов.
- Что называют константой равновесия?
- Сформулируйте и математически запишите закон разведения Оствальда.
- Как связаны между собой константа и степень диссоциации для слабых электролитов? Сильных электролитов?
- Сколько молей ионов образуется при диссоциации 1 моль фосфата кальция Са3(РО4)2?
- Константа диссоциации слабого однокислотного основания равна 6•10-4. Вычислите концентрацию гидроксид-ионов в 0,01 N растворе этого основания.
Ионное произведение
1. Что называют ионным произведение воды? Чему оно численно равно при 298 К?
2. Чему равны концентрации ионов водорода и гидроксид-ионов (в моль/л) в химически чистой воде?
3. Что называют водородным показателем среды? Гидроксидным показателем среды?
4. Какие значения принимает рН в кислых, нейтральных, основных средах?
5. Как изменяется рН при разбавлении растворов кислот? Растворов оснований? Буферных растворов?
6. Чему равна концентрация раствора (моль/л) гидроксида калия, если рН раствора равен 12?
7. Чему равна концентрация раствора (моль/л) гидроксида стронция, если рН раствора равен 12?
8. Чему равна концентрация раствора (моль/л) соляной кислоты, если рН раствора равен 2?
9. Чему равна концентрация раствора (моль/л) серной кислоты, если рН раствора равен 1,5?
10. Чему равен рН 0,05 М водного раствора серной кислоты? Гидроксида натрия?
11. Какие растворы называют буферными? Приведите примеры.
Коррозия металлов
1. Химическая коррозия протекает в среде: (тип среды)
2. Влажная атмосферная коррозия является: (тип коррозии)
3. Электрохимическая коррозия возможна в: (тип раствора)
4. Электрохимическая коррозия стали идет быстрее в воде, содержащей соли: цинка, бария, цезия
5. Более устойчив алюминий в растворе: щелочи, кислоты, воды с растворенным кислородом
6. Как ведет себя алюминий в высококонцентрированной азотной кислоте?
7. Как изменится скорость коррозии при загрязнение поверхности алюминия благородными металлами?
8. Чем объясняется неустойчивость меди и медных сплавов в аммиачных растворах?
9. Скорость коррозии цинка выше: во влажном воздухе; в воде, содержащей углекислый газ; сухой атмосфере; воде, содержащей кислород
10. Более устойчив к коррозии алюминий, содержащий примесь: магния, никеля, серебра, кобальта
11. Для предотвращения коррозии сталей и сплавов при высоких температурах применяют: (тип защиты)
12. Под действием электрического тока коррозионный процесс происходит: (на катоде или на аноде)
13. Быстрее всего стальные конструкции корродируют в среде: (рН среды)
14. Электрокоррозией называют коррозию под действием:
15. При избирательной коррозии в окисленное состояние переходит ----- металл: (более или менее активный)
16. Коррозия стали в почве является: (тип коррозии)
17. Наиболее коррозионноопасной для стальной конструкции является вода, содержащая растворенный: хлорид натрия, бром, сульфид натрия, раствор аммиака
18. Электрохимическая коррозия протекает в: нефти, кислоте, этаноле
19. Химическая коррозия протекает в растворе: соляной кислоты, брома в эфире, СО2 в воде
20. Что такое оксидирование?
21. Химическая коррозия протекает в среде: хлороводород (газ), хлороводород (раствор в воде), бром (раствор в воде)
22. Сплав меди с цинком называется латунью. Что происходит при коррозии латуни?
23. Менее опасным с точки зрения коррозии железа является раствор, рН которого: 2, 4, 7, 10
24. Наиболее интенсивно коррозия железа протекает в растворе, содержащем: хлорид натрия, фосфат калия, хлорид цинка
25. Чем объясняется значительная стойкость алюминия к коррозии?
26. Для защиты стальной конструкции от коррозии на ее поверхности следует закрепить пластину: магниевую, кобальтовую, из висмута
27. Для защиты металлов от коррозии наносят металлические покрытия. В случае
нарушения целостности покрытия оловянного стального изделия происходит:
28. На поверхности закисленной почвы садового участка находятся железные трубы с никелевыми кранами. Коррозии будет подвергаться:
29. Катодно хром поляризуется в контакте с: цинком, серебром, алюминием
30. Медь поляризуется анодно в контакте с: цинком, железом, золотом
31. Коррозия олова с водородной деполяризацией возможна в растворе с рН: 3, 7,12
32. Коррозия железа с водородной деполяризацией возможна в растворе с рН: 5, 7, 11
33. Быстрее всего железо будет корродировать в контакте с: алюминием, серебром, медью
34. Что такое легирование? Каково его назначение?
35. В качестве протектора для защиты медной конструкции от коррозии можно использовать: серебро, никель, смолу
36. С какой целью используют ингибиторы?
37. Какие покрытия называют катодными?
38. Какие покрытия называют анодными?
39. Протектором для защиты стальной конструкции от коррозии может быть: платина, хром, никель
40. Коррозионноопасными называют покрытия металлами, потенциал которых (больше, меньше, равны) потенциала основного металла
41. Покрытие железа кобальтом является коррозионноопасным, так как: это покрытие анодное, кобальт вообще не защищает от коррозии, это покрытие катодное, никель быстро окисляется
42. Для защиты стальной конструкции от коррозии в качестве протектора использовали магний. Анодный процесс при коррозии такой системы в кислой среде представляет собой: Fe - 2ē → Fe2+, Н2О - 2ē → ½ О2 + 2 Н+, 2Н+ + 2ē → Н2,Mg - 2ē → Mg2+
43 Как достигается катодная защита металлов от коррозии?
44. Электрохимическая коррозия металла возможна при условии, что потенциалокислителя (больше, меньше, равен) потенциала металла:
45. Как изменяется скорость катодного процесса при коррозии с водородной деполяризацией с уменьшением величины рН?
46. Как изменяется скорость катодного процесса при коррозии металлов в кислой среде с увеличением водородного перенапряжения?
47. Как изменяется скорость коррозионного процесса в нейтральной среде с кислородной деполяризацией при повышении температуры выше 80 °С?
49. Катодный процесс с кислородной деполяризацией при коррозии в нейтральной среде представляет собой: 2Н2О + 2ē → Н2 + 2ОН-, 2Н2О - 4ē → О2 + 4Н+, О2 + 4Н+ + 4ē → 2Н2О, О2 + 2Н2О + 4ē → 4ОН-
50. Присутствие ионов хлора в коррозионной среде ускоряет коррозию, так как: затрудняется переход ионов металла в раствор, ионы хлора активируют пассиваторы, ионы хлора активируют ингибиторы, хлориды металлов легко растворяются.
51. Что является лимитирующей стадией коррозионного процесса, идущего с кислородной деполяризацией?
52. Что представляет собой анодный процесс коррозии контакта Sn / Ag, протекающей с водородной деполяризацией?
53. Стальная деталь покрыта оловом. Что представляет собой анодный процесс коррозии в кислой среде при нарушении целостности покрытия?
54. В щелочной среде в присутствии кислорода возможна коррозия: серебра, меди, ртути, платины
55. В нейтральной среде в отсутствии кислорода термодинамически устойчив: магний, алюминий, олово, цинк
56. В нейтральной среде в отсутствии кислорода термодинамически неустойчив: медь, хром, никель, серебро
Электролиз
1. Что происходит на электроде, который присоединен к положительному полюсу внешнего источника постоянного электрического тока, при электролизе?
2. Что происходит на электроде, который присоединен к отрицательному полюсу внешнего источника постоянного электрического тока, при электролизе?
3. Что происходит с потенциалом катодного процесса вследствие катодной поляризации?
4. Что происходит с потенциалом анодного процесса вследствие анодной поляризации?
5. Для осуществления процесса электролиза внешнее напряжение должно быть (больше, меньше, равно) разности равновесных потенциалов электродов:
6. Вследствие водородного перенапряжения при электролизе водных растворов
соответствующих соединений на катоде можно выделить: калий, хром, магний, серебро
7. В каком случае при электролизе водных растворов соединений хрома возможно восстановление ионов хрома на катоде?
8. На аноде осуществляется процесс отдачи электронов восстановителем. С каким потенциалом легче окисляются такие частицы?
9. Металлический анод может быть нерастворимым вследствие высокой анодной поляризации. Что является её причиной?
10. Чем объясняется выделение хлора на аноде при электролизе водных растворов хлоридов?
11. Что образуется на нерастворимом аноде при электролизе водных растворов нитратов?
12. Чем определяется последовательность электродных процессов при электролизе?
13. Что происходит на катоде при электролизе подкисленного водного раствора соли никеля при стандартных концентрациях?
14. Что является продуктом электролиза водного раствора фосфата калия на катоде?
15. Что получают электролизом водного раствора фосфата калия на аноде?
16. Что происходит при электролизе водного раствора сульфита калия на медном аноде?
17. Какой становится среда раствора в катодном пространстве в результате электролиза раствора фосфата калия с использованием инертных электродов?
18. Как изменяется концентрация соли в растворе в результате электролиза раствора сульфита натрия с использованием инертных электродов?
19. Как изменяется концентрация раствора при электролизе нитрата хрома с использованием медных электродов?
20. Что происходит при электролизе водного раствора фторида натрия на аноде?
21. В результате электролиза водного раствора соли среда раствора в катодном пространстве стала щелочной. Какой из растворов подвергался электролизу: нитрат серебра, сульфат меди, хлорид магния?
22. В результате электролиза водного раствора соли среда раствора а анодном пространстве стала кислой. Какой из растворов подвергался электролизу: сульфид калия, фосфат натрия, фторид натрия?
23. Как изменяется при электролизе водного раствора сульфида висмута концентрация соли в растворе с течением времени?
24. Как изменяется при электролизе водного раствора нитрата магния концентрация соли в растворе с течением времени?
25. Как изменяется при электролизе водного раствора нитрата кальция с использованием медных электродов концентрация соли в растворе с течением времени?
26. Как изменяется в результате электролиза водного раствора сульфата цинка с использованием инертных электродов величина рН раствора?
27. Как изменяется в результате электролиза водного раствора сульфата меди с использованием серебряных электродов величина рН раствора?
28. В какой последовательности при электролизе водного раствора, содержащего NaCl, FeSO4, K2S, NaI, будет происходить разрядка анионов?
29. В какой последовательности при электролизе водного раствора, содержащего Na2SO4, Cr(NO3)3, FeCl2, NiSO4 в одинаковых концентрациях, будет происходить разрядка ионов на катоде?
30. В какой последовательности при электролизе расплава смеси, содержащей одинаковые количества сульфата магния, иодида натрия и хлорида меди, будет происходить разрядка ионов на аноде?
31. Какой процесс происходит при электролизе раствора хлорида железа на медном аноде?
32. Какой процесс происходит при электролизе расплава сульфата калия на инертном аноде?
33. Можно ли электролизом водного раствора сульфата цинка получить металлический цинк?
34. Можно ли электролизом водного раствора сульфата калия получить металлический калий?
35. Что образуется в электролитической ванне при электролизе водного раствора сульфида натрия с инертными электродами?
36. Как наносят металлические покрытия гальваническим способом?
37. Сколько вещества образуется при пропускании через электролит 0,01 F электричества?
38. Какое количество электричества необходимо пропустить через электролит, чтобы электролизом получить 98 г серной кислоты?
39. Какие вещества и в каком количестве образуются на электродах при электролизе расплава хлорида магния, если пропустили 96500 Кл электричества?
40. Сколько электричества необходимо пропустить через электролит, чтобы электролизом получить 56 л Н2 (ну)?
41. Сколько электричества необходимо пропустить через электролит, чтобы электролизом получить 22,4 л О2 (ну)?
42. В течение какого времени необходимо проводить электролиз раствора CuSO4 током силой 2 А, чтобы на катоде получить 12,8 г Cu?
43. При пропускании через раствор нитрата алюминия некоторого количества электричества было получено 20 л Н2 (н.у). Что и в каком количестве выделилось на аноде?
44. Какие вещества и в каком количестве можно получить на электродах за 90 минут электролизом раствора иодида калия током силой 12 А?
45. В течение какого времени нужно пропускать через электролит ток силой 8 А, чтобы электролизом получить 200 г гидрокида натрия?
46. На получение 200 л кислорода (н.у) методом электролиза затрачено 8,6 кВт час электроэнергии. Сколько вольт составило напряжение на клеммах?
47. Сколько железа методом электролиза раствора FeCl2 можно получить, затратив 6 кВт час электроэнергии при напряжении 12 В?
48. За какое время методом электролиза, используя ток силой 8 А, всю медь, содержащуюся в 500 мл 0,1 н раствора CuSO4, можно выделить на катоде?
49. С чем связана электрохимическая поляризация электродов?
50. Водородное перенапряжение на цинковом электроде составляет 0,7 В. Чему будет равен потенциал выделения водорода на цинковом катоде при электролизе нейтрального раствора?
51. Кислородное перенапряжение на кадмиевом электроде составляет 0,4 В. Чему будет равен потенциал выделения кислорода на кадмиевом аноде при электролизе нейтрального раствора?
52. Как можно снизить концентрационную поляризацию медного анода при электролизе?
53. При электрохимической очистке железа током 7 А за 4 часа на катоде получили 24,87 г чистого железа. Чему равен выход по току?
54. Чем определяется выход по току?
Гальванические элементы
1. Что называют гальваническими элементами?
2. Что называют анодом в электрохимии?
3. Что называют катодом в электрохимии?
4. Как возникает в гальваническом элементе напряжение между катодом и анодом?
5. Чему равен потенциал стандартного водородного электрода?
6. Относительно какого электрода определяют стандартные окислительно-восстановительные потенциалы?
7. Потенциал анодом в гальваническом элементе (больше, меньше, равен) потенциала катода?
8. Каким уравнением или законом описывается зависимость величины потенциала металлического электрода от концентрации его ионов в растворе?
9. Сравните электродный потенциал никеля в растворе его соли с концентрацией 0,001 моль/л с его стандартным электродным потенциалом.
10. Как изменяется потенциал металлического электрода с уменьшением концентрации ионов металла в растворе?
11. Как изменяется с увеличением рН раствора потенциал водородного электрода?
12. Чему равен потенциал водородного электрода при рН раствора, равном 8?
13. Как изменится потенциал электрода Fe / Fe2+ при пропускании через раствор сероводорода?
14. Как изменится потенциал стандартного никелевого электрода при разбавлении раствора, в который он погружен, в пять раз?
15. Как изменится потенциал стандартного алюминиевого электрода при замене электролита на 0,05 молярный раствор?
16. При какой концентрации ионов Fe2+ потенциал железного электрода равен -0,5 В?
17. Чему равен электродный потенциал цинка в 0,0016 М растворе Zn(NO3)2?
18. Потенциал водородного электрода равен - 0,452 В. Чему равен рН раствора, в который он погружен?
19. Степень диссоциации Cu(NO3)2 в 1 М растворе равна 0,83. Чему равен потенциал медного электрода (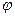 0 = 0,34 В) в этом растворе?
0 = 0,34 В) в этом растворе?
20. Составьте схему кобальт-кадмиевого гальванического элемента
21. Напишите анодный процесс, который протекает при работе гальванического элемента, составленного из стандартных магниевого и титанового электродов
22. Напишите катодный процесс, который протекает при работе гальванического элемента Pt, H2 / HNO3 // ZnSO4 / Zn при стандартных концентрациях электролитов
23. Напишите катодный процесс, который протекает при работе гальванического элемента, составленного из водородного электрода, погруженного в раствор с рН =12, и стандартного оловяного электрода
24. Алюминиевая и серебряная пластины соединены внешним проводником и погружены в раствор соляной кислоты. Составьте анодный и катодный процессы такого гальванического элемента
25. Составьте суммарная реакцию при работе гальванического элемента из стандартных железного и медного электродов
26. Какую реакцию называют токообразующей в гальваническом элементе?
27. Как определить ЭДС гальванического элемента?
28. Как изменится ЭДС гальванического элемента Mg / MgSO4 // FeSO4 / Fe при уменьшении концентрации FeSO4?
29. Как изменится ЭДС гальванического элемента, составленного из водородного и стандартного серебряного электродов при увеличении рН раствора соляной кислоты?
30. Рассчитайте ЭДС гальванического цинк-свинцового элемента при использовании 0,01 молярных растворов
31. Составьте концентрационный никель-никелевый гальванический элемент
32. Как изменится ЭДС кобальт-серебряного гальванического элемента при уменьшении концентрации ионов кобальта и серебра в 3 раза?
33. В каком случае будет работать гальванический элемент, электроды которого сделаны из одного и того же металла?
34. ЭДС гальванического элемента, составленного из никелевого электрода и стандартного железного электрода, погруженного в раствор FeSO4, равна нулю ( = - 0,25 В,
= - 0,25 В,  = - 0,44 В). Чему равна концентрация ионов никеля в растворе?
= - 0,44 В). Чему равна концентрация ионов никеля в растворе?
35. Серебряная и никелевая пластины соединены внешним проводником и погружены в раствор соляной кислоты. Какой газ и на какой пластине выделится через некоторое время?
36. Сравните напряжение на клеммах гальванического элемента и ЭДС






