БИОХИМИЯ СЛОЖНЫХ БЕЛКОВ
План
1. Понятие о сложных белках, простетических группах. Классификация сложных белков.
2. Биохимия гликопротеинов, их структура и функции в организме.
3. Биохимия фосфопротеинов, их структура и функции в организме.
4. Биохимия хромопротеинов, их структура и функции в организме.
5. Биохимия нуклеопротеинов, их структура и функции в организме.
6. Биохимия липопротеинов, структура и функции в организме.
1. Сложные белки или протеиды состоят в отличие от простых из белковой части и небелковой, которая называется простетической группой.
Классифицируют сложные белки в зависимости от простетической группы. Названия складываются миз названия простетической группы и слова «протеин». Если простетическая группа:
– углевод – гликопротеин;
– остаток фосфорной кислоты – фосфопротеин;
– нуклеиновые кислоты – нуклеопротеин (РНК – рибонуклеопротеины, ДНК – дезоксирибонуклеопротеины).
Характеризовать сложный белок по следующей схеме:
1. название белка и его функция в организме;
2. охарактеризовать белковую часть: особенности состава и строения;
3. охарактеризовать небелковую часть;
4. охарактеризовать связи, которыми соединяются белковая и небелковая части.
1. Гликопротеины – сложные белки, простетической группой которых являются различные углеводы и их производные. Примером гликопротеинов являются: транспортные белки (трансферритин, транскортин, гаптоглобин и др.), факторы свертывания крови (протромбин, фибриноген), иммуноглобулины, ферменты (рибонуклеаза В, холинэстераза), гормоны (тиротропин, гонадотропин и др.) Клеточные гликопротеины, находящиеся на поверхности мембран, обеспечивают специфичность межклеточных контактов, влияют на дифференцировку тканей.
Особое внимание следует уделить строению и функциям коллагена. Это самый распространенный белок в организме человека; на его долю приходится примерно 1/3 от общего количества белков. Структура коллагена придает тканям следующие функции: механическую прочность и нерастяжимость. Сухожилия, которыми мышцы прикрепляются к костям, состоят в основном из волокон коллагена, которые, переплетаясь, крест-накрест, образуют нерастяжимую и очень прочную на разрыв структуру. Аналогичные структуры являются основой кожи, вообще соединительной ткани, органического матрикса костей, зубов.
Коллаген – сложный белок, гликопротеин: белковая часть представлена тремя левозакрученными спиралями в свою очередь закрученные в правую спираль.

Рис.1 Строение молекулы коллагена (а) и схема укладки молекул в коллагеновых фибриллах (б).
Особенности состава коллагенов:
1. каждая третья аминокислоты – глицин;
2. содержится редкие аминокислоты гидроксипролин (только в коллагене) и гидроксилизин (очень редкая);
Небелковая часть коллагена – углеводный компонент – моносахаридные (галактоза) и дисахаридные (галактоза+глюкоза) остатки.
Углеводные компоненты связаны с белковой частью по гидроксильным остаткам некоторых остатков гидроксилизина (гликозидные связи).
2. Фосфопротеины – сложные белки, содержащие в качестве небелковой части остатки фосфорной кислоты (0,5-0,9 %). Например, казеиноген (казеин) молока является полноценным белком, содержащим все незаменимые аминокислоты, выполняет питательную функцию. В молоке он связан не только с остатками фосфорной кислоты, но и с ионами кальция (кальций и фосфор находятся в физиологически оптимальном соотношении, поэтому они хорошо усваиваются).
Простетическая группа связана с белковой частью эфирной связью через ОН-группы остатков серина и треонина.
3. Нуклеопротеины – сложные белки, которые в качестве простетической группы содержат нуклеиновые кислоты: а) ДНК и б) РНК.
а) простетическая группа ДНК – белок называется дезоксирибонуклеопротиен. Пример, структурная единица хроматина – нуклеосома – обеспечивает ультракомпактность упаковки ДНК.
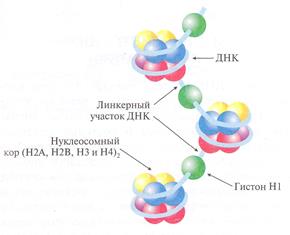
Белковая часть представлена гистонами. Это небольшие белки с высоким содержанием лизина и аргинина. По относительному содержанию лизина и аргинина их делят на пять типов: Н1, Н2А, Н2В, Н3 и Н4. каждая нуклеосома состоит из четырех пар молекул гистонов – 2 Н2А, 2 Н2В, 2Н3, 2Н4, обвитые снаружи суперспиралью ДНК со 150 оснований.
Положительнозаряженные группы лизина и аргинина белковой части взаимодействуют с отрицательнозаряженными группами остатков фосфорной кислоты ДНК.
Между нуклеосомами находиться участок ДНК (30 пар оснований) – линкерный участок, которая связана лишь с одной молекулой белка Н1.
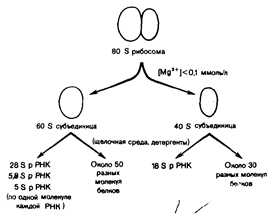
б) Простетическая группа РНК – рубонуклеопротеины. Пример, рибосома эукариот.
Рибосма состоит из двух субъединиц – большой и малой. Белковая часть большой субъединицы представлена около 50 молекул различных белков, небелковая – тремя молекулами РНК (двух «легкой» и одной «тяжелой»). Белковая часть малой субъединицы представлена 33 белками и одной «средней» молекулой РНК.
Рибосома устройство для биосинтезе белка
.
4. Липотпротеины – в следующем семестре.
5. Хромопротеины – являются сложными белками, простетическая группой которых представлена окрашенными соединениями небелковой природы, откуда и возникло их название (от греч.chroma- краска). Окрашенная группа хромопротеинов может принадлежать к разным классам органических соединений: порфиринам, каротиноидам, производным витаминов и др.
Важнейшую группу хромопротеинов составляют так называемые гемопротеины: миоглобин, гемоглобин и ряд окислительно-восстановительных ферментов. Гемопротеины состоят из различных простых белков и небелковой части – гем.
Гемоглобин является сложным белком хромопротеином, состоит из простого белка глобина и небелковой части: четырех молекул гема. Гемоглобин проявляет свойства как белка, так и гема, но объединившись, смешанная молекула приобретает новые качества – дыхательную функцию, которая отдельно в глобине и геме находится только в зачаточном состоянии. Гемоголобин обеспечивает перенос кислорода от легких в ткани и удаление диоксида углерода из тканей.
Молекула гемоглобина состоит из четырех субъединичных глобул (протомеров). Например гемоглобин А (основной гемоглобин человека) состоит из двух одинаковых субъединиц a (по 141 аминокислотному остатку) и двух идентичных единиц b (по 146 остатков). Его субъединичная формула-a2 b2, м.м. 64500. У человека, кроме того обнаружены: гемоглобин a2 e2 - в зародыше человека; гемоглобин F (a2 g2 ) – гемоглобин плода человека, а так же в небольших количествах другие гемоглобины. Как видно протомеры a являются общими для всех гемоглобинов человека.
Четыре протомера располагаются в виде тетраэдра.
 рис.3 Схема четвертичной структуры молекулы гемоглобина. Заштрихованные области – места контактов a - и b- протомеров, зачерненные области – места расположения гемов, жирными линиями показаны «солевые мостики», существующие в дезоксигемоглобине. В центре небольшая полость.
рис.3 Схема четвертичной структуры молекулы гемоглобина. Заштрихованные области – места контактов a - и b- протомеров, зачерненные области – места расположения гемов, жирными линиями показаны «солевые мостики», существующие в дезоксигемоглобине. В центре небольшая полость.
Постоянная связь между протомерами обеспечивается гидрофобными взаимодействиями. Каждый a-протомер имеет хороший контакт с обоими b- протомерами. Между идентичными протомерами контакт слабее. Молекула гемоглобина легко диссоциирует на две ab-половинки. Взаимодействия между a и b¢ и между a¢ и b существенно более слабые, чем взаимодействие между a и b, а так же между a¢ и b¢.Каждый протомер содержит гем, находящийся в гидрофобной «нише», что защищает его от окисления в ферриформу. Молекула гемоглобина, таким образом содержит 4 гема. Каждый гемм содержит атом Fe+2 , к которому присоединяется одна молекула кислорода.
Гемогруппы располагаются на внешней стороне протомеров. Расстояния между ними довольно велики 2,5 нм. Молекула гемоглобина существует в двух формах: «напряженной» (Т) и «релаксированной» (R). Первая характерна для дезоксигемоглобина, вторая - для оксигемоглобина. Т- форма более жесткая, в отличие от R-формы она имеет 8 солевых мостиков:
1. Четыре солевых мостика между a-протомерами.
2. Два солевых мостика между разными протомерами: между a и b¢ и между a¢ и b.
3. По одному солевому мостику внутри каждого b-протомера.
В образовании четырех солевых мостиков участвуют С-концевые карбоксильные группы и боковые аминогруппы четырех лизинов, находящихся внутри a-цепей. В образовании других четырех солевых мостиков участвуют боковые карбоксильные группы четырех аспарагиновых кислот, с одной стороны, и боковые группы двух аргининов и двух гистидинов - с другой. При присоединении кислорода солевые мостики разрушаются, и Т-форма переходит в более компактную форму.
Строение одного протомера.
Каждый протомер имеет белковую часть и небелковую – гем.
 Скелетом гема является кольцо порфина. Порфин – это 16-членное кольцо (макроцикл), построенное из 4 пятичленных азотсодержащих гетероциклов пиррола и его изомеров, соединенных между собой по альфа-углеродным атомам метиновыми группами таким образом, что образуется сопряженная система. b-углеродные атомы во всех кольцах порфина могут быть связаны с различными группами, в частности, метильными, винильными и остатками пропионовой кислоты, образуя молекулы различных протопорфиринов. Протопорфирины имеют много изомеров в зависимости от положения заместителей в макроцикле. Один из его изомеров, имеющий в положениях 1,3,5,8 метильные группы, в положениях 2 и 4 – винильные группы и в положениях 6 и 7 – пропильные, получил название протопорфирин IX (1,3,5,8- тетраметил-2,4-дивинил-6,7-дипропионовокислый порфин).
Скелетом гема является кольцо порфина. Порфин – это 16-членное кольцо (макроцикл), построенное из 4 пятичленных азотсодержащих гетероциклов пиррола и его изомеров, соединенных между собой по альфа-углеродным атомам метиновыми группами таким образом, что образуется сопряженная система. b-углеродные атомы во всех кольцах порфина могут быть связаны с различными группами, в частности, метильными, винильными и остатками пропионовой кислоты, образуя молекулы различных протопорфиринов. Протопорфирины имеют много изомеров в зависимости от положения заместителей в макроцикле. Один из его изомеров, имеющий в положениях 1,3,5,8 метильные группы, в положениях 2 и 4 – винильные группы и в положениях 6 и 7 – пропильные, получил название протопорфирин IX (1,3,5,8- тетраметил-2,4-дивинил-6,7-дипропионовокислый порфин).
Рис. 1 Структура гема.
Комплекс протопорфина IX с Fe+2 называется гемом, а с Fe+3 – гемином.
Координационное число для железа равно шести. В геме железо связано двумя ковалентными связями с атомами азота II и IV колец и двумя координационными связями с атомами азота I и III колец.
Гем соединяется с белковой частью (глобином) гидрофобными связями между пиррольными циклами и гидрофобными радикалами аминокислот. Кроме того, имеется координационная связь между атомом железа и имидазольным кольцом одного из остатков гистидина в глобине. За счет еще одной координационной связи к атому железа может присоединяться молекула кислорода с образованием оксигемоглобина; валентность железа при этом не изменяется.
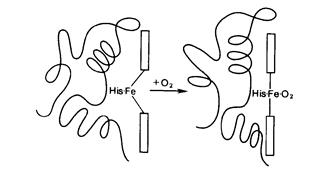
Рис.2. Смещение проксимального гистидина при оксигенировании дезоксигемоглобина
Пиррольные кольца гема расположены в одной плоскости, в то время как атом железа несколько выступает из этой плоскости.
При присоединении кислорода железо перемещается в плоскость пиррольных колец. Так как железо связано с остатком гистидина пептидной цепи, то происходит и перемещение участка пептидной цепи, то есть изменяется конформация белка. Таким образом, присоединение кислорода сопровождается изменением пространственной структуры.
Присоединение кослорода к гемоглобину носит кооперативный характер (труднее всего присоединяется первая молекула кислорода, а каждая последующая все легче).
Присоединение первой молекулы О2 с a-протомером происходит трудно, происходит изменение конформации a-протомера (атом железа входит в плоскость гемма и «тянет за собой ППЦ»). При этом рвутся две ионные связи между a и a¢ субъединицами. Субъединицы приобретают большую подвижность, что облегчает присоединение второй молекулы О2 к гему a¢-субъединицы. Оставшиеся две a-a¢ ионные связи при этом также разрываются, что дает возможность остальным гемам принять выгодное положение для присоединения кислорода. третья молекула кислорода соединяется с b субъединицей. Одна из ионных связей b-b¢ разрываются. облегчая доступ кислороду к последнему атому железа гема b¢. при этом разрывается последняя ионная связь b-b¢. В итоге 4-я молекула кислорода присоединяется к О2 примерно в 300 раз легче, чем 1-я.
Загруженный кислородом гемоглобин отдает его сначала с трудом, а затем все легче и легче. такое кооперативное поведение гемоглобина имеет физиологическое значение. если бы гемы действовали автономно, то загрузка кислорода потребовала бы 90-кратного перепада давления. А это невозможно, следовательно, основная масса кислорода не сможет оторваться от Hb. мы задохнулись бы даже в атмосфере кислорода.
Миоглобин – относительно небольшой глобулярный белок (мол. вес 16700); осуществляет в мышцах внутриклеточный транспорт и кратковременное депонирование кислорода. Молекула его состоит из одной полипептидной цепи, содержащей 153 аминокислотных остатка. В миоглобине, как и в гемоглобине содержится железопорфириновая группа (гемогруппа, или гем), и он так же как и гемоглобин, способен обратимо присоединять кислород. Таким образом, миоглобин в структурном и функциональном отношении родствен гемоглобину, молекула которого состоит из четырех пептидных цепей и четырех гемогрупп, вследствие чего его молекулярный вес в 4 раза выше.
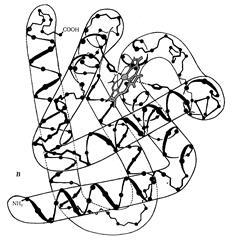
Рис. 4 Строение молекулы миоглобина
Миоглобин содержится в клетках скелетных мышц; в особенно больших количествах он встречается у водных млекопитающих, например у китов, тюленей и моржей, мышцы которых настолько богаты миоглобином, что окрашены в коричневый цвет. Миоглобин служит не только для депонирования кислорода; но и для ускорения диффузии кислорода в клетке.
Остов молекулы миоглобина состоит из восьми относительно прямолинейных отрезков, разделенных между собой местами сгибов (находятся остатки пролинов). Каждый отрезок на протяжении всей своей длины закручен в виде a-спирали; наиболее длинная спираль содержит 23 аминокислотных остатка, а наиболее короткая – 7, причем все спирали являются правыми. Около 70% аминокислотных остатков, содержащихся в молекуле миоглобина, находятся в прямолинейных a-спиральных участках.
5. Гемоглобинопатии. Это состояния, связанные с изменением одного из трех свойств нормального гемоглобина- растворимость, сродство к кислороду или устойчивость к денатурации.
Гемоглобины с измененной растворимостью.
Наиболее часто встречающийся аномальный гемоглобин - серповидно-клеточный HbS, т.к. в b-цепях гемоглобина остаток глу- в положении 6 заменен на остаток валина. У индивидуумов, гомозиготных по HbS наблюдается серповидно-клеточная анемия, а гетерозиготы имеют только некоторые признаки заболевания, но обычно без клинических проявлений. У больных серповидно-клеточной анемией нормальная форма эритроцитов изменяется на форму серпа или полумесяца при превращении окси-HbS в дезокси-HbS в условиях низкого pО2.. Серповидные зритроциты обладают повышенной механической ломкостью и имеют более короткую по сравнению с нормой продолжительность жизни. Серповидно-клеточная анемия встречается чаще в районах эндемичных по малярии, так как считается, что малярийный плазмодий вызывает в эритроцитах образование HbS.
Дефекты, обусловленные нарушением синтеза цепей гемоглобина.
Нарушение синтеза какой либо цепи гемоглобина приводит к возникновению талассемий. При a-талассемии нарушается синтез a - цепи. Это приводит к уменьшению образования всех физиологических видов гемоглобина.. b-талассемия вызвана нарушением синтеза b-цепей. При всех видах талассемии изменяется продукция эритроидных клеток в костном мозге и насыщение эритроцитов гемоглобином.
Гемоглобины с измененным сродством к кислороду.
Метгемоглобин отличается от гемоглобина наличием трехвалентного железа. В норме у взрослого человека содержится в крови гемоглобина: 132-164 г/л – у мужчин и 115-145 г/л – у женщин. Метгемоглобин составляет 0,1-0,3% от общего гемоглобина. Восстановление метгемоглобина в гемоглобин происходит при участии НАДФ.Н2 –метгемоглобинредуктазы, в присутствии аскорбиновой кислоты. Метгемоглобинемия развивается при:
1) отравлении нитратами, нитритами, нитрозосоединениями, анилином, бромидами, сульфонамидами. Для новорожденных особую опасность представляет собой нитратсодержащая вода.
2) наследственном дефиците НАДФ-метгемоглоинредуктазы
3) наличии аномальных гемоглобинов.
Карбоксигемоглобин.
Сродство гемоглобина человека к СО больше чем в 200 раз превышает сродство к кислороду. Так как СО вытесняет О2 из оксигемоглобина, то при отравлении СО на коже и в тканях жертвы четко различим яркий вишнево-красный цвет, характерный для HbCO.






