В процесі тканинного дихання від субстратів шляхом окиснення відщеплюються протони і електрони. Вони поступають на ферменти дегідрогенази, які відносяться до класу оксидоредуктаз і локалізовані у внутрішній мембрані мітохондрій. Пересуваючись від одного перенощика електронів до іншого, вони переходять на нижчі енергетичні рівні, віддаючи свою енергію порціями. В останній ланці дихального ланцюга електрони відновлюють молекулярний кисень з подальшим виділенням води. Звільнена енергія при перенесенні електронів у дихальному ланцюзі запасається в пірофосфатних зв’язках АТФ.
Окиснення органічних молекул в клітині, спряжене з вивільненням енергії, здійснюється дегідруванням – перенесенням електронів і протонів від атомів водню на молекулярний кисень (Рис. 3.1).

Рис. 3.1. Перенесення електронів і протонів від атомів водню
У клітинах тварин і людини спряження процесів окиснювапьно-відновних реакцій з синтезом АТФ проходить в клітинних органелах – мітохондріях. Ферменти дихального ланцюга розміщені на внутрішній мембрані цих органел і поділяються на три групи:.
1. Піридинзалежні дегідрогенази.
2. Флавінзалежні дегідрогенази.
3. Цитохроми.
3.3.1. Піридинзалежні дегідрогенази. Піридинзалежні дегідрогенази отримали таку назву в зв’язку з цим, що в структуру їх небілкового компонента входить похідне піридину – нікотинамід. Тому їх ще називають дегідрогеназами. Ці дегідрогенази як кофермент містять:
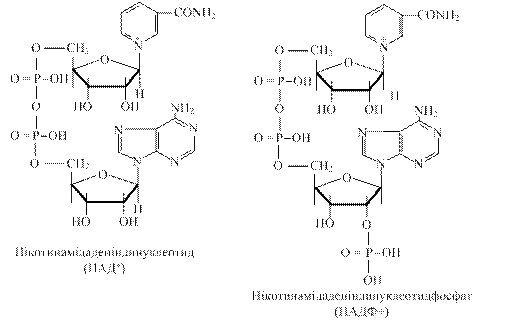
1) Нікотинамідаденіндинуклеотид (НАД+) складається з двох нуклеотидів: аденілової кислоти і нуклеотиду, в якого місце пуринової або піримідинової основи займає нікотинамід (вітамін РР). Ці нуклеотиди з’єднані через залишки фосфатів.
2) Нікотинамідаденіндинуклеотидфосфат ( НАДФ+) - це НАД+, у якого в другому положенні рибози аденілової кислоти є додаткова фосфатна група.
Піридинзалежні дегідрогенази відносяться до складних ферментів, в яких НАД+ або НАДФ+ є коферментами, слабо зв’язаними з апоферментом і тому в клітині знаходяться окремо від білкової частини ферменту, виконуючи функцію носіїв атомів водню (протонів і електронів). Ці дегідрогенази є універсальними акцепторами водню для багатьох субстратів: спиртів, альдегідів, кето- і гідроксикислот, дикарбонових кислот, амінів тощо. Специфічність дії цієї групи дегідрогеназ обумовлена білковою частиною ферменту, оскільки коферменти за своєю будовою подібні.
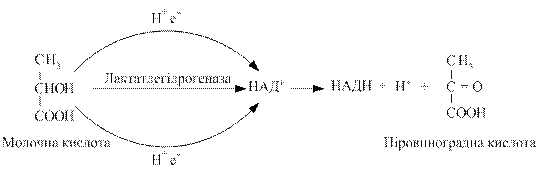
Дегідрування, як початкову стадію біологічного окиснення з участю піридинзалежних дегідрогеназ на прикладі молочної кислоти, можна представити так:
Здатність НАД+ і НАДФ+ виконувати функцію проміжного перенощика водню пов’язана з наявністю в його структурі аміду нікотинової кислоти.
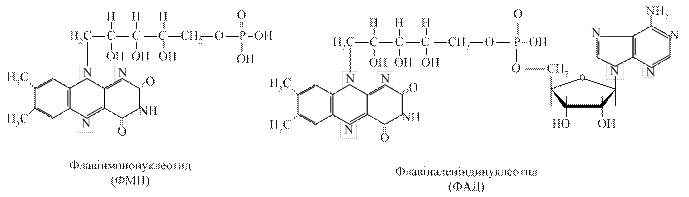
3.3.2. Флавінзалежні дегідрогенази. Вони містять у своїй структурі небілковий компонент флавінове кільце – вітамін В2. Одні з них виконують функцію первинного дегідрування певних субстратів (янтарна кислота, похідні жирних кислот та інші). Вони здатні відщеплювати й приймати водневі від субстратів, при цьому виключається дія піридинзалежних дегідрогеназ. Інші оксидази можуть зразу при дегідруванні субстратів передавати протони й електрони на молекулярний кисень з утворенням пероксиду водню, забираючи від НАД·Н+ Н+.
Флавінові ферменти є проміжними перенощиками водню від НАДН+Н+ на сполуку наступного етапу дихального ланцюга (убіхінон). Первинні дегідрогенази розміщуються на внутрішній поверхні внутрішньої мембрани мітохондрій.
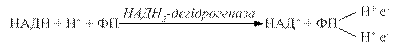
Відщепленні від НАДН+ Н+ електрони й протони (атоми водню) приєднуються до атомів азоту в 1-му і 10-му положеннях ізоалоксазинового кільця рибофлавіну, при цьому проходить переміщення подвійних спряжених зв’язків:
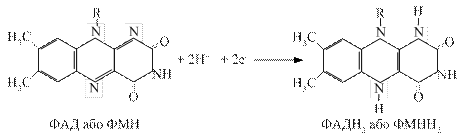
3.3.3. Убіхінон. Це жиророзчинний хінон, який має довгий ненасичений ланцюг. Він присутній практично у всіх клітинах. Його молекула здатна приєднувати атоми водню, що супроводжується переходом з окисленої форми у відновлену. Убіхінон може приймати участь в одно- і двоелектронному перенесенні. Молекула убіхінону має високу гідрофобність за рахунок бічного ланцюга. Це сприяє швидкій його дифузії в ліпідних фазах внутрішньої мітохондріальної мембрани. Убіхінон є похідним бензохінону з довгим бічним ланцюгом, який в більшості тканин ссавців складається з 10 ізопреноїдних залишків. На даний час встановлена коферментна роль убіхінону, який здійснює перенесення електронів і протонів, дифундуючи від внутрішньої поверхні мембрани до зовнішньої. Загальну реакцію третього етапу можна зобразити так:
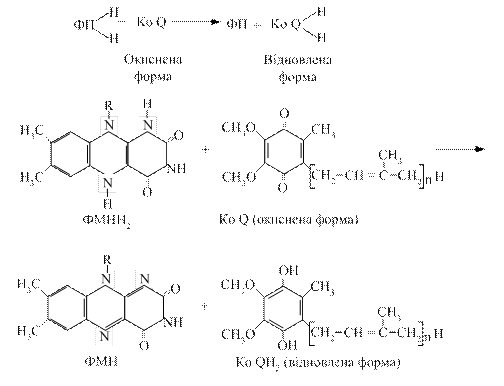
При цьому відновлена форма флавопротеїну окиснюється і може знову включатись у дихальний ланцюг.
3.3.4. Цитохроми. Цитохромна система складається з ряду ферментів, небілкова частина яких представлена залізопорфіринами, подібними до гему. Відомо чотири типи гемів, їх позначають латинськими буквами а,в,с. В процесах тканинного дихання велику роль відіграють цитохроми b, с1, с, а, а3. Цитохроми відрізняються будовою білкової частини, природою бічних ланцюгів і способом приєднання гему до білків. Атом заліза в гемі може змінювати валентність, приєднуючи або віддаючи електрон:
Fe3+ + e- ® Fe2+
Fe2+ - e- ® Fe3+
Установлено, що цитохроми розміщуються між КоQ і киснем. У дихальний ланцюг вони включаються в залежності від окиснювально-відновного потенціалу в основному в такій послідовності: b, с1, с, а, а3.
Комплекс цитохромів в і с1 переносить електрони від атомів водню відновленого КоQ·Н2 на цитохром c. Електрони послідовно проходять через атоми заліза цитохромів в і с1, потім поступають на цитохром с, протони при цьому вивільняються у внутрішнє середовище. Цитохром с – це залізовмісний білок з невеликою молекулярною масою (12000 Да), який складається з одного поліпептидного ланцюга і порфіринової групи з атомом заліза.
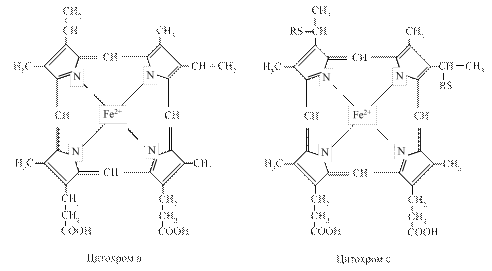
Цитохром с переносить електрони. Знаходиться поблизу внутрішньої мембрани і, очевидно, може виходити в міжмембранний простір. Він виконує як би човникові рухи між цитохромом b і комплексом цитохромів а і а3, дифундуючи вздовж поверхні мембрани.
3.3.5. Етапи тканинного дихання. Перший етап тканинного дихання починається з дегідрування, тобто відщеплення водню від відповідного субстрату. Ці реакції здійснюються піридинзалежними (для одних субстратів), а для інших флавінзалежними дегідрогеназами. Другий етап полягає в перенесенні в дихальному ланцюзі двох атомів водню від відновленої форми НАДН+ Н+ на флавопротеїни – проміжні переносники атомів водню. Третій етап– перенесення електронів і протонів від відновлених флавопротеїнів на убіхінон, який ще називають коферментом Q (КоQ). Потім в дихальному ланцюзі шляхи електронів і протонів розходяться (четвертий етап): електрони атомів водню від відновленої форми КоQ поступають на цитохромну систему, а протони звільняються у внутрішнє середовище. Комплекс цитохромів а і а3 переносить електрони на кисень. У результаті цього утворюється активний кисень, який взаємодіє з двома протонами з матриксу, утворюючи воду (рис. 3.2).
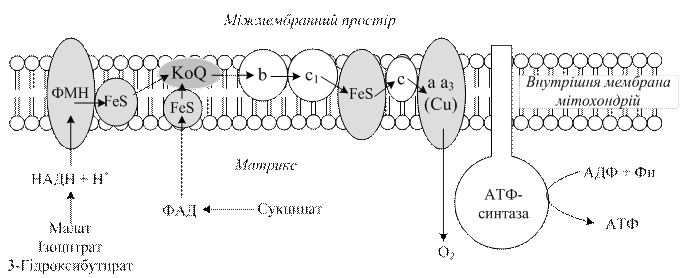 Рис.3.2. Схема організації компонентів дихального ланцюга мітохондрій
Рис.3.2. Схема організації компонентів дихального ланцюга мітохондрій
Перенесення протонів і електронів проходить завжди від меншого до більшого потенціалу (рис. 3.3). Різниця потенціалів між відновленим і окисненим субстратом називається редокс-потенціалом і вимірюється у вольтах.
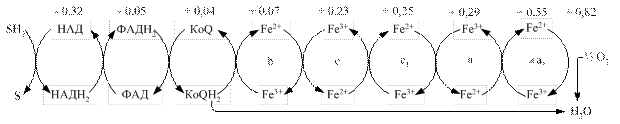
Рис. 3.3. Схема організації дихального ланцюга мітохондрій
Існують подовжені і скорочені шляхи тканинного дихання. Прикладом подовженого шляху є окиснення α-кетокислот.
Вони спочатку піддаються окиснювальному декарбоксилюванню (проходить втрата карбоксигрупи α -кетокислот з утворенням СО2), а два водні передаються на ліпоєву кислоту, потім діють нікотинамідні ферменти і вже НАДН2 включається в дихальний ланцюг. Скороченим шляхом окиснюється, наприклад (бурштинова) янтарна кислота:

При цьому процес дегідрування здійснюють флавінзалежні дегідрогенази, тобто виключається дія нікотинамідних дегідрогеназ. В живих організмах може відбуватися скорочений шлях аеробного окиснення органічних речовин без участі цитохромної системи. В цьому випадку водні окисненого субстрату зразу переносяться особливими металовмісними флавіновими ферментами (оксидазами) на молекулярний кисень з утворенням пероксиду водню. Утворений пероксид водню є сильною отрутою для клітини. Його знешкодження здійснюється за допомогою гемвмісних ферментів: каталази і пероксидази (рис. 3.4).
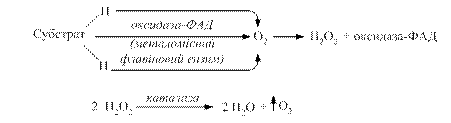
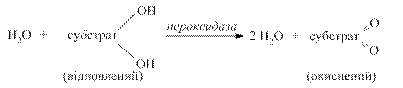
Рис. 3.4. Схема утворення пероксиду водню та механізм його знешкодження каталазою та пероксидазою
Каталаза – дуже активний фермент; одна її молекула розкладає до 4000 молекул Н2О2 за 1с. Пероксидаза в тканинах тварин малоактивна порівняно з каталазою. Рослинні клітини навпаки багаті на пероксидазу. Для каталази субстратом і донором електронів служать молекули пероксиду водню, а для пероксидази – органічний субстрат.






