Лекционный комплекс.
Лекция 1
План
1. Введение. Характеристика коллоидной химии как науки.
2. Основные этапы развития коллоидной химии. Значение коллоидной химии в подготовке учителя химии.
3. Общая характеристика дисперсных систем (ДС).
4. Классификация ДС по степени дисперсности, по агрегатному состоянию фаз, по степени взаимодействия дисперсной фазы с дисперсной средой.
5. Роль коллоидно-химических процессов в технологических системах.
Первые работы, ставшие отправным пунктом в возникновении учения о коллоидах, были проведены в середине XIX в. Итальянский ученый Ф. Сельви (1845) изучал системы, представляющие собой хлорид серебра, серу, берлинскую лазурь, распределенные в объеме воды. Он считал, что ничтожное количество этих веществ, не являются растворами, похожими на растворы хлорида натрия.
К. Нэгли, чтобы отличить системы содержащие мицеллы (частицы mica ит.) от растворов назвал мицеллосодержащие системы «золями».
М. Фарадей (1857) исследовал системы, содержащие золото, распределенное в объеме воды. Такие системы были известны еще алхимикам, получившим их восстановлением в воде солей золота и давшим им название aurum potabile (питьевое золото). Изучая оптические свойства золей золота, Фарадей пришел к выводу, что в них золото содержится в виде очень маленьких частиц.
Т. Грэм (1861) провел исследования по диффузии, нашел коллоиды, ввел диализ, предложил мембрану для разделения растворов и коллоидов. В своих работах Грэм использовал диализ, работая с системами, содержащие органические вещества: желатин, пектин, казеин, гуммиарабик и другие, которые, как золото, берлинская лазурь в золях, отличаются малой скоростью диффузии и не проходят через мембрану при диализе и плохо диффундируют.Полувековой период в развитии коллоидной химии связан с противоречивыми мнениями о природе коллоидов. В 1903 г был сконструирован ультрамикроскоп, позволивший наблюдать отдельные коллоидные частицы. Это способствовало быстрому развитию коллоидной химии. Оно позволило вычислить размеры частиц в золях, проверить теорию броуновского движения, разработанную А. Эйнштейном и М. Смолуховским (1905 – 1906). Исследователи большое внимание уделяли размерам частиц, связывая их со свойствами коллоидных растворов, с процессами коагуляции. Советские исследователи А.А. Думанский, И.И. Жуков, П.А. Ребиндер, Б.В. Дерягин и др. изучали вышеприведенные процессы.
Коллоидная химия играет важную роль в современном научно-техническом прогрессе. Без коллоидно-химических процессов невозможны многие технологические операции радиоэлектронной, пищевой, легкой промышленности, производство строительных материалов, медицинских препаратов и др. Изучение коллоидной химии – необходимое звено в подготовке квалифицированных специалистов химиков, в том числе и бакалавров химии.
Дисперсные системы. В коллоидной химии широко используются многие понятия из курса физической химии.
Фаза – часть системы одного состава, одинаковых физических свойств, ограниченная от других частей поверхностью раздела. Разделяют гомогенные системы, гетерогенные системы, микрогетерогенные системы и ультрамикрогетерогенные системы.
Микрогетерогенные и ультрамикрогетерогенные системы _ представители особого класса гетерогенных систем, называемых дисперсными системами. Эти системы имеют чрезвычайно развитую поверхность раздела фаз. Понятия «дисперсные» системы объединяют системы, содержащие частицы, малые во всех измерениях, и, системы с частицами, имеющими в некоторых направлениях значительные размеры (вплоть до макроскопических). К первому роду систем относятся дисперсии золота, серы, берлинской лазури и другие вещества в воде, ко второму – активированный уголь, силикагель, синтетические пористее алюмосиликаты (цеолиты).
Дисперсность. Различия меду между системами может заключаться в том, что одна система содержит дисперсную фазу в виде частиц одного и того же размера, а друга частицы разного размера.
В. Оствальд предложил применять для характеристики систем степень дисперсности, мерой которой служит удельная поверхность.
Удельной поверхностью называют площадь раздела фаз, приходящую на единицу массы или объема дисперсной фазы. Если частицы дисперсной фазы имеют форму куба и одинаковы по размерам, то удельная поверхность системы вычисляется по формуле
Sуд = 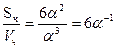 ,
,
где 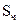 - поверхность частиц; Vч – ее объем; a - длина ребра кубической частицы.
- поверхность частиц; Vч – ее объем; a - длина ребра кубической частицы.
Для системы, содержащей одинаковые частицы дисперсной фазы сферической формы
Sуд = 6a-1
Используя удельную поверхность как усредненную характеристику, можно сравнить микро- и ультрамикрогетерогенные системы с пористыми телами системы, также включенными в класс дисперсных систем. Например, средний размер частиц в ультрамикрогетерогенных системах можно принять равным 10-8 м, чему соответствует удельная поверхность 109 м2/м3. Имеющие развитую внутреннюю поверхность активированный уголь и силикагель по этому показатель близки к ультрамикрогетерогенным системам; их удельная
поверхность соответственно 8×105 м2/кг и 4×105 м2/кг.
Классификации дисперсных систем. В основу наиболее простой классификации дисперсных систем положены размеры частиц дисперсной фазы (табл. 1).
Самыми малыми дисперсными частицами являются наночастицы. Наночастицы содержат несколько сотен (или менее) атомов. Они имеют сложную внутреннюю структуру. Важная особенность наночастиц по сравнению с более крупными частицами заключается в том, что из-за предельно малых размеров у них отсутствует различие между поверхностными и объемными свойствами. К числу наиболее известных наночастиц относятся фуллерены – разветвленные образования, состоящие из атомов углерода. Характерный признак ультрадисперсных частиц (наночастиц) – зависимость их свойств от размера частиц, т.е. наличие размерных (масштабных) эффектов.
Высокодисперсные частицы благодаря своим малым размерам способны участвовать в броуновском движении. Грубодисперсные частицы вследствие отличия их плотности от плотности дисперсионной среды быстро оседают, или всплывают, что приводит к расслоению фаз и «гибели» коллоидов.
Таблица 1. Классификация дисперсных систем по размеру частиц.
| Тип системы | Размер частиц, м | Характерные свойства | |
| Грубодисперсные | 10-5 – 10-7 | Частицы дисперсной фазы видимы в обычный микроскоп | |
| Коллоидно-дисперсная | 10-7 – 10-9 | Частицы проходят через бумажные и стеклянные фильтры, но не проходят через ультрафильтры; невидимы в обычный микроскоп, но видимы в ультра- и электронный микроскоп. | |
| Форма частиц Длина, ширина и толщина частиц примерно одинаковы и составляют от 1 нм до 10 мкм Толщина частиц составляет от 1 нм до 10мкм, длина и ширина – более 100мкм Диаметр поперечного сечения составляет от1 нм до 10мкм Сферическая, кубическая Эллипсоидная, призматическая | Объемные (трехмерные) Поверхностные (двухмерные): например, тонкие пленки и слои Линейные (одномерные): тонкие нити, волокна Симметричные | ||
| Строение частиц: Твердые частицы; жидкие капли и пленки; газовые пузырьки пленки Мицеллы в растворах поверхностно- активных веществ; кластеры | Фазовые Псевдофазовые | ||
| Химический состав частиц | Неорганические Органические Полимерные Биополимерные | ||
Низкомолекулярные системы (обычно жидкости, растворы, газовые смеси) имеют размеры частиц мене 10-9 м. Входящие в их состав молекулы и ионы невидимы в ультрамикроскоп и способны проходить через ультрафильтры.
Наибольшее распространение получила классификация, в основу которой положено агрегатное состояние фаз, образующих дисперсную систему. Буквами Г, Ж и Т обозначены соответственно газообразное, жидкое и твердое состояния.
Таблица 2. Классификация дисперсных систем по агрегатному состоянию
| Дисперсионная среда | Дисперсная фаза | Характеристика по размеру частиц | Название системы |
| Г | ¾ | ||
| Г | Ж | Гд Кд | Туман Аэрозоль |
| Т | Гд Кд | Пыль, дым Аэрозоль | |
| Г | Гд Кд | Пена Пена | |
| Ж | Ж | Гд Кд | Эмульсия Эмульсия |
| Т | Гд Кд | Суспензия Золь | |
| Г | Гд Кд | Твердая пена Твердая пена | |
| Т | Ж | Гд Кд | Нет названия То же |
| Т | Гд Кд | Твердый золь Твердый золь** |
* Кд и Гд означают соответственноно коллоидно-дисперсные и грубодисперсные системы.
** Примером твердого золя может служить «рубиновое стекло», в котором коллоидно-дисперсное золото распределено по объему силикатного стекла.
В название коллоидно-дисперсных систем часто включают название дисперсионной среды и слово «золь», например лиозоль (жидкая среда, от греч. лиос – жидкость), алкозоль (в спирте), гидрозоль (воде) и т.п.
Классификация, учитывающая различие в форме частиц, называется классификацией по топографическому признаку. В соответствии с этим различают корпускулярные, фибриллярные (волокнистые) и ламинарные (пленочные) системы. В корпускулярных системах частицы дисперсной фазы малы по всем измерениям; в фибриллярных (волокнистых) – по двум направлениям; в пленочных (ламинарных) – по одному направлению.
Классификация дисперсных частиц по форме. Форма дисперсных частиц очень разнообразна
. На многие свойства дисперсных частиц и образуемых ими дисперсных систем сильно влияет соотношение между их размерами: длиной (l), шириной (h) и толщиной (d). По этому признаку частицы классифицируются на три группы.
1. объемные (трехмерные) частицы: все три размера (h, l, d) примерно одинаковы и находятся в дисперсном (от 1 нм до 10 мкм) интервале.
2. поверхностные (двухмерные) частицы: дисперсному интервалу отвечает только один размер (толщина d), а два других размера (длина l и ширина h) значительно больше и могут иметь макроскопические значения.
3. линейные (одномерные) частицы: очень тонкие нити, волокна; интервалу дисперсных размеров отвечает поперечный размер.
Классификация дисперсных частиц по строению. В зависимости от строения дисперсные частицы классифицируют на фазовые и псевдофазовые.
Фазовые частицы. Такие частицы представляют собой малые объемы макроскопической фазы вещества. Они могут находиться в трех агрегатных состояниях: в виде твердых частиц (микрокристаллов), небольших жидких капель или тонких пленок, газовых пузырей. Основные особенности дисперсных фазовых частиц определяются их большой удельной поверхностью.
Псевдофазовые (коллоидные) частицы. Большая группа дисперсных частиц имеет сложное и своеобразное строение, которое нельзя отнести к одному из трех агрегатных состояний. Дисперсные частицы с такой особой структурой называют псевдофазными, или коллоидными.
Яркий пример псевдофазных дисперсных частиц – агрегаты, состоящие из нескольких десятков молекул поверхностно-активных веществ; такие агрегаты называют мицеллами. Другой важный класс псевдофазных частиц – агрегаты из небольшого числа наночастиц.
Классификация дисперсных частиц по химическому составу. Она очевидна из таблиц и не требует дополнительных пояснений.
Контрольные вопросы
1. В чем содержатся характеристика коллоидных систем
2. Какая классификация дисперсных частиц по коллоидному раствору?
3. Как проводится классификация дисперсных частиц по строению?
4. Как проводится классификация дисперсных частиц по размерам частиц?
Лекция 2
План
1. Лиофобные системы.
2. Лиофильные системы.
3. Методы получения дисперсных систем.
4. Химические методы получения дисперсных систем.
5. Диализ.
Микрогетерогенные и ультрамикрогетерогенные системы _ представители особого класса гетерогенных систем, называемых дисперсными системами. Эти системы имеют чрезвычайно развитую поверхность раздела фаз.
По термодинамической устойчивости и характеру образования различают лиофобные и лиофильные системы. Первые образуются из пересыщенных систем или в результате дробления более крупных частиц и являются термодинамически неустойчивыми. Лиофильные системы образуются самопроизвольно и, следовательно, термодинамически устойчивы.
Получение дисперсных систем. Известны два способа получения дисперсных систем. В одном из них тонко измельчают (диспергируют) твердые и жидкие вещества в соответствующей дисперсионной среде, в другом вызывают образование частиц дисперсной фазы из отдельных молекул или ионов.
Методы получения дисперсных систем измельчением более крупных частиц называют диспергационными. Методы основанные на образовании частиц в результате кристаллизации или конденсации называют конденсаци- онными. Диспергационные методы широко используют для получения грубодисперсионных систем – суспензий, эмульсий. Порошков. Выбор типа измельчения твердых материалов зависит от механических свойств. Хрупкие материалы измельчают ударом, вязкие истиранием.
Механическое измельчение проводят в специальных промышленных и лабораторных устройствах – мельницах.
Высокой дисперсности можно достичь ультразвуковым диспергированием, которое связано с кавитацией – образованием и захлопыванием полостей в жидкости. Захлопывание полостей сопровождается появлением кавитационных ударных волн, которые и разрушают материал. Эмульсии, полученные ультразвуковым методом, отличаются однородностью частиц дисперсной фазы.
Механическому разрушению твердых материалов способствуют дефекты их кристаллической структуры.
Получению высокодисперсных систем может препятствовать слипание частиц дисперсной фазы. Скорость слипания обычно возрастает с уменьшением размеров частиц.
Конденсационные методы позволяют получить дисперсные системы из гомогенных сред. Появление новой фазы происходит при пересыщении среды. Пересыщение, т.е. создание кон м химической реакции или физического процесса. В зависимости от этого различают физические и химические конденсационные методы.
Физические методы. Они основаны на конденсации пара. В газовой среде конденсацией паров различных веществ получают аэрозоли. Совместной конденсацией нерастворимых веществ можно получить золи.
Химические методы. В качестве примеров приведем следующие химические процессы.
1. Восстановление. Классический пример этого метода – получения золя золота восстановлением золотохлористоводородной кислоты. в качестве восстановителя используют пероксид водорода (метод Зигмонди)
2HAuCl4 + 3H2O2 = 2Au + 8HCl + 3O2
Известны и другие восстановители. Некоторые из них применяли еще в средние века алхимики.
Золи железа, никеля, вольфрама, свинца и ряда других металлов можно получить электрохимическим восстановлением из их солей.
2. Гидролиз. Широко применяется для получения золей гидроксидов металлов. Например, золь гидроксида железа получают по реакции
FeCl3 + 3H2O = Fe(OH)3 + 3HCl
Для очистки воды от механических примесей используют гидроксид алюминия, полученный гидролизом сульфата алюминия.
3. Реакция обмена. Этот метод наиболее часто встречается на практике. Например, получения золя сульфида мышьяка
2H3AsO3 + 3H2S = As2S3 + 6H2O
Получение золя иодида серебра
AgNO3 + KI = AgI + KNO3
Реакции обмена дают возможность получить золи в органических растворителях. В частности, хорошо изучена реакция
Hg(CN)2 + H2S = HgS + 2HCN
Ее проводят, растворяя Hg(CN)2 в метиловом, этиловом или пропиловом спирте и пропуская через раствор сероводород.
Все приведенные выше реакции применимы и для получения макрокристаллических осадков. Для их образования используют растворы 0,1 М концентрации. Для образования микроскопических образований нужны сильноразбавленные растворы (в сотни и тысячи раз менее).
Первый этап образования новой фазы – появление зародышей, являющихся минимальным скоплением новой фазы и находящихся в равновесии со средой. Известны два механизма образования зародышей: а) гомогенный, при котором новая фаза зарождается в однородной старой фазе;
б) гетерогенный метод, при котором зарождение происходит в местах неоднородностей фазы. Примесями, служащими центрами конденсации по гетерогенному механизму, могут быть отдельные пылинки или заряженные частицы.
Образование зародышей по гомогенному механизму объясняется местным повышением концентрации в результате теплового движения молекул (флуктуации концентраций).
Термодинамические расчеты, произведенные Дж.У. Гиббсом и М. Фольмером, показывают, что работа, затраченная на образование зародыша по гетерогенному механизму, меньше, чем по гомогенному. Этот вывод подтверждается экспериментально: в системе. содержавшей гетерогенные примеси, конденсация протекает значительно легче.
Второй этап конденсационного образования новой фазы – рост кристаллов. Скорость роста кристаллов определяется разностью действующей концентрации вещества в растворе и равновесной концентрацией этого вещества при той же температуре. Чем больше разность, тем быстрее растут кристаллы.
Скорость роста кристаллов может значительно замедляться примесями, содержащимися в системе. Замедляющее действие примесей связано с их способностью захватываться поверхностью растущего кристалла. Располагаясь на поверхности. Ни затрудняют доступ молекул или ионов кристаллизующего соединения.
Золи и растворы высокомолекулярных соединений содержат в виде нежелательных примесей низкомолекулярные соединения. Их удаляют следующими методами.
Диализ. Он является исторически первым методом очистки. Его предложил Т. Грэм (1861). Диализатор представляет сосуд, дном которого служит мембрана, задерживающая коллоидные частицы или макромолекулы и пропускающая молекулы растворителя и низкомолекулярные примеси. Внешней средой, контактирующей с мембраной, является растворитель. Низкомолекулярные примеси. Концентрация которых в золе или макромолекулярном растворе выше, переходит сквозь мембрану во внешнюю среду (диализат). Очистка идет до тех пор, пока концентрации примесей в золе и диализате не станут близкими по величине. Т.е. пока не выровняются химические потенциалы в золе и диализате.
Эффективность очистки зависит от свойств мембраны. Мембраны имеют пористую природу. Размеры пор, сквозь которые проходят низкомолекулярные вещества. должны быть достаточно малыми. Чтобы через них не проходили коллоидные частицы или макромолекулы.
Для низкомолекулярных систем можно с достаточным приближением принять, что скорость очистки определяется разностью примесей в золе и диализате. Кинетика очистки методом диализа может быть выражена уравнением
w = 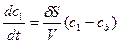 ,
,
где w - скорость диализа, с – концентрация низкомолекулярного вещества в золе в момент времени t; сд – концентрация вещества в диализате; S – площадь мембраны; V – объем золя в ячейке; d - коэффициент диализа, зависящий от вязкости среды, природы примесей и пористости мембран.
Как видно из уравнения, один из способов интенсификации процесса диализа – повышение отношения S/V.
Контрольные вопросы
1. Охарактеризуйте методы получения дисперсных частиц.
2. Укажите основные способы диспергирования твердых материалов.
3. В чем заключается процесс самопроизвольного диспергирования?
4. Приведите примеры физических и химических конденсационных методов получения дисперсных частиц.
Лекция 3
План
1. Коллоидные растворы – ультрамикрогетерогенные системы.
2. Лиофобные и лиофильные системы (ВМС). Сходства и различия
. 3. Общая характеристика коллоидных растворов.
4. Кинетическая и агрегативная устойчивость коллоидных систем.
Истинные растворы отличаются от коллоидных тем, что они представляют собой гомогенные системы, где растворенное вещество раздробленно в растворителе в виде отдельных, не связанных между собой молекул или ионов, размеры которых порядка 10-7 см. В коллоидных растворах размеры частиц в 10 -100 раз большее; грубодисперсных системах размеры частиц свыше. Грубодисперсные системы часто называют суспензиями или эмульсиями.
Суспензии – коллоидная система, в которой крупные твердые частицы диспергированы в жидкой среде.
Эмульсия – коллоидная система, в которой крупные жидкие частицы равномерно распределены в другой жидкой фазе.
Коллоидные растворы называют золями (лат. solution - раствор), Застывший золь, превратившийся целиком в довольно плотную студнеобразную массу, называют гелем (лат.gelatinous - желатин). Согласно современным представлениям студни (гели) образуются высокомолекулярными соединениями, молекулы которых могут соединяться друг с другом в длинные цепочки или нити. Переплетение этих нитей создает ажурную пространственную решету или сетку (скелет студня), ячейки которой заполнены жидкостью.
Коллоидная система называется лиофобной (греч  растворяю и jobox -страх), если частица непосредственно не взаимодействует с окружающим ее растворителем. Например, коллоидные растворы металлов
растворяю и jobox -страх), если частица непосредственно не взаимодействует с окружающим ее растворителем. Например, коллоидные растворы металлов
(золота в воде).
Лиофильные коллоидные растворы (греч. 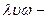 растворяю,
растворяю, 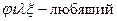 ) проявляют химическое взаимодействие коллоидных частиц с окружающим их растворителем. К таким коллоидным растворам относятся водные растворы желатина, крахмала и др.
) проявляют химическое взаимодействие коллоидных частиц с окружающим их растворителем. К таким коллоидным растворам относятся водные растворы желатина, крахмала и др.
Водные растворы коллоидов называются гидрозолями или гидрогелями.
Коллоидные растворы могут быть получены двумя противоположными путями: раздроблением или диспергированием грубых частиц на более мелкие; агрегацией молекул или ионов, в более крупные частицы. Первые получили название методов диспергирования, вторые называются конденсационными. Важным условием для получения устойчивого коллоидного раствора является присутствие в растворе ПАВ, которые создают достаточное интенсивное взаимодействие между поверхностью частиц и окружающей их средой. Вещество, которое обусловливает устойчивость коллоидного раствора,
называется стабилизаторам
Строение частиц гидрозоля, например йодистого серебра, в случае избытка в системе йодистого калия можно представить следующим образом
{m[AgI] × nI- × (n – x) K+}x- × xK+
ядро
ô «ô адсорбционный ®ôдиффузионный® ô
слой слой
ô коллоидная частица ® ô
ô мицелла ® ô
m число молекул AgI в ядре частицы; n – количество избыточных ионов, прочно адсорбированных на поверхности ядра
(как правило, m >> n); n - x – число противоионов в коллоидной частице. Так как обычно n > x, т коллоидная частица имеет в нашем примере заряд x-. В зависимости от условий приготовления и очистки золя коэффициенты m,n,x могут изменяться в широких пределах.
При формировании мицеллы на ядре её адсорбируются ионы согласно следующим правилам Пескова – Фаянса.
1. на всякой твердой поверхности адсорбируются преимущественно ионы, которые имеют общую с данной поверхностью атомную группировку. Поэтому, например, на осадке йодистого серебра, полученном в реакции
AgNO3 + KI ® AgI + K NO3,
преимущественно будут адсорбироваться ионы Ag+ либо I- , но не ионы K+ или NO3-.
Многовалентные ионы адсорбируются значительно лучше, чем одновалентные. Ион будет адсорбироваться твердой поверхностью, если заряд поверхности противоположен по знаку заряда иона и если образующееся поверхностное соединение труднорастворимо.
Контрольные вопросы
1. Какие растворы называются коллоидными растворами?
2. Что собой представляют лиофобные и лиофильные системы? В чем их сходства и различия?
. 3. Дать общую характеристику коллоидным растворам.
4. В чем кинетическая и агрегативная устойчивость коллоидных систем.
Лекция 4
План
1. Диффузия в коллоидных растворах и величина сдвига.
2. Мембранное равновесие.
3. Реологические свойства коллоидных систем.
4. Закон Ньютона.
5. Вязкость коллоидных растворов. Аномалии вязкости. Уравнение Бингма.
Молекулярно – кинетическая теория, первоначально разработанная для газов, а затем распространенная на молекулярные или ионные растворы, применима к растворам высокомолекулярных соединений. Специфика коллоидных систем и растворов ВМС проявляется в том, что масса отдельной частицы или отдельной микромолекулы намного больше массы молекулы дисперсионной среды (в случае золя) или растворителя (для ВМС).
Изучение молекулярно-кинетических явлений важно по двум причинам. Одна из них – экспериментальная проверка основных положений молекулярно-кинетической теории. Используют ультрамикроскопиию.
Вторая причина – использование получаемых результатов для решения практических задач: определения размеров и массы частиц и макромолекул, фракционирование систем и др.
Диффузия. Диффузией называется перенос вещества в системе, из двух или более компонентов, вследствие теплового движения молекул и частиц дисперсной фазы. Процесс переноса обнаруживается по изменению со временем концентрации вещества в различных частях системы. Если в пределах всей системы температура одинаковая, то диффузия приводит к самопроизвольному выравниванию концентраций. В тех случаях, когда в системе имеется температурный или, какой либо другой градиент, влияющий на значение химического потенциала вещества, диффузия может даже к еще большему увеличению разности концентраций. Поэтому рассматриваются изотермические системы.
Количественно диффузия характеризуется потоком Ii, равным массе вещества, проходящей за единицу времени через условную единичную поверхность, располагаемую перпендикулярно направлению потока:
Ii = 

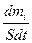 ,
,
где dmi – масса вещества i, переносимое за достаточно малое время dt через поверхность, площадь которой равна S.
А.Фик (1855) вывел уравнение
Ii = - Di grad ci
где D – коэффициент диффузии вещества i. В СИ размерность коэффициента диффузии – м2× с-1.
Знак минус означает, что поток направлен против градиента, т.е. в сторону уменьшения концентрации.
Изучение диффузии сводится обычно к определению коэффициента диффузии. Экспериментально установлено, что коэффициент диффузии, являющийся характеристикой системы дисперсионной среды – диффундирующее вещество, зависит от концентрации.
Закон вязкого течения Ньютона. Ньютон (1687 г.) предположил, что внутреннее трение при течении жидкости зависит от относительной скорости и перемещения ее части. Закон вязкого течения жидкости, установленный Ньютоном, постулируется так: сила внутреннего трении при перемещении одного слоя жидкости относительно другого, прямо пропорциональна градиенту относительной скорости этого перемещения и поверхности слоев. Математическая запись закона Ньютона:
F = hS 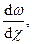
где F- сила, действующая на поверхности его слоя в направление, противоположном его движению; S – площадь слоя; w - относительная скорость, движения слоев, находящихся на расстоянии c; h - коэффициент пропорциональности, зависящий от природы жидкости и являющийся одной из важнейших ее характеристик (его называют коэффициентом вязкости или просто вязкостью).
Характерной особенностью многих золей вялятся неподчинение их зависимостям, выражаемым уравнением Ньютона. Для многих золей, эмульсий и растворов высокомолекулярных веществ зависимость, характерная для истинных растворов, отсутствует. Вычисленная по соответствующему уравнению вязкость имеет переменное значение и является функцией градиента скорости. Т.е. вязкость многих дисперсных систем не является инвариантной характеристикой системы, зависит от условий ее определения, например от скорости течения жидкости в вискозиметре, от типа и размеров прибора.
Законам Ньютона и Пуазейля не подчиняются коллоидные системы с удлиненными частицами и частицами, способными деформироваться, а также структурированные коллоидные системы. Причина аномалии вязкого течения коллоидных систем с вытянутыми, палочкообразными частицами заключается в том, что по мере увеличения напряжения сдвига, обусловливающего течение, такие частицы ориентируются своей длинной осью в направлении потока, в результате чего понижается гидродинамическое сопротивление и этим самым убыстряется движение жидкости.
Все жидкости, починяющиеся закону Ньютона, называются нормальными; системы же, способные течь, но не подчиняющиеся уравнению Ньютона, принято называть аномальными.
Контрольные вопросы
1. Что такое диффузия?
2. В чем заключается закон Фика
3. Что такое реологические свойства коллоидных систем?
4. Что такое вязкость коллоидных растворов.?центраций, превышающих равновесные, может быть вызвано проведение
Лекция 5
План
1. Особенности оптических свойств дисперсных систем, рассеяние света. Оптическая анизотропия
2. Окраска коллоидных систем. Оптические методы анализа дисперсности.
3. Дисперсионный анализ методом световой микроскопии.
Оптические свойства дисперсных систем.
Оптические методы используются для изучения систем, содержащих множество частиц, и для наблюдения за отдельными частицами. Для дисперсных систем наиболее характерное оптическое явление – рассеяние света. При рассеянии света энергия падающего луча не переходит в тепловую энергию, а снова испускается частицами в разных направлениях. Поэтому рассеянный свет можно наблюдать сбоку на темном фоне.
Систематическое изучение рассеяния света началось в середине XIX в. (Брюк1852 г.; Фарадей, 1857г.; Тиндаль начиная с 1869г.). Особенно подробные исследования были выполнены Дж. Тиндалем, предложившим освещать золь с помощью проекционного фонаря. Видимый сбоку луч получил название конуса Тиндаля.
Теория рассеяния света разработана Релеем (3871-1898). Она применим к системам, содержащим непроводящие частицы (золи диэлектриков) сферической формы с размерами во много раз меньше длины волны падающего света. Предполагается, что под действием электрического поля световой волны в частицах диэлектриков возникают индуцированные диполи, становящиеся новыми источниками излучения. Интенсивность света S1, рассеваемого частицей, определяется по формуле
S1 = 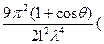
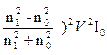 ,
,
Где q - угол между направлением падающего пучка и пучка рассеянного света; l – расстояние от сферической частицы при наблюдении рассеяния; V- объем частицы; l - длина волны света;
I0 – интенсивность света; n1 и n0 – показатели преломления частицы и среды.
Полная интенсивность света, рассеиваемого частицей во всех направлениях,
S1 = 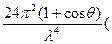
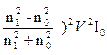 .
.
Из уравнения Релея можно сделать следующие выводы. Рассеяние света тем значительнее, чем крупнее частицы.
На интенсивность рассеяния света оказывает длина его волны. Преимущественно рассеивается коротковолновое излучение (обращает внимание l4 в знаменателе). Поэтому при освещении белым светом, который можно рассматривать как смесь лучей различной длины волны, рассеянный свет богаче коротковолновым излучением а прошедший – длинноволновым. Интенсивность рассеянного света находится в прямой зависимости от разности показателей преломления дисперсной фазы и среды. При равенстве
показателей преломления система практически не рассеивает свет. Если при этом среда и дисперсная фаза отличается показателем оптической дисперсии, то система окрашена в яркие цвета (эффект Христиансена).
Рассеяние света наиболее заметно в дисперсных системах, однако и гомогенные системы рассеивают свет.
Рассеивание света в газах, жидкостях и кристаллах объясняется тепловым движениям атомов и молекул, нарушающих их оптическую однородность. В результате в различных областях объема будут различные
концентрации атомов и молекул, нарушающих их оптическую однородность (теория Смолуховского).
На основании данной теории А. Эйнштейн разработал теорию рассеяния света гомогенными системами (1910). Дебай (1944) показал, что рассеяние света растворами высокомолекулярных соединений может быть использовано для определения молекулярных масс веществ.
Явления, связанные с рассеянием света, широко используется для установления формы и размеров частиц.
Аналитический метод определения концентрации частиц, основанный на измерении интенсивности рассеянного света, называется нефелометрией
В некоторых случаях сравнивают интенсивность не рассеянного света, а интенсивности световых потоков, проходящих через рассеивающую среду. Этот метод называется турбидиметрией. Интенсивность света, прошедшего через рассеивающую среду, определяется по уравнению
I = I0 e-hel,
Где h – коэффициент мутности, с – концентрация частиц; l – толщина кюветы.
Существуют эффекты, напоминающие в некоторой степени опалесценцию (рассеяние света), флуоресценцию и комбинационное рассеяние. В отличие от рассеяния при флуоресценции и комбинационном рассеянии переходы электронов на различные энергетические уровни под действием квантов света приводят к появлению излучений с длиной волны, отличающейся от падающего света.
Ультрамикроскопия Дифракционная теория Аббе показывает, что предельное значения частиц, видимых в микроскоп, 2,5×10-7м, а при применении иммерсионных жидкостей – 1,8×10-7м. Следовательно, коллоидные частицы не наблюдаются с помощью обычного оптического микроскопа.
В 1903 г. Р.Зигмонди, и Г. Зидентропф предложили оптический метод изучения систем, содержащих частицы коллоидных размеров. По этому методу, называемому ультрамикроскопией, наблюдается свет, рассеянный
одиночными частицами. Этот метод можно сравнить с наблюдением за движением отдельных пылинок, попавших в солнечный луч в темном помещении. Метод ультрамикроскопии дает возможность определить средние размеры частиц в золе. Для этого сосчитывают число частиц n в просматриваемом объеме u. Если общий объем системы V, а масса дисперсной фазы m, то средний объем частицы равен
¡ = 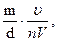
где d – плотность дисперсной фазы.
Ультрамикроскопия в некоторой степени позволяет судить о форме частиц, так как интенсивность света, рассеиваемого сферическими частицами, не изменяется со временем. А аниздиаметрические частицы вследствие вращательного броуновского движения мерцают.
Контрольные вопросы
1. В чем заключаются особенности оптических свойств дисперсных систем?
2. Особенности оптических методов анализа?
3. Какие оптические свойства проявляют дисперсные системы?
4. В чем заключаются особенности дисперсионного анализа методом световой микроскопии.
Лекция 6
План
1. Поверхностное натяжение жидкостей.
2. Поверхностная энергия Гибсса. Поверхностная активность.
3. Поверхностно-активные вещества.
4. Свойства поверхностных пленок. Смачивание. Растекание. Когезия.
Адгезия. Флотация.
5. Работы П.А. Ребиндера
Роль поверхностных явлений в дисперсных системах исключительно велика. Многие специфические свойства дисперсных ситцем объясняются их огромной удельной поверхностью, благодаря которой факторы, связанные с гетерогенностью, приобретают большое значение.
Границу между фазами рассматривают в виде математической поверхности или в виде промежуточного слоя. Эта граница обладает особыми свойствами, которые определяются различием энергетических характеристик молекул на поверхности и в объеме фазы.
И. Ленгмюр предложил метод оценки энергии межмолекулярного взаимодействия в объеме фазы и на ее поверхности. Молекулу жидкости он представил кубиком с длиной ребра d. Было сопоставлено, что энергия, идущая на дробление жидкости соизмерима с теплотой испарения Lисп в пересчете на единицу объема. Следовательно,
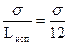
Величину d можно приблизительно определить по формуле
d = 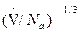 ,
,
где 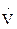 - объем, занимаемый одним молем жидкости; NA – постоянная Авогадро, s - коэффициент поверхностного натяжения.
- объем, занимаемый одним молем жидкости; NA – постоянная Авогадро, s - коэффициент поверхностного натяжения.
Формула имеет приближенный характер, так как в ней не учитывается форма молекул и их неоднородность.
Молекулярное притяжение зависит от расположения. Например для молекулы масляной кислоты Н3С – СН2 – СН2 – СООН энергия взаимодействия углеродных цепей Н3С – СН2 – СН2 – друг с другом отличается от энергии взаимодействия полярных групп – СООН и энергии взаимодействии между полярными и углеводородными частями молекул.
Поверхностное натяжение жидкостей на границе с газом. Для определения термодинамических характеристик рассмотрим некоторые соотношения.
Если состав равновесных фаз постоянен, то частная производная энергии Гиббса по площади раздела фаз при постоянных температуре и давлении, представляет собой поверхностное натяжение s. Его можно также определить как частную производную энергии Гельмгольца, внутренней энергии и энтальпии по площади поверхности раздела фаз. В соответствии с этим
s = (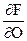 ) V,T,ci
) V,T,ci  = (
= ( ) p,T,c = (
) p,T,c = (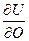 ) V,S, c = (
) V,S, c = (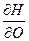 ) p, S, c
) p, S, c


где G – энергия Гиббса, F – энергия Гельмгольца, H – энтальпия, U – внутренняя энергия, S – энтропия, T – температура, p – давление, c – концентрация вещества в фазах. О – площадь раздела фаз. Все функции и параметры относится к системе в целом.
Из данного определения поверхностного натяжения следует, что при постоянном отношении соответствующих параметрах и концентрациях увеличение площади поверхности раздела фаз в квазистатическом процессе сопровождается работой dWкв, причем
dWкв= - s d O; s = - dWкв / dО
Таким образом, поверхностное натяжение численно равно работе квазистатического процесса по созданию поверхности раздела фаз, отнесенной к единице площади этой поверхности и взятой со знаком минус.
Уравнения лежат в основе ряда методов экспериментального изучения поверхностного натяжения. Такими методами являются модельные эксперименты Дюпре по отрыву рамки в цилиндре.
s = 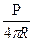 ,
,
где Р масса груза, r(R) радиус цилиндра.
Межфазное натяжение на границе жидкость-жидкость. Для определения коэффициента межфазного на границе жидкость – жидкость применимы методы, в основе которых измерение высоты поднятия жидкости в капиллярах, геометрические размеры капель, пузырьков и т.п., которые относятся к категории статистических. Их используют, если условия измерений можно считать равновесными. Отличие только в использовании разности плотностей жидкости (вместо плотности одной для границы жидкость – газ).
s = sА + sВ – 2Ф(sАsВ)
В уравнении величина Ф является функцией упаковки молекул и молярных объемов жидкостей. Обычно Ф = 0,5 ¸ 1,2.
Растекание. Возьмем две взаимно нерастворимые жидкости. А и В. Пусть под жидкостью А, имеющей большее поверхностное натяжение, подразумевается вода. Нанесем на ее поверхность каплю масла. sАВ – коэффициент межфазного натяжения между жидкостями. sА – коэффициент поверхностного натяжения воды на границе с воздухом, sВ – коэффициент поверхностного натяжения масла на границе с воздухом. При протекании самопроизвольных процессов должно наблюдаться уменьшение энергии Гиббса. При неизменном составе фаз и при Р =const и T= const
dG =S sI dO
т. е. изменение энергии Гиббса системы равно сумме произведений соответствующего коэффициента поверхностного или межфазного натяжения на границе жидкость – жидкость. Если поверхность раздела вода – масло увеличить на dO, то на столько же увеличится площадь раздела масло – воздух и сократится площадь раздела вода – воздух.
dG =(sАВ + sВ – sА) dO,
Для процесса самопроизвольного увеличения поверхностного контакта вода – масло (dG<0, dO>0) получим
sАB + sВ – sА < 0.
Самопроизвольное увеличение площади границы масло – вода называется растеканием. Растекание возможно, если
S = sА – sВ – sАB > 0.
Хорошо растекаются на поверхности воды высшие спирты R – OH, органические кислоты R – СОOH и их соли R – СОOМе, амины R – NH2,
сульфокислоты R – SО3H. не растекаются на поверхности вазелиновое и машинное масло. Эти жидкости сохраняют размер и форму капли неизменными.
На воде
н – Октиловый спирт......36,7
Олеиновая кислота....... 24, 6
Анилин................ 24,4
Вазелиновое масло......– 13,5
Керосин............... – 13,6
Адгезия и когезия. Флотация Ребиндер.
Работа, затрачиваемая на преодоление сил сцепления между молекулами однородной жидкости и приводящую к возникновению к возникновению двух новых поверхностей раздела фаз жидкость – газ с площадью каждой из них 1 м2, называют работой когезии
Смачивание. Если каплю жидкости поместить на твердую поверхность, то через некоторое капля принимает форму, зависящую как от ее размеров и плотности жидкости, так и от характера взаимодействия жидкости с поверхностью. Поверхность контакта жидкости с плоской поверхностью ограничена линией, называемой периметром смачивания. В каждой точке периметра смачивания соприкасаются три фазы: твердая жидкая и газообразная. Силы поверхностного натяжения на границах трех фаз характеризуется направлениями. Если из точки О (соприкосновение трех фаз) провести касательную, то механическое равновесие капли определяется тем, что проекции всех сил будут равны нулю.
Юнгом (1804) была выведена формула:
cos q = 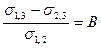 ,
,
где q - краевой угол смачивания, действующий между направлением силы по касательной s1,2 и поверхностью s1,3; В = cos q называется критерием смачивания. Его значение находится в пределах +1 или = В > или = -1. В случае, если В > 0 считают, что жидкость смачивает поверхность. При В < 0 жидкость не смачивает поверхность.
Практическое значение смачивания. Смачивание имеет большое значение для успешного проведения ряда важнейших технологических процессов. На пример в таких процессах, как стирка, пропитка и флотация.
Флотация – метод обогащения полезных ископаемых. В основе этого метода лежит использования различий в смачивании разделяемых частиц водой.
Гидрофильные частицы смачиваются водой и под действием поверхностного натяжения на границе вода – воздух или вода – масло частица втягивается в воду. Наряду с силой поверхностного натяжения на частицу действует и сила тяжести. В результате частица, смачиваемая водой, целиком перейдет в водную фазу и потонет.
Гидрофобные частицы вода не смачивает, и под действием поверхностного натяжения на границе вода – воздух или вода – масло частица может остаться на границе раздела, если только она не слишком велика сила тяжести не превысит флотационную силу. Измельчая минерал до нужной дисперсности, всегда можно подобрать размер частиц, при котором частицы будут оставаться на поверхности, поскольку при дроблении сила тяжести уменьшается прямо пропорционально кубу радиуса частицы. В тоже время флотационная сила снижается прямо пропорционально первой степени радиуса.
Флотационное обогащение руд полезных ископаемых основано на том, что сернистые соединения, в которых металлы находятся в руде, обладают большей гидрофобностью, чем пустая порода, например кварц. В настоящее время широкое применение получила так называемая пенная флотация. Она заключается в том, что в суспензию минерала – флотационную пульпу – тем или иным способом вводят пузырьки воздуха. При всплывании пузырьки собирают по своей поверхности те частицы руды, на которых вода образует большой краевой угол. В результате на поверхности пульпы образуется минерализованная пена. Эту пену самотеком или с помощью специальных гребков удаляют с поверхности пульпы в виде концентрата руды. Хорошо смачиваемые водой частицы пустой породы не прилипают к пузырькам, оседают на дно и образуют отходы флотации, так называемые «хвосты».
Работы П.А. Ребиндера связаны с классификацией коллоидных структур, с понятиями о лиофильных золях, с правилом уравнения полярности, с самопроизвольном возникновении двухфазных систем, с структурно-механическом факторе стабилизации, с эффектом диспергировании под влиянием адсорбции.
Контрольные вопросы
1. Что такое поверхностное натяжение жидкостей?
2. Поверхностная энергия Гибсса. Поверхностная активность. Правило Траубе.
3. Поверхностно-активные вещества и их свойства.
4. Какими свойствами обладают поверхностные пленки.
5. Что такое смачивание, растекание, когезия, адгезия, флотация?
Лекция 7
План
1. Сорбция. Адсорбция. Изотерма сорбции. Природа адсорбционных сил. Капиллярная конденсация.
2. Физическая адсорбция. Хемосорбция.
3. Тепловой эффект адсорбции, интегральная, дифференциальная теплота адсорбции.
4. Адсорбенты: угли, гели, цеолиты.
Адсорбция. Адсорбцией называется концентрирование, какого – либо вещества в поверхностном слое в результате самопроизвольного перехода его из объема фазы.
Адсорбционное равновесие определяется двумя процессами: притяжением молекул к поверхности под действием межмолекулярных сил и тепловым движением, стремящимся восстановить равенство концентраций в поверхностном слое и объеме фазы. Количественно адсорбцию характеризуют числом молей или массой вещества, накопленного на границе фаз, в расчете на единицу площади поверхности раздела: моль/м2, кг/м2, м3/м2 . адсорбция наблюдается на поверхности раздела фаз: твердое вещество – жидкость, твердое вещество – газ, жидкость – жидкость и жидкость – газ. Твердое вещество, на поверхности которого происходит адсорбция, называется адсорбентом. Часто количественно адсорбцию на твердой поверхности выражают в молях на 1г адсорбента. Вещество, концентрирующееся на границе раздела фаз называют адсорбтивом или адсорбатом.
Адсорбция – одно из проявлений более общего процесса сорбции. Хемосорбция – на поверхности образуется химическое соединение. Поглощение вещества объемом фазы называется абсорбцией. На скорость абсорбции существенно влияет адсорбционный слой.
Различают два вида адсорбции: адсорбцию на твердой поверхности и адсорбцию в поверхностном слое жидкости. Способ вычисления энергии адсорбции разработан Гиббсом.
Основные закономерности адсорбции выявляются наиболее отчетливо для водных растворов ПАВ на границе с газом (воздухом). Главное следствие адсорбции – уменьшение поверхностного растворителя (воды). Поэтому в коллоидной химии используют еще одно определение: ПАВ – это вещество, которое уменьшают поверхностное натяжение (свободную поверхностную энергию) данной фазы – жидкости или твердого тела.
Удельная адсорбция (Г) – самопроизвольное концентрирование вещества на поверхности раздела фаз по сравнению с количеством этого вещества во внутренних объемах фаз А и Б. В коллоидной химии вместо термина «удельная адсорбция» используют термин адсорбция. По определению избыточное число молекул (Dn) в поверхностном слое равно
Dn = [ns – (nA + nB)],
где ns – число молекул ПАВ в поверхностном слое толщиной d;
nA и nB – число молекул ПАВ в объемах фаз А и В соответственно.
Таким образом, удельная адсорбция (Г, моль/м2) определяется уравнением
Г = [ns – (nA + nB)]/(WNA),
где NA – число Авогадро.
Для гетерогенных систем, в которых одной из граничивших фаз является газ, при определении адсорбции ПАВ можно пренебречь концентрацией ПАВ в газовой фазе. Тогда для раствора ПАВ на границе с воздухом можно пользоваться приближенным уравнением
Г = (Сs -C)d,
где Сs – концентрация ПАВ в поверхностном слое толщиной d;
С – концентрация раствора.
На ряду с поверхностной активностью (-ds/dC при С ® 0) для характеристики ПАВ используется еще один термодинамический параметр – работу адсорбции (Wадс), которая равна работе перехода 1 моля ПАВ из внутреннего объема раствора на его поверхность, граничащую с соседней фазой, при постоянной температуре. Для расчета работы адсорбции рассмотрим самый простой случай – разбавленный водный раствор ПАВ в объеме раствора концентрацией С равен
m = m0 + RT ln C
Для разбавленных растворов удельная адсорбция (Г) значительно меньше предельной адсорбции (Гmax), соответствующей насыщенному монослою ПАВ на поверхности раствора. При условии Г << Гmax поверхностный слой толщиной d представляет собой разбавленный поверхностный раствор. Тогда химический потенциал ПАВ в поверхностном слое вещества можно определить обычным соотношением
ms = msо + RT ln Cs,
где Cs – поверхностная концентрация; msо – стандартный химический потенциал ПАВ в поверхностном слое раствора.
Разность стандартного химического потенциала данного ПАВ (m0 - msо) по определению равна работе переноса 1 моля ПАВ из объема на поверхность раствора в стандартных условиях.
Wадс= mo - msо,
Wадс = RT ln (Cs/ С)
Для разбавленных растворов ПАВ выполняется соотношение Cs>> С, поэтому уравнение
Г = Сsd,
где d - толщина поверхностного слоя.
Уравнение работы адсорбции принимает вид
Wадс = RT ln [Г/(dС)].
Уравнение используют для расчета работы адсорбции различных ПАВ по экспериментальным данным. В гомологических рядах ПАВ при переходе к очередному гомологу работа адсорбции возрастает примерно на 3 кДж/моль. Этот результат позволяет объяснить причину увеличения поверхностной активности примерно в 3 – 3,2 раза при удлинении углеводородной цепи в молекуле ПАВ на одну группу – СН2 –.
Теплота адсорбции. Как уже отмечено, физическая адсорбция является экзотермическим процессом. Различают два способа выражения теплоты адсорбции - интегральную и дифференциальную.
Интегральная теплота адсорбции qинт представляет собой общее количество выделившегося при адсорбции тепла, отнесенное к 1 г адсорбента. Очевидно
qинт = Q/m,
где Q – общее количество выделившегося тепла, Дж; m – масса адсорбента, г.
На первый взгляд можно полагать, что теплота qинт должна быть прямо пропорциональна количеству адсорбированного вещества. однако. на самом деле этого нет. Это объясняется тем. Что в начале процесса газ адсорбируется на наиболее активных центрах с максимальным тепловым эффектом, а в конце процесса вступают в действие менее активные центры, при адсорбции на которых выделяется сравнительно мало тепла.
Дифференциальная теплота адсорбции. Допустим, что к данному моменту адсорбировалось на поверхности адсорбента n молей адсорбтива и при этом выделилось Q Дж тепла. Допустим далее, что после адсорбировалось при той же температуре еще дополнительно dn молей адсорбтива и выделилось dQ Дж тепла. Дифференциальная теплота адсорбции qдиф представляет собой отношение этого дополнительно выделившегося тепла к дополнительно адсорбированному количеству адсорбтива, т.е.
qдиф = dQ/ dn
Иными словами, дифференциальной теплотой адсорбции называется тепло, выделившееся при дополнительной адсорбции малого количества адсорбтива и пересчитанное на 1 его моль. Единицами измерения дифференциальной теплоты адсорбции в соответствии с уравнением является Дж/моль (адсорбтива)
Твердые адсорбенты. Твердые материалы, используемые для адсорбции из газовой фазы и растворов, обладают высокой удельной поверхностью. В них содержится огромное число пустот, объемы которых во много раз меньше объема частиц, твердого вещества. именно пустоты, называемые порами обеспечивают характерные свойства твердых адсорбентов. Пространство твердой фазы, в котором содержатся поры, называется матрицей или скелетом. Поры могут сообщаться или с другими порами и внешней средой, или только с внешней средой, или вообще не сообщаться ни с другими порами, ни с внешней средой. Соответственно они называются сквозными, тупиковым и замкнутыми. Пространство открытых пор (сквозных и тупиковых) называется активным. В нем протекают сорбционные процессы.
Наиболее распространенными твердыми адсорбентами являются высокопористые углеродные материалы – активированные угли. Их получают из древесины и других растительных материалов (соломы, скорлупы орехов, морских водорослей). Тканей и крови животных, торфа, ископаемых углей, полимерных смол и пр.
Вторую большую группу составляют силикатные сорбенты. В их число входит силикагель. Получаемый высушиванием геля кремниевой кислоты. его скелет состоит из связанных друг с другом очень мелких шарообразных частиц SiO2. При определенных условиях синтезируются также алюмосиликаты особой каркасной структуры. В решетках кристаллов которых имеются полости. Такие алюмосиликаты называются цеолитами. Поры в цеолитах имеют размеры небольших молекул (около 1 нм).
Контрольные вопросы
1. В чем заключается поверхностная активность?
2. Дайте характеристику сорбции, адсорбции.
3. Природа адсорбционных сил. Капиллярная конденсация..
4. Виды адсорбции. Физическая адсорбция. Хемосорбция. 5. 5. Охарактеризуйте тепловой эффект адсорбции. Интегральная, дифференциальная теплота адсорбции.
6. Адсорбенты: угли, гели, цеолиты и их адсорбционные свойства.
Лекция 8
План
1. Адсорбция на границе жидкость-газ и жидкость- жидкость.
2. Уравнение изотермы адсорбции Гибсса. Адсорбция на твердых адсорбентах.
3. Теория адсорбции. Экспериментальное изучение адсорбции из растворов твердыми адсорбентами.
4. Полимолекулярная адсорбция. Теория Поляни и БЭТ.
Адсорбция из смесей. Адсорбция ионов. При растворении какого-либо вещества в растворителе возможно три различных случая.
Теория мономолекулярной адсорбции Ленгмюра.
Важнейшее следствие адсорбции ПАВ заключатся в том, что концентрация ПАВ в поверхностном слое раствора (Сs) значительно больше концентрации в объеме раствора (С): Сs >> С. Поскольку молекулы ПАВ не закреплены на поверхности, возможен их переход из поверхностного слоя в объем раствора.
Адсорбция ПАВ, таким образом, определяется конкуренцией двух процессов, которые идут в противоположных направлениях;
1) движение молекул ПАВ из объема на поверхность раствора (адсорбционный поток ia); этот процесс стимулируется энергетически – уменьшением поверхностного натяжения раствора в соответствии с уравнением адсорбции Гиббса.
2) движение молекул ПАВ с поверхности в объем раствора, обусловленное более высокой концентрацией ПАВ в поверхностном слое раствора (десорбционный поток id); поскольку десорбция ПАВ направлена на выравнивании концентраций.
Адсорбционное равновесие на поверхности раздела фаз раствор ПАВ – газ носит не статистический характер, а динамический характер. Поэтому количество ПАВ в поверхностном слое определяется соотношением потоков адсорбции и десорбции. Теория Ленгмюра построена на упрощенной модели процессов адсорбции и десорбции ПАВ.
Удельная адсорбция имеет предельное значение (Гmax), которое достигается при образовании насыщенного монослоя ПАВ. Доля поверхности f, занятая молекулами ПАВ, будет равна  f = Г/Гmax. Доля «свободной» поверхности, которая доступна для адсорбции дополнительных молекул ПАВ, равна 1 – f = 1 – Г/ Гmax.
f = Г/Гmax. Доля «свободной» поверхности, которая доступна для адсорбции дополнительных молекул ПАВ, равна 1 – f = 1 – Г/ Гmax.
Скорость адсорбции (ua, моль/(м2. с)) – количество ПАВ которое выносит адсорбционный поток на единицу площади поверхности раствора в единицу времени. Скорость адсорбции пропорциональна концентрации ПАВ (С) в растворе и доле (1 – f) доступной поверхности:
ua = КaС (1 – Г/Г max),
где Кa – константа скорости адсорбции, л/(м2× с).
Скорость десорбции (u d) пропорциональна только поверхности f, занятой адсорбционными молекулами, так как в объеме раствора всегда есть свободной место для размещения десорбционных молекул:
u d = Кdf,
где Кd – константа скорости десорбции, моль/(м2× с).
 Решая предыдущие уравнения, получаем уравнения адсорбции Ленгмюра
Решая предыдущие уравнения, получаем уравнения адсорбции Ленгмюра
Г = Г max 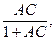

где А – коэффициент, равный отношению констант скоростей адсорбции и десорбции:
А = Кa/ Кd;
Коэффициент А имеет размерность обратной концентрации.
Динамическое уравнение адсорбции Ленгмюра в сочетании с терм<






