Под кислотно-основным состоянием (КОС) подразумевается соотношение концентраций водородных (Н+) и гидроксильных (ОН) ионов в биологических средах. Необходимым условием существования живого организма является поддержание постоянства этого параметра внутренней среды. От величины рН зависят стабильность мембран, функции ферментов, диссоциация электролитов, нервно-мышечная возбудимость и проводимость, комплексообразование и другие процессы.
Белковый, липидный, углеводный обмены являются источниками образования летучих (угольная) и нелетучих кислот (фосфорная, серная, пировиноградная, молочная и др.), часть из которых претерпевает дальнейшее окисление; небольшое количество кислых эквивалентов удаляется из организма в свободном состоянии или в виде солей. Основные соединения (ОН-, креатинин и др.) образуются в организме в значительно меньших количествах.
Тенденция к увеличению концентрации Н+ (и соответственно снижению рН) традиционно называется ацидозом; тенденция к снижению концентрации Н+ (повышению рН) получила название «алкалоз». Значения рН крови ниже 6,8 и выше 8,0 считаются несовместимыми с жизнью и в клинике практически не встречаются.
Механизмы регуляции КОС весьма эффективны и способны компенсировать значительные сдвиги рН.
КОС в организме характеризуется такими основными показателями, как:
1. Актуальный рН - отрицательный десятичный логарифм концентрации водородных ионов - является интегральным показателем кислотно-основного состояния. В норме рН артериальной крови составляет 7,35-7,45, венозной - 7,26-7,36.
2. Парциальное давление (напряжение) углекислого газа в крови (рСО2) отражает концентрацию углекислоты (под термином «углекислота» подразумеваются различные соединения двуокиси углерода в крови). Напряжение углекислого газа в артериальной крови (раСО2) в норме составляет 4,7-6,0 кПа, в венозной - 6,1-7,7 кПа.
3. Парциальное давление (напряжение) кислорода в крови (рО2)
отражает концентрацию растворенного в крови кислорода. Напряжение О2 в артериальной крови (раО2) составляет в норме 12,0- 12,6 кПа, в венозной - 4,6-6,0 кПа.
4. Стандартный бикарбонат плазмы крови (SB) - концентрация бикарбоната в плазме крови, уравновешенной при 37 °С со стандартной газовой смесью при рСО2=5,33 кПа и рО2 >13 кПа, - в норме составляет 21,3-21,8 ммоль/л.
5. Буферные основания крови (ВВ) - сумма анионов буферных систем, в основном ионов бикарбоната и анионов белков, - в норме составляет 40-60 ммоль/л.
6. Нормальные буферные основания крови (NBB) - показатель, определяемый при рН=7,38 и рСО2=5,33 кПа.
7. Избыток (или дефицит) оснований (ВЕ) - показатель избытка (или недостатка) буферных мощностей (ВВ-NBB) - в норме колеблется от +2,3 до -2,3 ммоль/л.
Стабилизация КОС организма обеспечивается буферными системами (бикарбонатная, фосфатная, белковая и гемоглобиновая), а также функционированием специфических физиологических механизмов компенсации КОС в некоторых органах (легкие, почки, печень, желудочно-кишечный тракт, костная ткань).
1. Бикарбонатная буферная система (10% от буферной емкости крови) представляет собой сопряженную кислотно-основную пару, состоящую из молекул угольной кислоты Н2СО3, играющей роль донора протона, и бикарбонат-ионов НСО3- (во внеклеточной жидкости в виде натриевой соли NaНСО3, во внутриклеточной - КНСО3). Концентрация недиссоциированных молекул Н2СО3 в крови незначительна и находится в прямой зависимости от концентрации растворенного СО2, поэтому известное уравнение Гендерсона-Хассельбаха1 для бикарбонатной системы представимо в следующем виде:
рН=рК а + lg(НСО 3- ] / [СО 2 ]).
Отношение концентраций Н2СО3 и НСО3- в крови в норме составляет 1:20. Эта буферная система эффективно функционирует при значениях рН около 7,4.
2. Фосфатная буферная система (только 1% от буферной емкости крови, при этом ее роль в тканях, особенно в почках, весьма существенна). В ее состав входят однозамещенный фосфат Н2РО4- (донор протона) и двузамещенный фосфат НРО42- (акцептор протона), соотношение которых в норме - 1:4. Фосфатный буфер спо-
1 Уравнение Гендерсона-Хассельбаха выражает рН буферного раствора через константу диссоциации Ка и соотношение концентраций акцептора и донора протонов: рН = рКа + ^([акцептор протонов] / [донор протонов]).
собен оказывать влияние на концентрацию протонов в растворе в диапазоне рН от 6,1 до 7,7, наиболее эффективен при рН = 7,2.
3. Белковая буферная система наиболее эффективна в области значений рН от 7,2 до 7,4. Белки, являясь амфотерными электролитами за счет наличия в составе их молекул свободных кислотных и основных групп, в кислой среде связывают ионы водорода, в щелочной - отдают.
4. Гемоглобиновая буферная система является наиболее мощной (около 70% буферной емкости крови). Она состоит из ННb и ННbО2 (слабые органические кислоты, доноры протонов) и КНb и КНbО2 (сопряженные основания, акцепторы протонов). Система, состоящая из взаимопревращающихся гемоглобина и оксигемоглобина, функционирует как единое целое.
Буферные системы оказывают компенсаторное воздействие на изменения КОС непосредственно в момент их возникновения, влияние легких сказывается в течение нескольких минут, время восстановления почками физиологического соотношения концентраций компонентов буферных систем и нарушенного КОС измеряется часами.
Выделение СО2 регулируется изменением скорости и объема легочной вентиляции. Увеличение альвеолярной вентиляции приводит к снижению рСО2 в артериальной крови, уменьшение - к увеличению рСО2. В организме человека присутствуют два типа хеморецепторов, принимающих участие в регуляции этого процесса: рецепторы рН в каротидных тельцах и рецепторы, чувствительные к СО2 в продолговатом мозгу, аортальном и каротидных тельцах.
С легочным механизмом регуляции КОС непосредственно связана бикарбонатная буферная система крови, находящаяся в равновесии с газообразным СО2. Накопление в организме угольной кислоты вызывает компенсаторную гипервентиляцию (одышку), приводящую к удалению избытка СО2 с выдыхаемым воздухом. Компенсаторная гиповентиляция при алкалозе приводит к сохранению СО2 и восстановлению запасов Н2СО3 в крови.
Участие гемоглобиновой буферной системы в регуляции КОС связано с кислородтранспортной функцией гемоглобина. Освобождение протона при оксигенировании гемоглобина компенсирует подщелачивание крови в капиллярах легких, обусловленное снижением концентрации СО2. Дезоксигенированный гемоглобин в капиллярах тканей связывает протон и предотвращает понижение рН крови (рис. 12-52).
 Рис. 12-52. Участие гемоглобиновой буферной системы в поддержании кислотно-основного равновесия: А - реакции в капиллярах тканей; Б - реакции в легких (по В. Эллиот, Д. Эллиот, 1999)
Рис. 12-52. Участие гемоглобиновой буферной системы в поддержании кислотно-основного равновесия: А - реакции в капиллярах тканей; Б - реакции в легких (по В. Эллиот, Д. Эллиот, 1999)
Почки участвуют в поддержании КОС, осуществляя регулируемый процесс реабсорбции натрия и секреции протонов. Поддержанию в крови концентрации бикарбоната натрия и выведению избыточного количества протонов способствуют превращения в канальцах почек двузамещенных фосфатов в однозамещенные, бикарбонатов в угольную кислоту, экскреция слабых органических кислот, образование в почках аммиака и использование его для нейтрализации и выведения кислых эквивалентов с мочой (рис. 12-53). Ацидоз увеличивает синтез и экскрецию NН4+ в почках, алкалоз оказывает обратное действие. К факторам регуляции секреции протонов почками относятся напряжение СО2 в артериальной крови (СО2 легко проникает в клетки канальцев и вызывает в них снижение рН, приводящее к повышению секреции Н+), активность карбоангидразы, рН артериальной крови (частично определяющий
 Рис. 12-53. Роль почек в компенсации нарушений кислотно-основного гомеостаза (А- - анион)
Рис. 12-53. Роль почек в компенсации нарушений кислотно-основного гомеостаза (А- - анион)
рН клеток канальцев), паратиреоидный гормон (снижающий активность?+/Н+-обменника), альдостерон. Минералокортикоиды, стимулируя реабсорбцию натрия, облегчают секрецию протонов, кроме того, альдостерон непосредственно активирует Н+-АТФазу, осуществляющую перемещение Н+ в просвет канальцев.
Роль печени в поддержании КОС связана с синтезом в ее клетках белков, относящихся к буферной системе, окислением органических кислот до СО2 и воды, преобразованием лактата в глюкозу и в дальнейшем в гликоген, а также выведением вместе с желчью из организма кислых и щелочных продуктов обмена.
Влияние желудочно-кишечного тракта на КОС организма связано с выделением соляной кислоты в полость желудка и бикарбоната натрия в проток поджелудочной железы (рис. 12-54, 12-55).
Ионы натрия, калия, кальция, магния, содержащиеся в костной ткани, могут обмениваться на ионы водорода, компенсируя аци-
 Рис. 12-54. Участие париетальных клеток желудка в поддержании кислотно-основного равновесия
Рис. 12-54. Участие париетальных клеток желудка в поддержании кислотно-основного равновесия
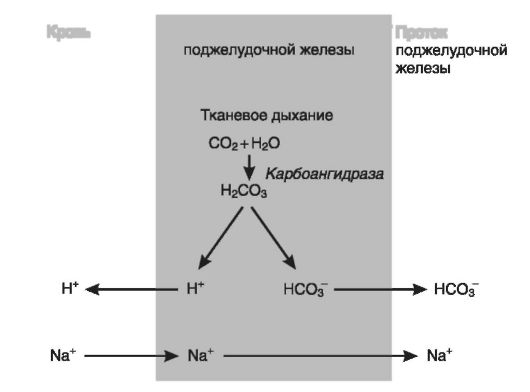
Рис. 12-55. Секреция НСО- клетками поджелудочной железы
доз. В тяжелых случаях этот процесс может приводить к декальцификации скелета.
Различают острые и хронические нарушения КОС. Для компенсации острых нарушений бывают задействованы зачастую только буферные системы организма, в регуляции хронических (установившихся) отклонений рН принимают участие легкие, почки, другие органы и ткани. Ацидозы и алкалозы могут быть компенсированными (компенсаторные механизмы способны поддерживать рН крови в пределах нормы за счет химических и функциональных сдвигов) и декомпенсированными (рН крови соответственно 7,24 и ниже и 7,55 и выше). Промежуточные состояния принято называть субкомпенсированными.
В зависимости от механизмов развития нарушений КОС выделяют газовые (дыхательные, респираторные) и негазовые (метаболические, обменные) ацидозы и алкалозы.
Газовый ацидоз
Газовый (дыхательный, респираторный) ацидоз характеризуется накоплением в крови углекислоты. Причинами острого дыхательного ацидоза могут стать:
1) высокая концентрация СО2 во вдыхаемом воздухе;
2) повышение сопротивления дыхательных путей (бронхоспазм, ларингоспазм, аспирация);
3) нарушения дыхательной функции легких (тяжелая пневмония, пневмоторакс, гемоторакс, отек легких);
4) угнетение дыхательного центра (анестетики, седативные препараты, черепно-мозговая травма, инфаркт головного мозга);
5) нервно-мышечные расстройства (приступ миастении, курареподобные вещества, токсины);
6) системные нарушения кровообращения (сердечная недостаточность, массивная тромбоэмболия);
7) ятрогенные воздействия: неадекватная механическая вентиляция легких, избыточное введение в организм СО2 (карбонаркоз) и др.
Хронический дыхательный ацидоз может быть обусловлен:
1) угнетением дыхательного центра (опухоль мозга, хроническая передозировка седативных препаратов);
2) нарушениями нервно-мышечной передачи (рассеянный склероз, полиомиелит, мышечная дистрофия, повреждения спинного мозга);
3) хроническими обструктивными заболеваниями легких (эмфизема, хронический бронхит);
4) ограничением движений, вызывающим снижение вентиляции (кифосколиоз, ожирение).
При гиперкапнии рН может некоторое время оставаться в границах физиологической нормы за счет действия компенсаторных механизмов. Возрастание парциального давления СО2 ведет к повышению возбудимости дыхательного центра, развитию одышки и выведению из организма избытка углекислого газа в более или менее достаточной степени. Особенностью функционирования буферных систем в условиях газового ацидоза является повышенная емкость бикарбонатного буфера, обусловленная высокой концентрацией в крови СО2. Возрастание концентрации протонов в плазме частично компенсируется белковой и фосфатной буферными системами, часть ионов водорода связывается гемоглобиновым буфером.
В почках ацидозом стимулируется образование и секреция NH4+, а также выведение Н+ в свободном виде. Увеличение выделения почками ионов водорода приводит к реабсорбции больших количеств НСО3-. Задержка почками бикарбоната при хроническом газовом ацидозе вызывает еще большее возрастание его концентрации в плазме, что способствует поддерживанию
нормального или близкого к нормальному значения рН (отмечается компенсаторный метаболический алкалоз). Развитие декомпенсации сопровождается общими нарушениями газообмена, вызванными в том числе снижением сродства гемоглобина к кислороду. Буферная емкость гемоглобиновой системы уменьшается (табл. 12-16, 12-17).
Таблица 12-16. Клинические признаки и лабораторные показатели при нарушениях кислотно-основного состояния (по М. Горн и соавт., 2000)
| Вариант нарушений | рН | рСО2 | [НСО3] | Клинические признаки и симптомы |
| Острый дыхательный ацидоз | Снижен | Повышено | Слабо повышена или норма | Тахикардия, тахипноэ, потливость, головная боль; беспокойство, переходящее в летаргию и кому; цианоз, аритмии |
| Хронический дыхательный ацидоз | Снижен | Повышено | Повышена (компенсаторная реакция) | Диспноэ или тахипноэ с повышением уровня СО2, который превышает компенсаторные возможности; прогрессирование нарушений ЦНС до летаргии, спутанности сознания и комы |
| Острый дыхательный алкалоз | Повышен | Снижено | Без изменений (снижение отмечается при длительном процессе и адекватной функции почек) | Парестезии, особенно в пальцах, головокружение |
| Хронический дыхательный алкалоз | Повышен | Снижено | Снижена (компенсаторная реакция) | Симптомы отсутствуют |
Окончание табл. 12-16
| Острый метаболический ацидоз | Снижен | Снижено (компенсаторная реакция) | Снижена | Тахипноэ, ведущее к дыханию типа Куссмауля; гипотензия, влажная холодная кожа, кома, аритмии |
| Хронический метаболический ацидоз | Снижен | Снижено (но не так сильно, как при остром метаболическом ацидозе) | Снижена | Слабость, анорексия, недомогание (может быть отнесено к проявлению хронического заболевания так же, как и к проявлению ацидоза), декальцификация костей |
| Острый метаболический алкалоз | Повышен | Повышено (почти до 60 - компенсаторная реакция) | Повышена | Мышечная слабость и гипорефлексия (обусловленная выраженной гипокалиемией), аритмии, апатия, спутанность сознания и ступор |
| Хронический метаболический алкалоз | Повышен | Повышено (компенсаторная реакция) | Повышена | Обычно симптомы отсутствуют |
Таблица 12-17. Основные механизмы коррекции нарушений кислотноосновного состояния (по М. Горн и соавт., 2000)


 Нарушение кислородтранспортной функции гемоглобина при респираторном ацидозе приводит к усилению гипоксии, сопровождающейся в дальнейшем присоединением явлений метаболического ацидоза вследствие нарушений процесса тканевого дыхания и накопления недоокисленных продуктов в клетках.
Нарушение кислородтранспортной функции гемоглобина при респираторном ацидозе приводит к усилению гипоксии, сопровождающейся в дальнейшем присоединением явлений метаболического ацидоза вследствие нарушений процесса тканевого дыхания и накопления недоокисленных продуктов в клетках.
При хроническом дыхательном ацидозе приобретает клиническое значение обмен избыточных ионов водорода внеклеточной жидкости на ионы натрия и кальция костной ткани, приводящий к развитию остеопороза.
Гиперкапния приводит к повышению артериального давления за счет возбуждения сосудодвигательного центра - развивается спазм артериол, в первую очередь легочных. Весьма неблагоприятным следствием избытка углекислого газа в крови является спазм бронхиол и выделение больших количеств вязкой слизи, что в еще большей степени ухудшает газообмен и создает дополнительную нагрузку на дыхательную мускулатуру. Ухудшение вентиляции и интенсивная работа дыхательных мышц, увеличивающая продукцию углекислого газа, создают «порочный круг».
При хроническом газовом ацидозе снижение активности адренорецепторов вызывает ослабление сердечной деятельности и падение артериального давления. Большой избыток СО2 может привести к развитию брадикардии, вплоть до остановки сердца, вследствие повышения тонуса блуждающего нерва.
Компенсаторные изменения при респираторном ацидозе служат причиной возрастания показателей ВВ и SB. ВЕ в норме или повышен.
Газовый алкалоз
Газовый (дыхательный, респираторный) алкалоз является результатом альвеолярной гипервентиляции. Синдромом гипервентиляции называется острая альвеолярная гипервентиляция в результа-
те психического возбуждения. К причинам дыхательного алкалоза относятся:
1) гипервентиляция при гипоксии (пневмония, пребывание на высокогорье, выраженная анемия, застойная сердечная недостаточность);
2) центральная стимуляция дыхательного центра (заболевания центральной нервной системы - инсульт, опухоль; прием лекарственных препаратов - салицилаты, агонисты адренорецепторов);
3) легочные расстройства (тромбоэмболия легочной артерии, астма, интерстициальный фиброз);
4) механическая гипервентиляция.
Важнейшим механизмом компенсации гипокапнии является снижение возбудимости дыхательного центра, приводящее к задержке СО2 в организме. Самопроизвольная гипервентиляция не может продолжаться очень долго, поэтому причинами истинного дыхательного алкалоза могут стать только поражения мозга и искусственная вентиляция легких без контроля концентрации СО2 в крови.
Компенсация роста рН осуществляется преимущественно за счет высвобождения протонов из тканевых небикарбонатных буферов. Ионы Н+ перемещаются из клеток во внеклеточное пространство в обмен на ионы калия (возможно развитие гипокалиемии) и образуют при взаимодействии с НСО3- угольную кислоту. Выход протонов из клеток может вызвать развитие внутриклеточного алкалоза.
Уменьшение содержания углекислого газа в эритроцитах повышает сродство гемоглобина к кислороду, затрудняя переход кислорода в ткани, и таким образом способствует развитию гипоксии. Следствием гипоксии при устоявшейся гипервентиляции является развитие метаболического ацидоза, компенсирующего смещение рН.
Хроническая адаптация к развивающемуся алкалозу связана с деятельностью почек: секреция протонов снижается, что выражается уменьшением выведения органических кислот и аммиака. Наряду с этим угнетается реабсорбция и стимулируется секреция бикарбоната, что приводит к уменьшению его уровня в плазме крови и возвращению величины рН к норме (см. табл. 12-16, 12-17).
Снижение рСО2 при газовом алкалозе, воздействуя на рецепторы сосудодвигательного центра, ведет к падению кровяного давления. При длительной гипервентиляции могут наблюдаться явления коллапса с нарушениями со стороны центральной нервной
системы. Развивающаяся в условиях алкалоза гипокальциемия становится причиной повышения нервно-мышечной возбудимости и может приводить к судорожным явлениям (тетании). У пациентов могут отмечаться беспокойство, головокружение, парестезии, сердечные аритмии, в тяжелых случаях наблюдаются спутанность сознания, обмороки.
Показатели ВВ и SВ снижаются при компенсации газового алкалоза, ВЕ обычно в пределах нормы, может быть снижен.
Негазовый ацидоз
Негазовый (метаболический) ацидоз - наиболее часто встречающееся в клинической практике изменение КОС, которое может быть вызвано следующими причинами:
1) нарушениями обмена веществ, приводящими к накоплению кислых продуктов (ацетоуксусная, молочная, β-гидроксимасляная и другие кислоты): кетоацидоз при сахарном диабете, нарушении функций печени, голодании, гипоксии и пр.; лактатацидоз при гипоксии, инфекциях, нарушениях функций печени; накопление органических и неорганических кислот при катаболических состояниях: травмах, ожогах, воспалительных процессах;
2) задержкой кислот или повышенным выведением щелочей при заболеваниях почек (почечный канальцевый ацидоз тип II, диффузный нефрит, обессоливающий нефрит, уремия, интоксикация сульфаниламидами);
3) потерей бикарбоната через фистулы, при диарее, дренировании поджелудочной железы;
4) длительным приемом кислот с пищей или отравлением кислотами, а также приемом некоторых лекарственных препаратов.
Повышение концентрации СО2, обусловленное сдвигом в бикарбонатной буферной системе при изменении pH, вызывает усиление легочной вентиляции (развивается компенсаторный газовый алкалоз). Снижение рН также стимулирует центральные хеморецепторы и способствует гипервентиляции. Значение гипервентиляции, кроме выведения СО2, состоит в насыщении крови и тканей кислородом, необходимым для окисления недоокисленных продуктов.
Избыток Н+ внеклеточной жидкости обменивается на ионы калия эритроцитов и тканевых клеток, концентрация калия в плазме
крови возрастает. Часть протонов переходит в костную ткань в обмен на кальций и натрий, поэтому длительный негазовый ацидоз может приводить к декальцификации костей, особенно если выведение органических кислот и аммонийных солей с мочой ограничено из-за почечной патологии. Истощение бикарбонатной буферной системы уменьшает обмен НСО3- эритроцитов на ионы хлора в венозной крови, приводя к развитию гиперхлоремии.
В почках активно реабсорбируются основания, и в повышенных количествах выделяются кислые эквиваленты, вследствие чего в моче повышается содержание кислот (рН мочи может понижаться до 4,5) и их аммонийных солей, так как в клетках почечных канальцев усилено образование аммиака. Усиленный аммониогенез (приобретающий важное значение при продолжительном негазовом ацидозе) способствует сохранению в организме натрия, калия, кальция и других катионов, в избытке фильтрующихся в клубочках. При ацидозе возрастает распад белков с увеличением содержания свободных аминокислот в крови (см. табл. 12-16, 12-17).
Клинические проявления негазового ацидоза зависят от основного патологического процесса и тяжести нарушения кислотноосновного состояния. Снижение рСО2 крови вследствие гипервентиляции приводит к снижению возбудимости дыхательного центра, возможно появление дыхания Куссмауля, характерного для диабетической, печеночной или уремической комы. Неизбежны нарушения водно-электролитного баланса, связанные с потерей катионов с мочой. При остром ацидозе отмечаются изменения сознания, снижение артериального давления, аритмии и шоковые состояния. В случае значительного повышения концентрации ионов калия в крови при низком содержании их в миокарде возможно развитие фибрилляции желудочков, чему способствует усиленная секреция катехоламинов надпочечниками, стимулируемая снижением рН. Хронический негазовый ацидоз может проявляться слабостью, недомоганием и анорексией, связанными с основным заболеванием.
При метаболическом ацидозе показатели ВВ, SB, ВЕ снижены.
Негазовый алкалоз
Негазовый (метаболический) алкалоз развивается в случае накопления в организме избытка оснований в результате потери ионов водорода или чрезмерного потребления щелочных веществ. К причинам метаболического алкалоза относятся:
1) нарушение выделения НСО3- (молочно-щелочной синдром);
2) введение больших количеств НСО3- (терапия раствором бикарбоната натрия, введение щелочных минеральных вод);
3) накопление в организме НСО3- в результате окисления избыточных количеств солей органических кислот, поступающих с пищей;
4) потеря большого количества соляной кислоты из желудка при неукротимой рвоте;
5) выделение избыточного количества протонов почками при приеме диуретиков, особенно петлевых и тиазидных;
6) хлордиарея - врожденный метаболический алкалоз: патологические изменения в кишечнике, приводящие к потерям хлора и калия;
7) уменьшение содержания калия в организме, вызывающее переход Н+ в клетку и повышение выделения их с мочой.
Увеличение рН при негазовом алкалозе снижает возбудимость дыхательного центра. Гиповентиляция, как и затруднение диссоциации оксигемоглобина в щелочной среде, способствует гипоксии; накопление недоокисленных продуктов наряду с повышенным рСО2 частично компенсирует избыток оснований. Нейтрализация повышенных количеств щелочных эквивалентов частично осуществляется их взаимодействием с угольной кислотой. Увеличение содержания СО2 стимулирует дыхание, и он удаляется из организма, поэтому дыхательная компенсация метаболического алкалоза недостаточна. В почках повышается выделение НСО3-, двузамещенных фосфатов, может развиваться потеря калия, а в тяжелых случаях и натрия. Кислотность мочи и содержание в ней аммиака снижены. Выведению калия почками способствует избыточное образование альдостерона. Развивающаяся гипокалиемия усугубляет алкалоз за счет перемещения части протонов внутрь клеток в обмен на выходящий в межклеточную среду ион калия - параллельно в части тканей развивается внутриклеточный ацидоз (см. табл.
12-16, 12-17).
Сопутствующая гипокалиемия проявляется предсердножелудочковыми аритмиями, мышечной слабостью, гипорефлексией, полиурией и полидипсией, ослаблением перистальтики кишечника вплоть до динамической непроходимости. Наряду с этим наблюдаются признаки повышенной нервно-мышечной возбудимости, спутанности сознания и ступора, а также гиповоле-
мии. Если при алкалозе снижается уровень Са2+, могут развиваться спазмы, симптомы тетании, гипокальциемические судороги.
Недостаток калия в организме может увеличивать потери Н+ с мочой, частично обеспечивающие сохранение калия в плазме. Таким образом, при гипокалиемии наряду с развитием алкалоза у больных может выделяться кислая моча - «парадоксальная ацидурия».
При метаболическом алкалозе показатели ВВ, SB, ВЕ повышены.






