Идеальный газ
Реальный газ
Идеальный газ
1) Объемом, занимаемым молекулами, пренебрегается
2) Силами взаимодействия между молекулами пренебрегается
Связь между давлением, плотностью и температурой описывается уравнением Клапейрона-Менделеева: pW =w RT или p = r RT (1)
где p – давление; W – объем; R = nr; n =1000/M - число молей газа в 1 кг пороха; М =23-25 г/моль; r =8,3143 КДж/(кг.град) – универсальная газовая постоянная; Т – температура газа.
Формула (1) применяется для давлений до 50 МПа.
Реальный газ
1) Объем, занимаемый молекулами, учитывается
2) Силы взаимодействия между молекулами учитываются
Связь между давлением, плотностью и температурой описывается уравнениями Ван-дер-Ваальса, Нобля-Абеля (Дюпре) и вириальным.
Уравнение Ван-дер-Ваальса
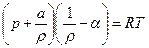 (2)
(2)
где a – коэффициент, учитывающий сцепление между молекулами; a – коволюм газов (дм3/кг), параметр, равный учетверенному собственному объему молекул.
Формула (1) применяется при давлениях в десятки тысяч МПа.
Уравнение Нобля-Абеля (Дюпре)
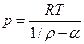 |
(3)
Это частный случай уравнения Ван-дер-Ваальса, в котором параметром и пренебрегается. Формула (3) применяется при давлениях от 50 до 2000 МПа.
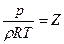 Вириальное уравнение состояния
Вириальное уравнение состояния
, (4)
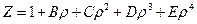 |
где (5)
Z – сжимаемость газа, B, C, D и Е – вириальные коэффициенты, зависящие от температуры газа.
2. Физический смысл газовой постоянной
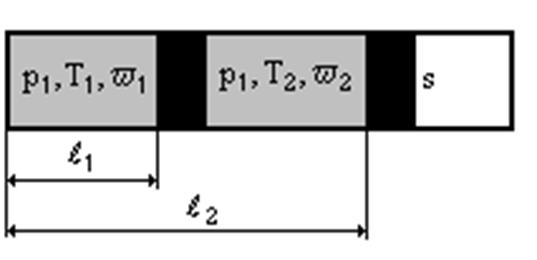
Идеальный поршень (поршень, при перемещении которого не учитываются масса и сила трения) при изменении параметров состояния имеет возможность свободно перемещаться. Для изменения начальных параметров состояния нагреем газ в цилиндре при p 1=const на 1К. В результате поршень переместится из положения I в положение II. При перемещении поршня будет совершена работа A=p1s(l2-l1). Так как sl1=W1, а sl2=W2,то A=p1(W2-W1), и тогда A=R(T1+1), т.е. R= A.
Таким образом, газовая постоянная R по физическому смыслу представляет собой механическую работу, совершаемую единицей массы газа при его нагреве на 1К и расширении при p= const.
Для использования уравнений состояния газов необходимо знать в каждый момент времени массу образовавшегося газа. Ее количество зависит от скорости газообразования при горении пороха.
3. Физическая картина горения пороха. Зоны горения.
Порох – это многокомпонентная твердая система, способная гореть без






